高糖化力白曲霉的复合诱变及固态发酵条件优化
2020-09-28赵志军刘延波葛少华潘春梅孙西玉
赵志军,李 敏,刘延波,刘 宁,葛少华,潘春梅,孙西玉,4*
(1.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州 450046;2.河南牧业经济学院 河南省白酒风格工程技术研究中心,河南 郑州 450046;3.宝丰酒业有限公司,河南 宝丰 467500;4.河南张弓老酒酒业有限公司,河南 宁陵 476733)
白酒是以高粱等淀粉质原料为主料,加入酒曲为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏、储存、勾调而成的蒸馏酒[1]。酒曲作为中国白酒酿造的糖化、发酵和生香剂,其品质对酒的产率和风格有极大的影响[2-3]。麸曲是以麸皮为原料制成的散曲。麸曲能提供大量的休眠酿酒微生物,具有制作周期短、出酒率高、节约粮食、成本低的优点[4-5]。
白曲霉具有糖化能力强、耐酸度高、培养条件粗放等特点[6]。白曲霉麸曲在高酸度、高蛋白酒醅环境中可发挥其糖化酶、酸性蛋白酶高的优势,有利于提高白酒出品率及风味物质的生成[7-9]。糖化酶作为淀粉的水解酶,对白酒产量和质量均有重大影响[10]。糖化酶活力低往往会导致白酒出酒率低,丢糟中淀粉含量高,不仅造成浪费而且加重了副产物处理负担[11-12]。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变通过发射均匀且粒子丰富的等离子体射流,使活性粒子透过细胞膜作用于脱氧核糖核酸(deoxyribonucleic acid,DNA)物质,引起DNA的多样性损伤,细胞启动SOS修复机制,在修复过程中产生种类丰富的错配位点,最终稳定遗传进而获得大量突变株,是一种获得安全性高的优良菌种的可靠方法[13-14]。紫外线诱变(ultraviolet,UV)是常用的诱变手段之一,具有操作简便、效率高、安全性好、突变的性状不易恢复等优点,应用较为广泛[15]。采用复合诱变技术往往比单一诱变效果更好[16]。
该研究以实验室保藏的白曲霉菌株为出发菌株,采用UV-ARTP复合诱变技术进行菌种选育,获得糖化酶活力较高的菌株,并对其进行固态发酵条件优化,旨在进一步提高该菌株的产糖化酶能力,为白酒、食醋等产品的发酵生产提供优质菌种资源,为规模化制曲提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
白曲霉(Aspergillus candidus)Nz 3.602:由河南牧业经济学院河南省白酒风格工程技术研究中心保藏;
麸皮、糠壳、土豆:市售;2 mol/L乙酸-乙酸钠缓冲溶液(pH 4.6)、斐林试剂、1 mol/L氢氧化钠溶液、1 g/L葡萄糖标准溶液、20 g/L可溶性淀粉溶液、0.9%无菌生理盐水等(均为分析纯):国药集团化学试剂有限公司。
1.1.2 培养基
种子液态培养基:将去皮切块后的马铃薯200 g,加1 000 mL蒸馏水,煮沸20 min。用八层纱布过滤,补加蒸馏水至1 000 mL。加入葡萄糖20 g,搅拌溶解后分装。固态基础培养基为在种子液态培养基的基础上补加琼脂20 g。
筛选培养基:可溶性淀粉2.0 g,氯化钠5.0 g,牛肉膏5.0 g,蛋白胨10 g,脱氧胆酸钠2.0 g,琼脂20 g,水1 000 mL。
以上培养基均在121 ℃条件下高压蒸汽灭菌20 min。
固态发酵培养基:250 mL三角瓶装入25 g调整含水率为65%的麸皮,121 ℃高压蒸汽灭菌30 min[9]。
1.2 仪器与设备
ZQLY-300S振荡培养箱:上海知楚仪器有限公司;HH-6数显恒温水浴锅:常州方科仪器有限公司;GH-500隔水式培养箱:北京科伟永兴仪器有限公司;JY2002电子天平:上海菁华科技仪器有限公司;PHS-3C pH计:上海雷磁仪器厂;LDZX-50KBS立式高压灭菌锅:上海申安医疗器械厂;常压室温等离子体诱变育种仪ⅡS:无锡源清天木生物科技有限公司。
1.3 方法
1.3.1 菌株活化、发酵培养及糖化力测定
菌株活化:将-20 ℃甘油管保存的菌株取出在固态基础培养基上划线于28 ℃培养,连续划线培养3代,使菌落形态发育稳定。
种子液培养及三角瓶制曲:挑取一环斜面或平板中菌落直径大且颜色分布均匀的单菌落,接种到含有50 mL种子液态培养基的250 mL三角瓶中,150 r/min、28 ℃培养48 h[17]。取4%的菌液接种于固态发酵培养基中,每隔24 h摇瓶一次,培养3 d,待表面长满孢子时即为三角瓶麸曲[4]。倒于灭菌的牛皮纸上于35 ℃快速烘干,密封袋保存。
糖化力测定:用斐林法[9]测定糖化酶的酶活。糖化酶的酶活定义为:1 g干曲在30 ℃、pH 4.6条件下,反应1 h,将可溶性淀粉分解为1 mg葡萄糖所需要的糖化酶量为1个酶活力单位(U/g)。
1.3.2 UV诱变及筛选
孢子悬浮液的制备:取1支保藏菌株的试管,用适量无菌生理盐水将菌株洗到50 mL含有玻璃珠的三角瓶中,在150 r/min摇床上振荡10 min,以三层无菌擦镜纸将孢子悬浮液过滤至无菌试管并稀释至孢子含量为106个/mL,备用[18]。
UV诱变处理:取10 mL稀释好的菌悬液置入无菌培养皿,开启磁力搅拌器,于15 W紫外线灭菌灯垂直下方30 cm处,分别处理2min、4min、6min、8min、10min、12min、14min、16 min。照射结束后,避光稳定5 min。取适当稀释度的孢子悬浮液0.1 mL,与未诱变的孢子悬浮液分别涂布于固态基础培养基,平行3组,28 ℃培养3 d观察菌落,计数并计算致死率,制作致死曲线,从而得到最佳诱变时间(以致死率为80%~90%所需的照射时间作为参照)[19]。
UV诱变筛选:将诱变处理后的孢子悬浮液涂布于固态基础培养基中,28 ℃避光培养后把单菌落分别挑出编号划线培养,纯培养后将菌株以三点法[20]点种于筛选培养基中,28 ℃培养3 d后用碘液染色,测定菌落直径与透明圈直径,计算透明圈与菌落直径比(HC值),筛选出HC值大的菌株,对其进行固态发酵培养测定糖化酶活力。
1.3.3 ARTP诱变及筛选
孢子悬浮液的制备:将经过UV诱变处理的酶活最高的菌株制备孢子悬浮液,方法同1.3.2。
ARTP诱变处理及筛选方法:将菌悬液均匀涂抹在金属载片表面,用镊子将菌物载片转移到载物台,设定参数为诱变功率120 W、氦气流量10 L/min,等离子体发射源与样品距离为2 mm,操作温度由25 ℃逐步升至35 ℃,分别照射10 s、20 s、30 s、40 s、50 s、60 s,处理后将载片转移到装有1 mL生理盐水的EP管中,振荡洗脱形成新的菌悬液,与未诱变的菌悬液稀释相应倍数分别涂布于固态基础培养基上,28 ℃培养至出现单菌落,计数并计算致死率[14]。选取致死率在80%左右的时间作为诱变处理时间。筛选方法同UV诱变,得到酶活提高的菌株。
1.3.4 传代培养
将诱变筛选出的突变株进行连续6次传代培养,测定各批次糖化酶酶活力,以确定突变菌株的遗传稳定性。
1.3.5 诱变菌株固态发酵产糖化酶条件的优化
单因素试验:固定糠壳添加量5%、原料含水量65%、接种量4%、培养时间3 d和培养温度28 ℃为单因素试验基础条件,以糖化酶活力值为评价指标,选择糠壳添加量(5%、10%、15%、20%、25%)、原料含水量(60%、65%、70%、75%、80%)、接种量(4%、8%、12%、16%、20%)、培养时间(3 d、4 d、5 d、6 d、7 d)、培养温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)5个因素进行单因素试验,考察各因素对产酶能力的影响。
响应面优化:根据单因素结果,选择对发酵产酶影响最显著的3个因素为变量,酶活大小为响应值,运用Design Expert 8.0.6设计3因素3水平共17个试验点的Box-Behnken响应面分析试验。根据响应面分析的结果,配制最佳固态发酵培养基做验证试验。
2 结果与分析
2.1 初始酶活测定
以菌株Nz 3.602作为出发菌株,将其活化后按4%的接种量接种于固态发酵培养基中相同条件下培养3 d,测定菌株糖化酶酶活为566.11 U/g。
2.2 UV诱变选育
以菌株Nz 3.602孢子悬浮液为材料,对最佳的UV照射时间进行探索,得到诱变致死曲线,结果见图1。

图1 菌株Nz 3.602紫外诱变致死曲线Fig.1 Lethal curve of strain Nz 3.602 induced by ultraviolet mutagenesis
由图1可知,随着照射时间的增长,菌株的致死率增大,当照射时间为12 min时,菌株致死率为86.08%,故选择12 min作为UV诱变照射时间。以菌株Nz 3.602作为出发菌株,经过UV照射12 min后涂布于固态基础培养基上,暗条件下28 ℃培养3 d,将单菌落分别挑出,编号为A1~A57。从中挑选出HC值较高的突变株并测定其酶活,结果见表1。
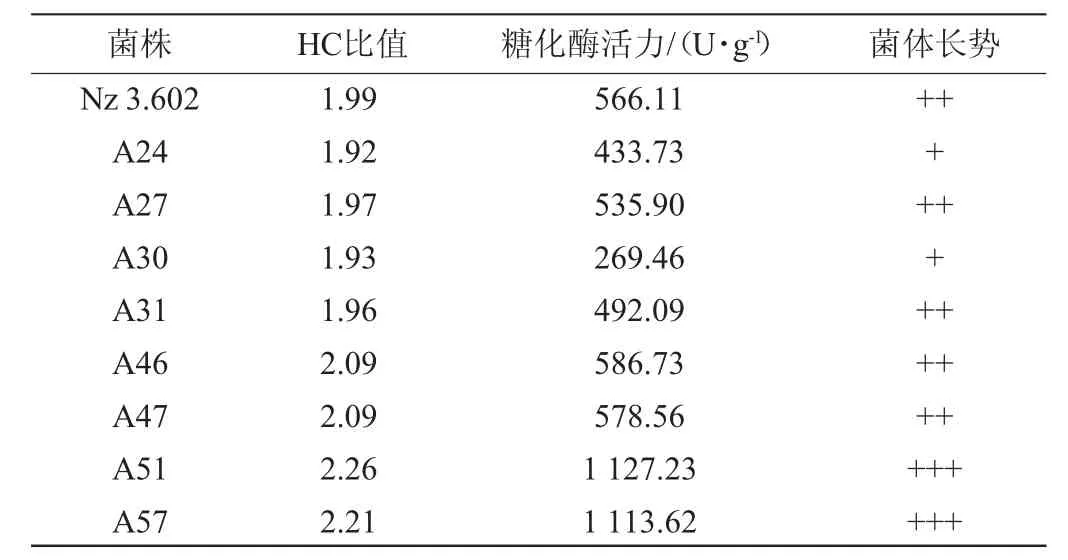
表1 紫外诱变糖化酶高产突变株的HC值及糖化酶活力Table 1 HC value and glucoamylase activity of high yield glucoamylase mutant induced by ultraviolet
由表1可知,菌株A51发酵产糖化酶活力最高,达1 127.23 U/g,较出发菌株提高了99.12%。以糖化酶酶活作为筛选指标,将菌株A51作为ARTP诱变的出发菌株。
2.3 ARTP诱变选育
对菌株A51进行ARTP诱变,测定ARTP致死曲线,结果见图2。

图2 菌株A51的ARTP诱变致死曲线Fig.2 Lethal rate curve of strain A51 induced by ARTP
由图2可知,ARTP处理时间越长致死率越大。在处理40 s时致死率为86.22%,在80%~90%范围内,因此选择40 s作为ARTP诱变的处理时间。
将菌株A51在ARTP仪上诱变处理40 s,稀释涂布于固态基础培养基上,28 ℃培养3 d后将单菌落挑出继续划线纯化培养,共计菌株30株,编号为B1~B30。从中挑选出HC比值较高的突变株并测定其酶活,结果见表2所示。
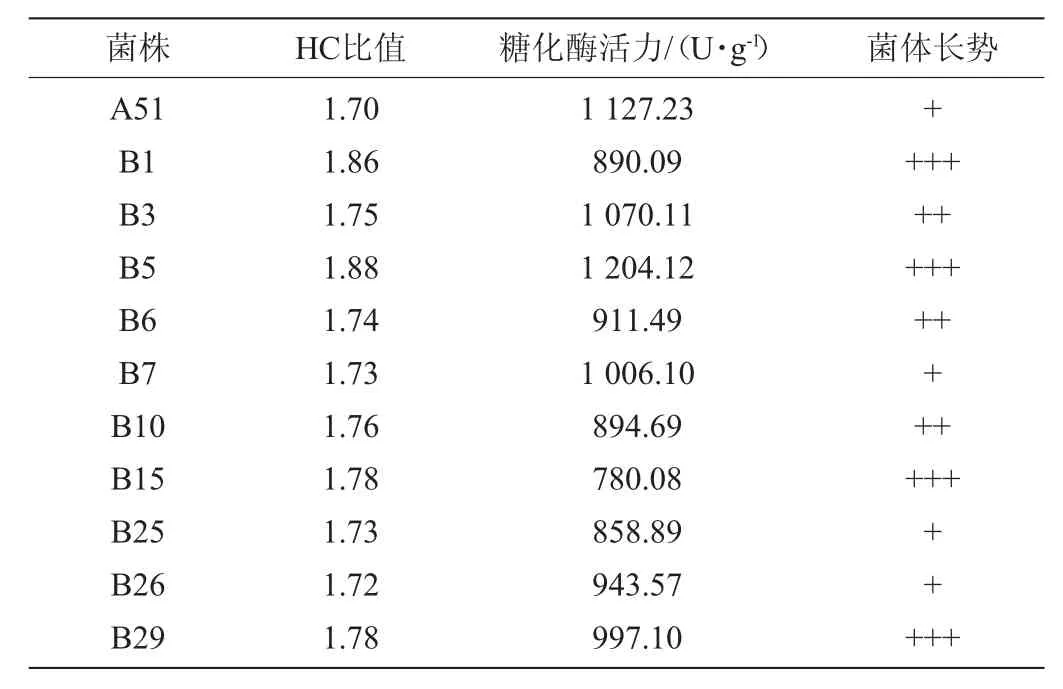
表2 ARTP诱变糖化酶高产突变株的HC值及糖化酶活力Table 2 HC value and glucoamylase activity of high yield glucoamylase mutant induced by ARTP
由表2可知,菌株B5产糖化酶活力最高,达1 204.12 U/g,较菌株A51提高了6.82%,较菌株Nz 3.602提高了112.70%。
2.4 遗传稳定性试验
将高产糖化酶的突变株B5于固态发酵培养基中连续传代培养6次,每批次3个平行,测定每批次的糖化酶酶活力,结果如图3所示。
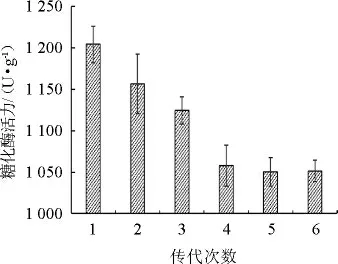
图3 高产糖化酶突变株的遗传稳定性Fig.3 Genetic stability of high yield glucoamylase mutant strain
由图3可知,突变株B5在第5代时的糖化酶活力趋于稳定,为1 050.32 U/g,较出发菌株酶活提高了85.53%。故经UV-ARTP诱变后的菌株B5具有较好的遗传稳定性,可以进行后续发酵试验。同时表明,利用UV-ARTP复合诱变技术是一种能在短时间内选育出遗传稳定的高产糖化酶白曲霉菌株的优良方法,且复合诱变更具优势。
2.5 固态发酵产糖化酶条件优化单因素试验结果
2.5.1 糠壳添加量对产酶活性的影响

图4 糠壳添加量对产酶活性的影响Fig.4 Effect of bran shell addition on enzyme activity
由图4可知,随着糠壳添加量的增加,糖化酶活力先增大后减小。在糠壳添加量为15%时糖化酶活力最大,为1 014.30 U/g。此时曲料疏松度较好,氧气含量高,利于微生物前期增殖和酶的合成。随着糠壳添加量的增加,固态发酵培养基的碳、氮源的分布降低,不利于菌体的生长。故选择最佳的糠壳添加量为15%。
2.5.2 原料含水量对产酶活性的影响
由图5可知,糖化酶活力随着原料含水量的增加呈先增加后降低的趋势。当原料含水量为70%时,糖化酶活力达到最大值为1 243.07 U/g。水分含量过低,培养基后期会较干燥,不利于微生物的生长繁殖及产酶;水分含量过高不利于酶活积累,同时又导致曲料结合紧密,无法充分散热,影响菌株的生长和产酶。故选择原料最佳含水量为70%。
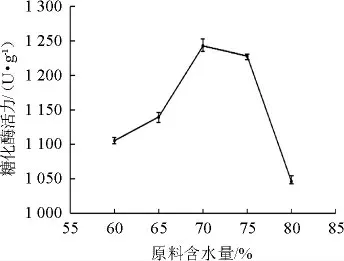
图5 原料含水量对产酶活性的影响Fig.5 Effect of water content of raw materials on enzyme activity
2.5.3 接种量对产酶活性的影响

图6 接种量对产酶活性的影响Fig.6 Effect of inoculum on enzyme activity
由图6可知,糖化酶活力随着接种量的增加先增加后降低。在接种量为12%时,糖化酶活力达到最大值为1 190.60 U/g。当接种量继续增加时,微生物菌丝生长过快,基质消耗大,培养基中营养物质有限,产酶量急剧下降。故选择最佳接种量为12%。
2.5.4 培养时间对产酶活性的影响
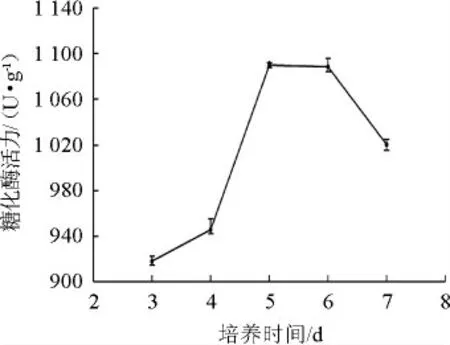
图7 培养时间对产酶活性的影响Fig.7 Effect of culture time on enzyme activity
由图7可知,糖化酶活力随着培养时间的增加先增加后降低。在培养时间为5 d时,糖化酶活力达到最大值为1 190.33 U/g。当时间继续增加时,受微生物生长周期和培养基中营养成分含量的限制,出现酶大量失活现象,产酶总量下降。故选择最佳培养时间为5 d。
2.5.5 培养温度对产酶活性的影响

图8 培养温度对产酶活性的影响Fig.8 Effect of incubation temperature on enzyme activity
由图8可知,白曲霉糖化酶活力伴随着温度的上升呈现出先增加后降低的趋势。在培养温度为30 ℃时,糖化酶活力达到最大值为1 146.34 U/g。当温度继续升高时,微生物的生长和产酶受较大限制,产酶量下降。故选择最佳培养温度为30 ℃。
2.6 响应面试验优化
2.6.1 响应面试验设计与结果
以固态发酵培养基中的原料含水量、接种量和培养温度为因素,糖化酶活力为响应值进行优化试验。响应面Box-Behnken试验设计及结果见表3。

表3 发酵条件优化Box-Behnken试验设计及结果Table 3 Design and results of Box-Behnken experiments for fermentation conditions optimization
2.6.2 模型方差分析及响应面分析
采用Design Expert 8.0.6软件对表4数据进行二次回归方程拟合,得到糖化酶活力(Y)对原料含水量(A)、接种量(B)及培养温度(C)的多元二次回归方程:Y=1 250.45+44.09A+8.17B-30.51C-22.12AB-33.60AC-16.82BC-173.60A2-178.92B2-123.96C2。

表4 响应面试验回归模型方差分析Table 4 Variance analysis of regression mode for response surface experiments
从表4可看出,模型极显著(P<0.000 1),失拟项不显著(P=0.094 5>0.05),决定系数R2=0.964 9,说明有96.49%的响应值变化可以用模型来解释;变异系数(coefficient of variation,CV)为1.22%,说明变异(偏离)程度较小。因此,该回归模型预测值与实测值有较好的拟合水平,适用于对白曲霉固态发酵条件进行分析和预测。
2.6.3 各因素响应面交互作用分析
根据回归方程绘制响应面分析图,以确认原料含水量、接种量和培养温度对糖化酶活力的影响,响应面曲面和等高线见图9。
通过Design Expert 8.0.6软件分析,在250 mL三角瓶中加入麸皮25 g、糠壳15%、培养时间5 d的基础条件下,最佳发酵条件为原料含水量70.70%、接种量12.08%、培养温度29.71 ℃,此时糖化酶活力的理论值为1 255.80 U/g。
考虑到实际操作可行性,本试验在250 mL三角瓶中加入麸皮25 g、糠壳15%、培养时间5 d的基础条件下调整发酵最优条件为原料含水量70%、接种量12%、培养温度30 ℃。
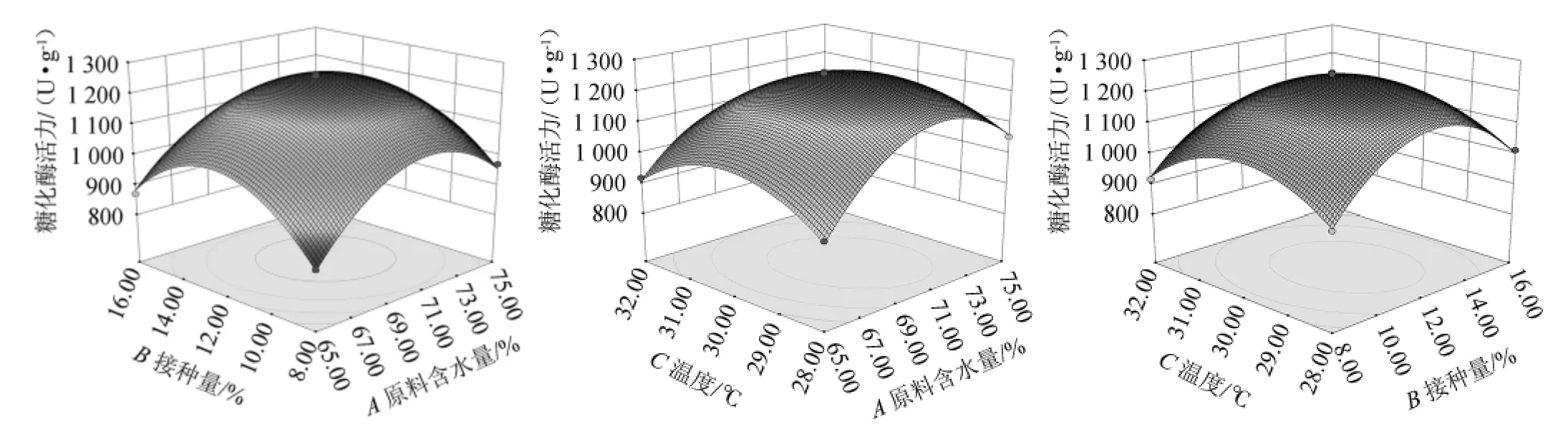
图9 各因素交互作用对曲糖化酶活力影响的响应面和等高线图Fig.9 Response surface plots and contour lines of effects of interaction between each factor on glucoamylase activity
2.6.4 模型验证
依据上述通过响应面分析获得的最优发酵条件方案对突变株B5进行发酵试验验证,测得的糖化酶活力为(1254.17±6.14)U/g,较优化前提高了19.41%,验证结果与响应面试验预测结果基本一致,说明所构建模型能够较真实反映各因素对糖化酶活力的影响,优化条件方案可行。
3 结论
本研究利用UV-ARTP对白曲霉Nz 3.602进行复合诱变处理,在紫外线照射12 min,ARTP处理40 s的条件下,获得了一株高产糖化酶白曲霉菌株B5。经响应面优化菌株的发酵条件,结果表明,在250 mL三角瓶中加入麸皮25 g,糠壳15%、培养时间5 d的基础条件下,获得最优发酵条件为原料含水量70%、接种量12%和培养温度30 ℃。在此条件下菌株B5糖化酶活力达到(1 254.17±6.14)U/g,较出发菌株提高了121.54%,且遗传稳定性能良好。为白曲霉在生产实践中的应用提供了优良菌种来源和理论依据。
