毛果杨赤霉素氧化酶基因家族鉴定与功能分析
2020-09-28修志静管非凡诸葛祥林王一鸣杨海灵
修志静,管非凡,诸葛祥林,王一鸣,杨海灵
(北京林业大学 生物科学与技术学院,北京 100083)
赤霉素(Gibberellins,GAs)是一类广泛存在的重要植物激素。GAs的生物合成与代谢途径研究已经有近百年,取得了突破性进展[1]。GAs参与植物生长发育等多个生物学过程,比如赤霉素可以促进植物茎节间细胞有丝分裂,使细胞长度增加而节间数不变,从而实现茎的伸长[2-3],赤霉素还可以促进下胚轴伸长、叶的伸展和叶片扩大、花的开放、根的生长、表皮毛状体的发育、果实和种子的发育和成熟等[4-7]。在生产中,赤霉素也有广泛的应用,如促进农作物的生长和早熟、提高作物产量、打破种子休眠并增加发芽率、延长贮藏期、改变雌雄花比例、增加种子产量等[8]。林木相关研究表明,赤霉素能影响树木次生木质部细胞的分化,从而在木材形成的过程中发挥作用[9]。
赤霉素的生物合成与代谢是由多种酶参与的多步骤酶促反应过程,它在植物体内的动态平衡是由多种因素直接或间接调控的[10]。前馈调节和反馈调节是赤霉素合成和代谢途径主要的调控方式,通过调控赤霉素合成代谢关键步骤的酶活性从而实现对赤霉素合成代谢的控制[11]。GAs合成代谢通路上涉及的关键酶主要来源于3个基因家族:萜烯合成酶基因家族(TPSs)、细胞色素P450单加氧酶基因家族(P450s)和2-酮戊二酸依赖性双加氧酶基因家族(2ODD)。其中,2ODD基因家族的GA氧化酶(GAox)是赤霉素合成和调控的关键酶,它们主要负责催化不同GAs之间的相互转化[11]。根据酶催化反应作用的碳原子位置的不同,GAox又可以分类为GA2ox、GA3ox和GA20ox等几个亚家族[12]。GA20ox和GA3ox可以催化没有活性的赤霉素GA12和GA53生成具有生物活性的赤霉素GA1和GA4,提高植物体内具有生物活性的GAs的水平,而GA2ox是GAs降解过程中的关键酶,它可以使植物体内具有生物活性的GAs及其前体和其他中间产物分解失活,从而降低植物体内具有生物活性的GAs的水平[13]。到目前为止,大多数研究专注于GA2ox、GA20ox和GA3ox,过量表达的GA20ox会增加植物根的长度以及数量[14],GA20ox和GA3ox的功能缺失突变体可以产生矮化的表型[15-19],同样过表达GA2ox也可以导致植物出现矮化的表型[13,20]。
毛果杨Populus trichocarpa是完成全基因组测序的第一个林木树种,具有重要的经济和生态价值,是林木模式植物[21]。在木本植物毛果杨中,参与赤霉素合成通路的GAox基因还没有得到系统解析。因此,本研究选择毛果杨GAox基因家族为研究对象,整合基因组定位、基因结构、基因表达模式和酶生化活性等数据,探究木本植物GAox基因家族成员的进化关系和功能分化机制。
1 材料与方法
1.1 实验材料
毛果杨植株,由中国林业科学研究院林木遗传育种国家重点实验室曾庆银课题组惠赠。
1.2 ODD基因家族的鉴定
以拟南芥Arabidopsis thalianaODD基因家族成员的蛋白质序列为模板,通过TBLASTN搜索,分别在Phytozome (https://phytozome.jgi.doe.gov/pz/portal.html)和PLAZA (https://bioinformatics.psb.ugent.be/plaza/)下载得到胶球藻C-169(Coccomyxa subellipsoideaC-169)、毛果杨和水稻Oryza sativa基因组中ODD基因家族成员的序列信息。使用NCBI的Conserved Domains数据库进行蛋白质保守结构域分析(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)。
1.3 毛果杨GAox基因家族进化分析
利用MUSCLE(https://www.ebi.ac.uk/Tools/msa/muscle/)对来自胶球藻C-169、拟南芥、水稻和毛果杨ODD基因家族的序列进行比对分析,并用BioEdit进行调整。利用IQ-TREE-1.6.7软件(http://www.iqtree.org/)构建最大似然法(Maximum Likelihood,ML)系统进化树[22],Bootstrap设为1 000,最后用MEGA7对系统进化树进行编辑。
1.4 毛果杨GAox基因家族基本特征和亚细胞定位分析
利用在线软件ExPASy中的pI/Mw(https://web.expasy.org/compute_pi/)预测PtGAox相对分子质量、理论等电点[23]。利用WoLF PSORT(https://www.genscript.com/wolf-psort.html)预测PtGAox基因家族的亚细胞定位。
1.5 毛果杨GAox基因家族基因结构和表达模式分析
利用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)分析GAox基因CDS序列和基因组序列,绘制基因结构图。在PopGenIE (http://v2.popgenie.org/)下载毛果杨GAox基因在成熟叶片、根、节间、幼叶以及节5个部位的表达数据,使用HemI软件(http://hemi.biocuckoo.org/)绘制毛果杨GAox基因表达模式热图。
1.6 毛果杨GAox基因家族表达与纯化
利用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取毛果杨的总RNA,用FastQuant cDNA第一链合成的试剂盒将RNA反转录成cDNA。PCR扩增得到目的基因,连接到pET32a载体转入大肠杆菌BL21(DE3)感受态并测序确认。确认正确的菌株在含羧苄抗性的LB液体培养基中培养至OD600约0.5 h加入终浓度为0.06 mmol IPTG诱导蛋白表达,16 ℃,150 r/min,过夜培养,离心收集菌体(10 000 g/min,3 min,4℃)。用缓冲液A(20 mmol/L 磷酸钠,0.5 mol/L氯化钠,20 mmol/L咪唑,pH值7.4)重悬菌体,进行超声波破碎裂解。通过镍离子亲和层析柱对破碎上清进行纯化,用缓冲液B(20 mmol/L磷酸钠,0.5 mol/L氯化钠,200 mmol/L咪唑,pH值7.4)洗脱目的蛋白。
1.7 毛果杨GAox蛋白酶活测定及三维结构模拟
毛果杨GAox基因家族的蛋白生化性质测定参照Martin DN等方法[24],反应体系包括:245 µL的100 mmol的 反 应 液(Tris-HCl pH值7.4,4 mmol 抗坏血酸,4 mmol 2-酮戊二酸,4 mmol DTT,0.5 mmol 硫酸亚铁,2 mg/mL牛血清蛋白和1 mg/mL过氧化氢),10 μL底物(溶于甲醇),10 μL纯化后的酶。30 ℃反应1 h后加入25 μL的乙酸终止反应,加入等体积的乙腈进行萃取,然后 通 过LC-MS-MRM(AB Sciex QTRAP® 5500 LC/MS/MS)分别对标准品和蛋白反应后的产物进行定性定量分析。在SWISS-MODEL网站(https://swissmodel.expasy.org)中分析GAox蛋白的三维结构,最后利用Discovery Studio 4.5 Client软件进行调整。
2 结果与分析
2.1 毛果杨GAox基因家族的鉴定
为了鉴定毛果杨基因组中参与赤霉素代谢通路的2ODD基因,在PLAZA数据库中搜索并下载得到71个拟南芥、78个水稻、124个毛果杨2ODD基因家族成员的蛋白序列。使用IQTREE-1.6.7,以来自胶球藻C-169(Coccomyxa subellipsoideaC-169)的3个ODD基因为外类群构建了276个2ODD基因的系统进化树(图1)。拟南芥和水稻2ODD基因家族分别有16个和12个GAoxs基因参与赤霉素代谢通路[12]。系统进化树聚类结果支持与拟南芥和水稻GAoxs基因聚在一枝的27个毛果杨2ODD基因为毛果杨GAoxs基因。利用CDD数据库进行蛋白质结构域分析,发现27个毛果杨GAox基因编码蛋白质都含有2ODD基因家族特有的2OG-FeⅡ_Oxy结构域,进一步证明它们属于2ODD基因家族[11,25]。因此最终确定这27个GAoxs基因为毛果杨2ODD基因家族中参与赤霉素代谢通路的关键基因。
2.2 毛果杨GAox基因家族系统进化分析
前人研究指出2ODD基因家族分成不少于8个亚家族,其中至少4个亚家族直接参与高等植物赤霉素代谢通路,即GA3ox、C19-GA2ox、C20-GA2ox和GA20ox亚家族[26]。拟南芥、水稻和毛果杨所有2ODD基因的系统进化树的聚类分析支持将ODD基因家族分成9个不同的亚类(Class I - Class IX)。其中Class I包含4个AtGA3ox,Class II和IV分别包含5个和4个AtGA2ox,Class III包含5个AtGA20ox。根据底物特异性,GA2ox基因分成C19-GA2ox基因和C20-GA2ox基因两类[27]。前人的研究指出,Class II的3个拟南 芥AtGA2oxs蛋 白(AtGA2ox1,AtGA2ox2,AtGA2ox3)能催化C19-GAs[28],属于C19-GA2ox,而Class IV的AtGA2ox7与AtGA2ox8能够催化C20-GAs 前体[29],属于C19-GA2ox。因此,3个物种ODD基因家族系统进化树的Class I、II、III、IV分别代表GA3ox、C19-GA2ox、GA20ox和C20-GA2ox这4个亚家族。本研究根据以上的聚类结果将毛果杨27个GAoxs基因命名为GA3ox1-4、GA20ox1-8、GA2ox1-15(图1B—E)。

图1 水稻、拟南芥和毛果杨2ODD基因家族系统进化树Fig.1 Phylogenetic tree of 2ODD gene family from rice, Arabidopsis and Populus
2.3 毛果杨GAox基因家族的序列特征
毛果杨GAox基因编码蛋白质长度为322~385个aa,编码氨基酸最长的是PtGA20ox7和PtGA20ox8。PtGA20ox7的相对分子质量最大,为44.06 kDa;PtGA2ox4的相对分子质量最小,为35.77 kDa。27个毛果杨GAox蛋白的理论等电点为5.24~8.73。亚细胞定位预测结果显示,12个PtGAox蛋白定位在细胞质,12个PtGAox蛋白定位在细胞核,3个PtGAox蛋白定位在叶绿体,PtGA2ox11和PtGA20ox7定位在细胞核和细胞质,PtGA3ox2定位在线粒体,PtGA2ox7定位在细胞核、细胞质、叶绿体。27个PtGAox基因编码蛋白序列比对分析发现它们都含有与Fe结合的2个组氨酸残基(H)和1个天冬氨酸(D)残基(图2,三角形),与2-酮戊二酸的5-羧基基团结合的精氨酸(R)残基和丝氨酸(S)残基(图2,菱形),活性位点比较保守。
2.4 毛果杨GAox基因家族的染色体定位

图2 毛果杨GAox蛋白活性中心附近氨基酸序列比对Fig.2 Amino acid sequence alignment near the active center of GAox protein

表1 PtGAox基因家族的序列信息Table 1 Sequence information of PtGAox gene family
本研究绘制了毛果杨基因组中参与赤霉素代谢通路的GAox基因家族成员的染色体定位图,杨树最近一次全基因组重复事件后染色体重排产生的同源染色体片段用线性表示,染色体分别由对应的数字(1~19)进行编号。毛果杨GAox基因家族的27个GAoxs基因分散定位在毛果杨19条染色体中的14条染色体上,第9、13、16、17、19染色体上没有任何GAoxs基因(图3)。在27个PtGAox基因中,有11对GAoxs基因(PtGA3ox1, 2;PtGA3ox3, 4; PtGA2ox1, 2; PtGA2ox4, 5; PtGA2ox6,7; PtGA2ox8/9, 10;PtGA2ox11, 12; PtGA2ox13,14;PtGA20ox1, 2;PtGA20ox5, 6; PtGA20ox7, 8)位于染色体共线区域内,可能来源于基因组的大片段重复。在5号和11号染色体上各有一个基因簇(PtGA20ox3, 4;PtGA2ox8, 9),可能来源于基因的串联重复。而PtGA2ox3和PtGA2ox15既不能在同源染色体片段上找到对应的大片段重复基因,又没有形成基因簇,分别分散在4和1号染色体上。
2.5 毛果杨GAox基因家族基因结构与表达模式分析
本研究探讨了27个毛果杨GAoxs基因在成熟叶片、根、节间、幼叶及节5个部位的表达模式,其中有3个基因(PtGA2ox8, PtGA2ox10和PtGA2ox12)没有搜索到表达数据(图4B)。毛果杨有8个GAoxs基因在成熟叶片中的表达量比在根、节间、幼叶和节的表达量高,而有9个、3个、3个和1个GAoxs基因分别在幼叶、根、节间和茎的表达量最高。在成熟叶中PtGA2ox1的表达量最高,而在其他4个部位PtGA2ox7表达量最高,这两个基因都属于C19-GA2ox亚家族。而同一个亚家族的另外5个基因(PtGA2ox2, 3, 4, 5和6)在5个部位的表达量又比较低,因此基因表达在C19-GA2ox亚家族发生了分化。GA3ox亚家族的4个基因在5个部位均有较高量的表达,其中PtGA3ox2在5个部位的表达量均高于PtGA3ox1、PtGA3ox3和PtGA3ox4。不同亚家族的GAoxs基因在5个部位的表达发生了分化。

图3 毛果杨GAox基因的染色体定位Fig.3 Genomic localization of Populus GAox genes
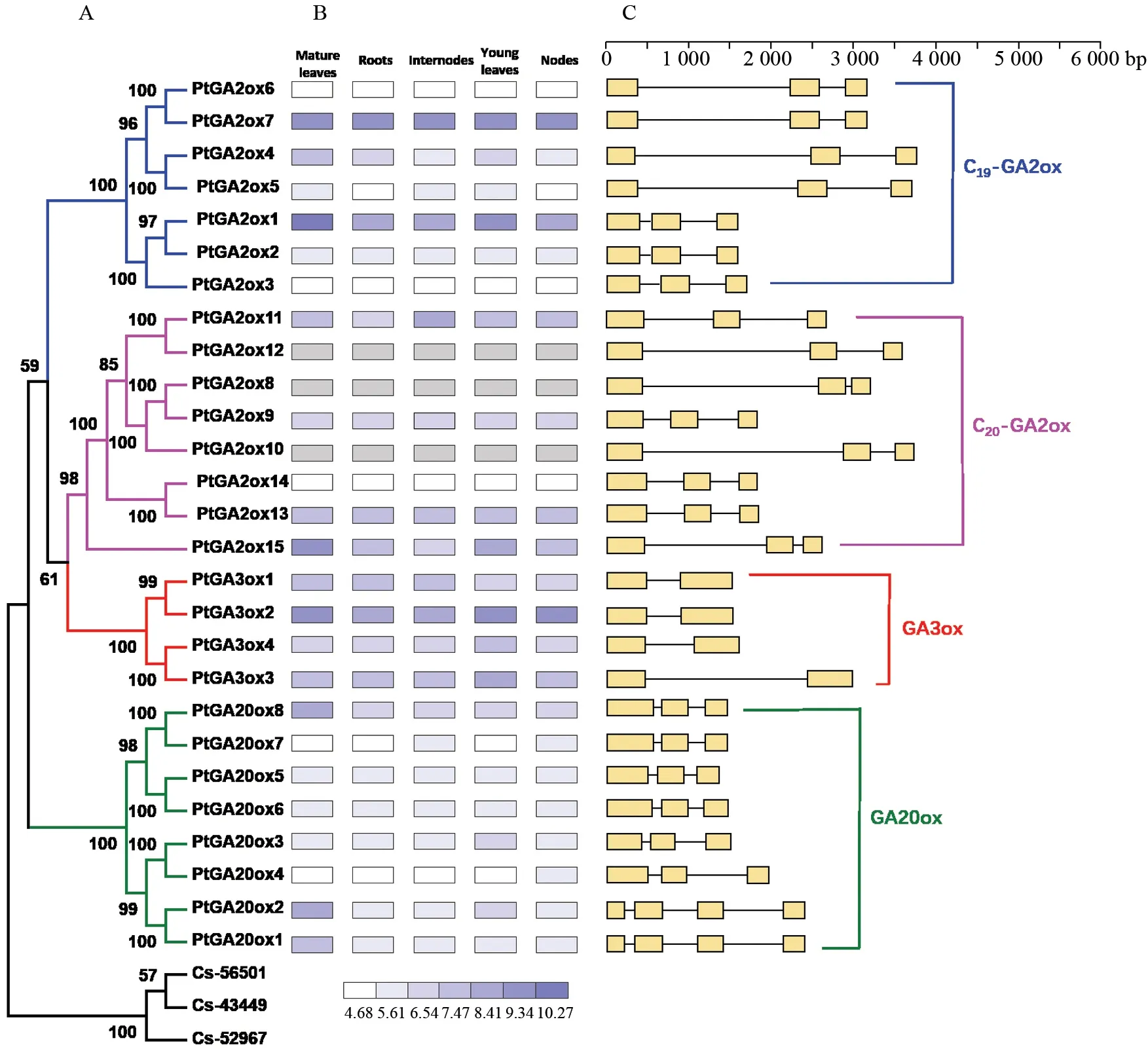
图4 毛果杨GAox基因家族基因结构和表达模式Fig.4 Gene structure and expression pattern of Populus GAox gene family
根据基因外显子和内含子长度,本研究绘制27个GAoxs基因的基因结构(图4C)。GA3ox亚家族和GA2ox亚家族的基因都具有3个外显子/两个内含子的基因结构,GA20ox亚家族包含两种基因结构,PtGA20ox1和PtGA20ox2含有4个外显子,其余的GA20ox基因含有3个外显子/两个内含子。同一个亚家族不同成员的基因结构有不同的模式,如GA3ox亚类的PtGA3ox1,PtGA3ox2和PtGA3ox4的结构相似度较高,而PtGA3ox3的内含子长度有明显差异。因此27个GAoxs基因的基因结构发生了分化。
2.6 毛果杨GAox基因家族的生化活性
本研究成功构建得到18个PtGAox基因的重组表达载体pPET32a/PtGAox (PtGA3ox1, 2, 3,PtGA2ox1, 3, 4, 5, 6, 7, 8, 13, 14, PtGA20ox2, 3, 4,5, 6, 7, 8),SDS-PAGE结果发现8个PtGAoxs蛋白(PtGA2ox3, 5, PtGA2ox8, 13, 14, PtGA20ox6, 7,8)为可溶性蛋白,6个PtGAox蛋白(PtGA2ox1,4, 6, 7, PtGA20ox2, 5)为包涵体,4个PtGAox蛋白(PtGA3ox1, 2, 3, PtGA20ox3)不表达。通过亲和层析对5个PtGAox蛋白进行了纯化,包括C19-GA2ox亚家族的PtGA2ox3和PtGA2ox5,GA20ox亚 家 族 的PtGA20ox6、PtGA20ox7和PtGA20ox8。高效液相色谱质谱联用仪(LC-MS)对纯化得到的蛋白进行了底物活性测定。根据标准品LC-MS全扫描结果确定酶学反应产物MRM定量分析时需要采集的母离子和子离子分别为:GA8,363.1/275.2;GA51,331.2/287.2;GA9,315.2→271.2;GA20,331.2→287.2;GA24,345.2→257.4(图5)。
酶活性测定的结果显示C19-GA2ox亚家族的两个蛋白对底物GA1和GA9有活性,催化GA1生成GA8,GA9生成GA51,而GA20ox亚家族的3个蛋白对底物GA15, GA24和GA53有活性,催化GA15生成GA24,GA24生成GA9,GA53生成GA20(表2)。与PtGA2ox5相比,PtGA2ox3对GA9的活性最高,活性为8.015 nmol·min-1mg-1。GA20ox亚家族的3个蛋白对底物GA15和GA53均表现出微弱的活性,而对底物GA24有较高的活性。其中PtGA20ox6对底物GA24的活性最高,酶活性为2.862 nmol·min-1mg-1。
蛋白活性与其结构紧密相关,因此本研究对5个毛果杨GAox蛋白的三维结构进行了模拟,与Huang等人[26]的研究结果十分相似,这5个蛋白主要由α螺旋和β折叠组成,而且所有的特征序列与底物结合的位点都位于缝隙中,三级结构差异不明显(图6)。
3 结论与讨论
赤霉素是植物体内的重要的激素之一,GAox基因家族是赤霉素合成途径的关键酶之一[30-32]。本研究在毛果杨基因组中一共鉴定得到27个GAox基因,分散分布在毛果杨14条染色体上。通过比较不同亚家族拟南芥和毛果杨GAox基因数量,发现GAox基因家族在毛果杨中发生了不同程度的扩张,比如C20-GA2ox亚家族含有4个拟南芥GAox基因和8个毛果杨GAox基因。在毛果杨中,有11对GAox基因是通过全基因组加倍产生的,因此其扩张主要是由于大片段重复产生的。PtGA20ox7和PtGA20ox8是由全基因组重复产生的一对重复基因,PtGA20ox8在5个组织部位的表达量均明显高于PtGA20ox7,而酶学活性测定的结果发现,这两个基因编码的蛋白对底物GA15和GA53均表现出微弱的活性,而对底物GA24有较高的活性,而且PtGA20ox8对GA24的活性是PtGA20ox7的两倍。因此表达模式和生化活性的分化可能是全基因组重复发生后这两个基因均得以保留的机制。有两个基因(PtGA2ox3,PtGA2ox15)在同源染色体片段上没有找到对应的大片段重复基因,这表明对应的同源序列可能在重复事件后已经丢失,支持全基因组重复事件之后加倍的基因拷贝有丢失的倾向[33]。
目前可知,GA2ox可以调节植物由营养生长到生殖生长,在植物开花以及果实成熟时含量较高[27-28],GA3ox在发育中的种子和未成熟的果实中含量较高[34],GA20ox在节、幼芽、萌发的胚中含量较高[35]。在毛果杨中有8个GAoxs基因在成熟叶片中的表达量比在根、节间、幼叶和节的表达量高,而且成熟叶片中表达量最高的3个基因是PtGA2ox1、PtGA2ox7和PtGA2ox15,都属于GA2ox亚家族,GA2ox是GAs降解过程中的关键酶,它可以使植物体内具有生物活性的GAs水平降低,因此这与成熟叶片中活性GAs水平降低是一致的[36]。而GA3ox亚家族4个基因中的3个基因在毛果杨的幼叶中表达量最高,GA3ox可以催化没有活性的赤霉素GA53生成具有生物活性的赤霉素GA4,提高植物体内具有生物活性的GAs的水平,因此这与幼叶中活性GAs水平较高是一致的[36]。
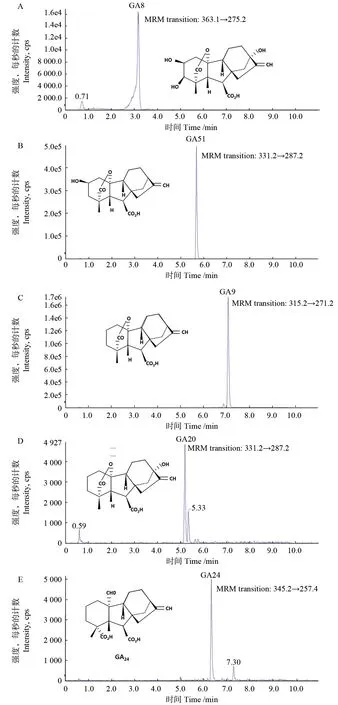
图5 PtGAox蛋白反应产物LC-MS-MRM定量分析Fig.5 Quantitative analysis of the products catalyzed by PtGAox proteins by LC-MS-MRM

表2 毛果杨C19-GA2ox和GA20ox亚家族蛋白底物活性†Table 2 Enzymatic activity of Populus C19-GA2ox and GA20ox subfamily proteins

图6 毛果杨C19-GA2ox和GA20ox蛋白三维结构模拟Fig.6 Structure modeling of Populus C19-GA2ox and GA20ox proteins
在系统进化树上,毛果杨的PtGA2ox3与拟南芥的AtGA2ox2和AtGA2ox3聚为一支,同源关系比较近;而毛果杨的PtGA2ox5与拟南芥的AtGA2ox4同源关系比较近。1999年Thomas等克隆并测定了AtGA2ox2、AtGA2ox3催化C19底物GA1、GA9的活性,发现AtGA2ox2对底物GA1有2β-羟基化氧化酶催化能力,对底物GA9有2-酮基化氧化酶的催化能力;而AtGA2ox3对上述两底物有2β-羟基化氧化酶催化活性[28]。目前拟南芥GA2ox家族成员AtGA2ox4对C19底物的特异性催化未见报到。本实验克隆获得了AtGA2ox2、AtGA2ox3的 同 源 蛋 白PtGA2ox3,AtGA2ox4的同源蛋白PtGA2ox5。体外酶活测定表明,PtGA2ox3对底物GA9有很高的催化活性,PtGA2ox5对底物GA9的催化活性较低。从模拟的三维结构上看,二者具有相似的高级结构。从活性位点附近一级序列比对来看,两者差别很大。PtGA2ox3蛋白在结合2-酮戊二酸的活性位点R和S附近以非极性氨基酸丙氨酸、脯氨酸、亮氨酸以及苯丙氨酸为主,疏水环境增强了底物与活性中心R和S的静电作用力,促进了催化基团与底物反应基团之间的正确定位和取向。而PtGA2ox5蛋白在活性位点R和S附近存在多个带羟基的氨基酸(苏氨酸,丝氨酸,酪氨酸),这些极性富电子基团与底物的羰基、羧基形成大量氢键,稳定了底物构象,抑制了底物扭曲形变,降低了酶活性中心的催化能力。推测PtGA2ox3活性中心位置附近的非极性基团是引起其催化活性高的原因,这虽然符合生物化学原理,仍然需要进一步的实验验证。
前人对赤霉素代谢途径的研究主要集中在水稻、拟南芥以及一些草本植物[26,37],很少有关于木本植物的研究,本研究主要对毛果杨GAox基因家族进行了鉴定、分类、表达模式和酶学活性测定,可为进一步研究毛果杨赤霉素代谢途径提供参考。
