超高效液相色谱–串联三重四级杆质谱法检测人血浆中非靶向代谢物
2020-09-26冯静陈曦曹忠波邢立莹李延升谢韬
冯静,陈曦,曹忠波,邢立莹,李延升,谢韬
(辽宁省疾病预防控制中心,辽宁省空气雾霾与人群健康监测重点实验室,沈阳 110005)
1999 年,英国帝国理工大学的Nicholson 等首次提出“代谢组学”的概念,他们通过高分辨核磁共振技术首次整体绘制了生物体液的代谢物指纹图谱,并将这种分组分析的方法称为代谢组学,此番论述开创了对复杂样品进行代谢组学分析的先河[1–3]。发展到近代,代谢轮廓分析已进化为代谢组学研究并且广泛应用于血、尿、脑脊液等生物样品中代谢物的定性与定量分析,以对疾病进行筛选和诊断[4–8]。代谢组学正日益成为生命科学研究的重点之一。针对慢性病基础调查进一步开展相关的代谢组学研究一直是笔者近年的工作内容[9–10]。由于代谢产物和生物体系的复杂性,尚未发展出能完全满足代谢组学分析的技术。
目前联用技术和多方法综合分析是公认的先进手段,其中色谱–质谱联用方法因兼具色谱的高分离度、高通量及质谱的普适性、高灵敏度和特异性而成为最主要的分析工具[11–14]。代谢组学研究包括样品采集和制备、代谢组数据采集、数据预处理、多变量数据分析、标志物识别和途径分析(代谢通路分析),结合临床疾病筛查诊断需要,可进一步筛选变量,绘制受试者工作特征分析曲线(ROC),建立逻辑分析概率模型,可望应用于未知人群疾病的筛查[5,15–17]。作为代谢组学研究的初始步骤,样品和数据采集是分析过程中最重要的环节之一,但目前发表的文献中此步骤往往没有经过充分的讨论。
笔者研究发现,提取剂、色谱条件甚至是检测仪器不同均会使代谢物小分子的检出数量产生显著差异。而尽可能获得最大的代谢物覆盖是非靶向代谢组学研究的基础,为保证后续数据的全面性和准确性以建立最可靠的预测模型,笔者对样品及数据采集方法做了全面的验证,以建立人血浆中非靶向代谢组学检测的最优方法。
1 实验部分
1.1 主要仪器与试剂
液相色谱系统:Waters AcquityTMUPLC system型,美国沃特世公司;
质谱仪:Xevo TQ 型三重四级杆质谱仪,美国沃特世公司;
代谢组学软件:Markerlynx 4.1,美国沃特世公司;
高速冷冻离心机:Thermo ST16R 型,美国赛默飞世尔科技公司;
氮吹仪:TurboVap LV 型,美国Caliper Life Sciences 公司;
漩涡混合器:Vortex-genie2 型,美国Scientific Industries 公司;
乙腈、甲醇、乙醇、丙酮:均为色谱纯,美国赛默飞世尔科技公司;
甲酸:色谱纯,美国Sigma 公司;
2-氯-苯丙氨酸标准品:纯度为98%,标准物质编号为LLB0T93,河北百灵威超精细材料有限公司;
实验用水:超纯水,自制。
1.2 溶液的配制
内标储备液:准确称取2-氯-苯丙氨酸标准品100 mg 于10 mL 容量瓶中,以1%甲酸溶液–乙腈(40∶60)溶解并定容,得2-氯-苯丙氨酸质量浓度为10 mg/mL 的内标储备液。
含内标复溶溶液:取100 μL 内标储备液于10 mL 容量瓶中,以乙腈–水(1∶4)定容,得2-氯-苯丙氨酸质量浓度为0.1 mg/mL 的复溶溶液。
1.3 仪器工作条件
1.3.1 色谱
色谱柱:Waters Acquity Hss T3 柱(100 mm× 2.1 mm,1.8 μm,美国沃特世公司);柱温:50℃;样品室温度:4 ℃;进样体积:10 μL;流动相:0.1%甲酸水溶液–0.1%甲酸乙腈溶液,流量为0.3 mL/min;梯度洗脱程序见表1。
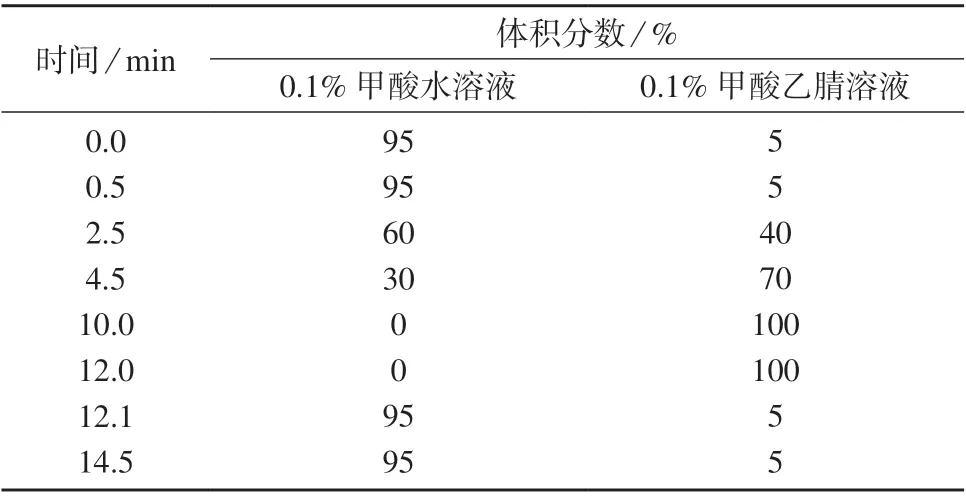
表1 色谱分离梯度洗脱程序
1.3.2 质谱
离子源:电喷雾离子源(ESI);监测模式:正离子模式;脱溶剂气:氮气,流量为650 L/h;离子源温度:150℃;锥孔反吹气:氮气,流量为50 L/h; 脱溶剂气温度:350℃;毛细管电压:3.0 kV;锥孔电压:30 V;质量测定:NaI–CsI;质量扫描范围:100~1 000 Da。
1.4 生物样品制备
血浆样品的采集:采集4 名健康志愿者全血各10 mL 于EDTA 抗凝采血管中,涡旋混合,以3 500 r/min 转速离心6 min,分离,得上层血浆样品,分装成a,b,c 3 份,每份700 μL,于–80℃保存。
血浆质控样品的制备:分别准确吸取每份血浆样品200 μL,涡旋混合,得血浆质控样品,分装成a,b,c 3 份,每份800 μL,于–80℃保存。
血浆样品的预处理:取血浆100 μL,加入甲醇–丙酮(1∶1) 300 μL,涡旋10 s,于4 ℃下以13 000 r/min 转速离心10 min,吸取上清液于2 mL离心管中,于室温下用氮气吹干,加入300 μL 含内标复溶溶液复溶,过0.22 μL 滤膜,取10 μL 注入超高效液相色谱–质谱联用仪中进行分析。
1.5 数据处理
将样品测定值用代谢组学软件Markerlynx 4.1进行数据处理,软件对仪器采集的数据进行解卷集和峰提取,获取每个血浆样品中的代谢物检测数量、保留时间和质荷比,数据可以导入第三方多元统计分析软件中进行进一步处理。
2 结果与讨论
2.1 代谢物提取条件筛选优化
查阅文献发现,乙腈、甲醇–乙腈混合液、甲醇–丙酮混合液作为提取剂,用于提取血浆中非靶向代谢物,可具有较高的代谢物覆盖率。笔者分别使用乙腈、甲醇–乙腈(1∶1)、甲醇–丙酮(1∶1)、甲醇–丙酮(1∶2)作为提取剂,对血浆质控样品中小分子代谢物检测数量进行考察,结果列于表2。试验表明,以甲醇–丙酮(1∶1)作为提取剂可以获得最大的小分子代谢物检测数量。
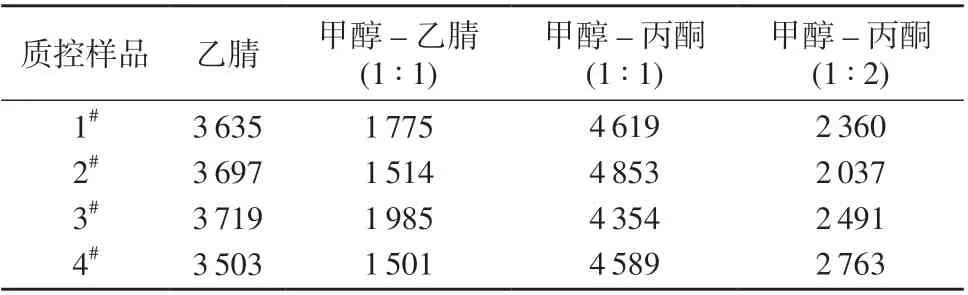
表2 不同提取剂提取血浆中小分子代谢物的数量
对净化后的样品进行浓缩复溶,有利于提高样品中微量代谢物的浓度,但浓缩亦会增加样品基质的浓度,因此有必要考察复溶剂用量对代谢物检测数量的影响。此外复溶后样品的净化有过膜和高速离心两种方式,过膜净化快速、高效,有利于满足后续研究对检测样品高通量的需求,但需考察样品过膜对代谢物检测数量的影响。对以上两个因素进行考察,结果见图1。结果表明,样本不经浓缩复溶,只进行过膜净化可取得最多的代谢物检测数量。
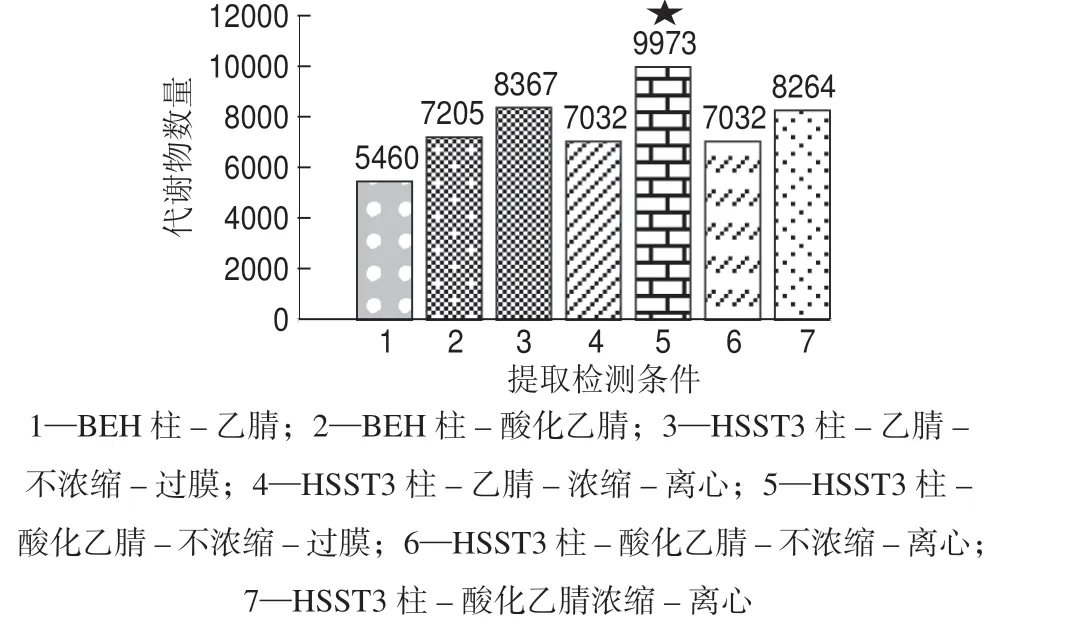
图1 不同提取及检测条件下血浆中代谢物的检测数量
2.2 色谱条件优化
反相液相色谱(RPLC)是目前代谢组学研究中使用最为广泛的分离手段,部分原因在于它与血浆、尿液等生物样品有非常好的兼容性。从RPLC 系统的固定相方面考察,Acquity BEH 柱非常适合于血浆样品中等极性和非极性代谢物的分离,而Acquity HSS T3 柱的键合硅胶对极性和离子型代谢物的保留有所增强,笔者着重考察这两种色谱柱的保留及分离效能。结果显示Acquity HSS T3 柱对血浆中代谢物的保留数量大于Acquity BEH 柱,结果见图1。由图1 可见,Acquity HSS T3 柱在选定的实验条件下对血浆代谢物的保留数为9 973 个,明显多于BEH柱保留的7 205 个。同时考察发现,向水相及有机相中同时添加体积分数为0.1%的甲酸能够显著提高待测物的离子化效率,提高信号响应值,使实验条件下代谢物的检测数量从8 367 个提高到9 973 个。
对反相液相色谱流动相进行筛选,使用不同流动相获得的色谱图如图2。图2(a)为乙腈作为有机相的血浆代谢物总离子流图,图2(b)为甲醇作为有机相的血浆代谢物总离子流图。由图2(b)可见,甲醇洗脱脂质污染物的效果比乙腈好,但本底信号强,噪音大;而乙腈的本底值低于甲醇,有利于血浆中痕量代谢物的检测。以代谢物天冬氨酸(m/z134.107,7.41 min)提取信号为例,甲醇作为有机相时天冬氨酸信号完全被本底掩盖[图2(c)],而乙腈作为有机相时响应信号良好[图2(d)]。

图2 不同流动相的色谱图
2.3 样品稳定性考察
以内标物质2-氯-苯丙氨酸(m/z119.6,2.06 min)作为考察对象,对血浆样品的日内稳定性进行考察。取血浆质控样品,置于4℃自动进样器中,分别放置0,4,8,12,24 h 后用本法测定,计算各时间点色谱峰强度与保留时间的相对标准偏差,以考察样品的稳定性,试验结果列于表3。由表3 数据可知,2-氯-苯丙氨酸色谱峰强度与保留时间测定值的相对标准偏差均小于15%,表明样品稳定性良好。
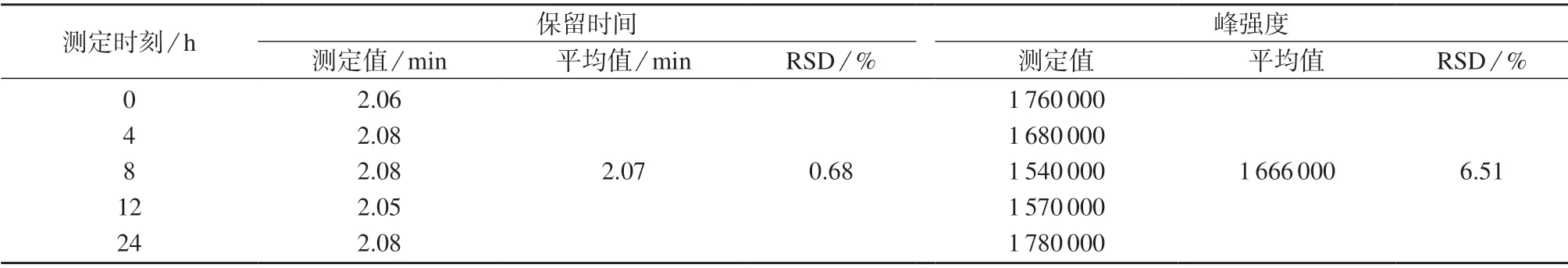
表3 血浆样品的日内稳定性试验结果
2.4 方法重复性考察
以内标物质2-氯-苯丙氨酸(m/z119.6,2.06 min)作为考察对象,对方法的重复性进行考察。方平行称取5 份血浆质控样品,分别进行分析并计算色谱峰强度和保留时间的相对标准偏差,以考察分析方法的精密度,试验结果列于表4。由表4 数据可知,色谱峰强度与保留时间的相对标准偏差均小于15%,表明分析方法重复性精密度良好。

表4 方法重复性试验结果
2.5 血浆样品测定
应用本法对4 份健康志愿者血浆样品进行测定,结果显示,所有样品在质量范围100~1 000 Da内均检测到近万个代谢物。
3 结语
在人体生物样本非靶向代谢组学研究过程中,样品和数据采集是代谢组学研究的初始步骤,更是整个研究的起点,尽可能多地检测出生物样本中的小分子代谢物,提高代谢物覆盖率是获得生物代谢标志物的基础和前提。笔者建立的人血浆样品前处理及液相色谱–串联质谱检测方法能够实现对血浆代谢物的较高覆盖率,保证数据采集的准确性、灵敏性和高通量,为后续研究提供可靠的技术基础。
