改良型大鼠鞘内穿刺置管针及导管末端注药装置在大鼠鞘内置管术中的应用研究*
2020-09-25徐昌顺
徐昌顺,孙 培,林 春
(福建医科大学基础医学院 脑老化与神经变性疾病重点实验室疼痛研究中心,福州 350108)
大鼠鞘内置管术,即经脊椎(间隙)将微量导管置入大鼠蛛网膜下腔的技术。通过留置的微量导管将药物直接输注到蛛网膜下腔,以研究药物对脊髓的作用,并且无需考虑血脑屏障的影响;同时还可以收集脑脊液用于中枢神经系统微环境的研究[1]。该技术首先由Yaksh和Rudy[2]于1976年创建,随后广泛应用于神经科学、脊髓功能学等研究领域。随着这一技术的推广应用,其缺陷也逐渐暴露出来:比如穿刺置管过程中脊柱结构破坏过多、脊髓神经损伤等易引起术后感觉、运动功能障碍;留置体外端导管固定不牢、鞘内给药不便以及导管易受污染等。针对以上问题,后续学者虽然不断改进穿刺置管工具,置管方法和导管固定方式[3],但尚未解决以上所有问题。为此,笔者改良设计了专门针对大鼠鞘内置管的穿刺置管套件(专利号:201822235843.6)和用于固定、保护导管末端、方便鞘内给药的微量注射旋塞(专利号:201920349321.0),并利用该套件和注药装置用于大鼠鞘内置管术中,通过观察比较该套件在置管成功率、注药便利性、导管位置准确性、旷场试验和缩足反应阈值以及置管后运动功能等方面的指标,以验证该装置的可行性和有效性。
1 材料与方法
1.1 实验动物及材料
清洁SD大鼠,雄性,体重200~250 g,由福建医科大学动物中心提供[许可证号:SYXK (闽)2016-0007]。PE-10导管(内径0.28 mm,外径0.61 mm,美国);Von Frey纤维丝(Aesthesio,美国);50 μl微量注射器(上海高鸽工贸有限公司);盐酸利多卡因注射液(上海禾丰制药有限公司);亚甲蓝注射液(济川药业集团有限公司)。
1.2 大鼠鞘内穿刺置管针套件和微量注射旋塞结构特点
大鼠鞘内置管穿刺针套件由中空的引导针和可由引导针中间穿过的探针组成。两者前端均设计为楔形,楔形角度分别为45°和30°,尾端为翼状手持部。探针可自由穿过引导针并且前端限制最大伸出为2 mm。引导针和探针均适配有封堵针芯(图1)。
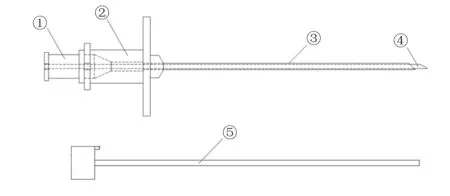
Fig. 1 The schematic diagram of puncture needle for lumbar intrathecal
微量注射旋塞由前后两个部分组成:前半部分为旋塞头,其内部具有前小后大的锥形容置腔,容积约8 μl,并由橡胶塞封住。后半部分为固定器,通过螺纹与旋塞头相连,固定器内部为圆形腔,含有橡胶柱及树脂垫。当微量导管(如PE-10)经穿孔到达锥形容置器前端时,通过拧紧旋塞头与固定器之间的螺纹,使旋塞头的圆柱体能够向内顶压橡胶柱,使得橡胶柱轴向尺寸被压缩,进而抱紧微量导管,实现了将整个微量注射旋塞固定连接在微量导管上(图2)。
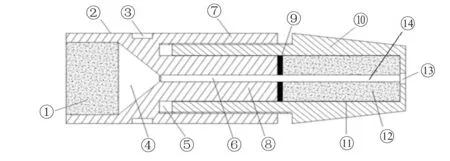
Fig. 2 The schematic diagram of Microinjection cock
1.3 麻醉及手术方法
健康雄性清洁级SD大鼠60只,按随机数字表法分为常规组(C组,n=30)和改良组(M组,n=30)。所有大鼠均采用七氟醚麻醉。麻醉显效后,剃除腰骶部及颈部手术区域毛发。
常规组:采用常规穿刺置管术,即消毒铺巾后于L5-6穿刺间隙正中纵向切开2~3 cm,分离椎旁肌肉至椎板,利用尖端磨平的20号注射器针头于穿刺椎间隙缓慢钻入,待针进入蛛网膜下腔可见大鼠一过性甩尾或后肢抽动,此时置入准备好的PE-10导管,退出针头,缝合固定导管后,导管在皮下潜行至大鼠两耳部之间穿出皮肤固定,体外保留2~3 cm长度,10 μl无菌生理盐水冲洗导管后,加热封闭末端。
改良组:大鼠俯卧位,腹下垫20 ml注射器,使腰骶部椎间隙充分暴露。消毒铺巾后,沿大鼠脊柱L5-6 处做一纵形正中皮肤切口,约3~5 mm,左手固定于椎间隙处,右手持引导针,将引导针向头端缓慢置入L5-6椎间隙,直至出现一突破感,表明针尖已刺破椎间韧带到达硬膜外腔。此时,拔出封堵针芯,插入探针,利用探针刺破此处硬脊膜并且可见大鼠出现甩尾或后肢抽动,表示针头已穿过硬膜达蛛网膜下腔,再拔出探针,经引导针置入提前做好标记并预充生理盐水的PE-10导管,经硬膜破口处到达蛛网膜下腔,置管深度为2~2.5 cm。此过程借鉴临床腰硬联合麻醉过程中的“针内针”技术,完成大鼠鞘内穿刺置管过程。置管后,用3-0无菌丝线将PE-10导管缝合固定于L5棘突和椎旁肌肉上,缝合皮肤切口,并经皮下隧道于颈部两耳之间的小切口处引出PE-10导管,导管末端连接微量注射旋塞,“荷包”缝合固定微量注射旋塞于颈部。待需要进行鞘内给药时,将微量注射器的针头穿透橡胶塞,将药液直接注入锥形容置腔中通过微量导管进入大鼠蛛网膜下腔内,注射完毕后拔出针头,可以依靠橡胶塞自行密封鞘内导管(图3)。
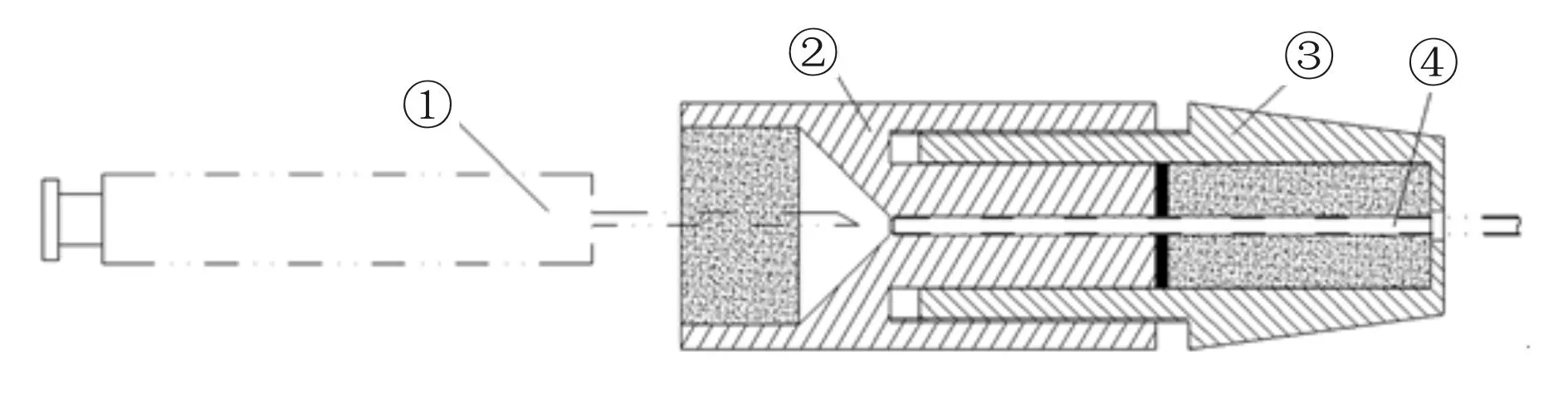
Fig. 3 The schematic diagram of Microinjection cock instructions
所有大鼠术后单笼饲养,自然苏醒,术后常规使用青霉素抗感染治疗3 d。
1.4 术后运动功能情况
观察并记录两组大鼠置管1 d后自然状态下随意行走的步态,采用分级制:Ⅰ级:正常步态;Ⅱ级:异常步态,一侧后肢功能障碍;Ⅲ级:双后足功能障碍但尚能行走;Ⅳ级:双后肢截瘫。
1.5 导管位置检测
两组大鼠鞘内置管完成后,分别于术后1、3、7、14、21 d进行利多卡因实验,检测导管是否在位;并于第30日鞘内注射亚甲蓝,后处死大鼠,解剖椎管,观察椎管内导管位置情况。常规组给药,需消毒导管体外保留端,剪除密封末端,将微量注射器针头小心插入导管内约3~5 mm,给予2%利多卡因10 μl,药液经导管注射入蛛网膜下腔,再使用10 μl无菌生理盐水冲洗导管,最后加热密封导管末端。改良组行鞘内注射给药时,先消毒微量注射旋塞的橡胶塞,后用微量注射器刺入橡胶塞给予2%利多卡因10 μl,随后再用10 μl无菌生理盐水冲洗,之后直接拔出微量注射器。记录并比较两组自开始消毒到完成鞘内给药操作的时间。注射利多卡因后,如大鼠在30 s内出现双下肢麻痹,并持续20~30 min,则证明导管位于蛛网膜下腔内。
1.6 大鼠缩足反应阈值测定
所有实验大鼠于置管前1 d,置管后1、3、7、14、21、30 d参照 Chaplan SR 等[4]介绍的方法,用 Von Frey 纤维丝以 Dixon WJ 等[5]的“up-and-down” 法测定推算其机械刺激反应阈值 (50%PWT,paw withdrawal threshol)。观察置管前后大鼠机械刺激缩足阈值的变化情况。用Von Frey纤维丝垂直刺激大鼠后足掌部,避开爪垫,持续时间≤4 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从2 g开始,当该力度刺激不能引起阳性反应,则给予相邻大一级力度刺激;如出现阳性反应则给予相邻小一级力度刺激,如此连续进行,直至出现阴性反应和阳性反应的骑跨值时,再连续测定4次。最大力度为15 g,大于此值时记为15 g。每次刺激间隔30 s,每次测量为同一后足并且纤维丝弯曲弧度相同,确保每次施加的刺激相同。
1.7 大鼠旷场实验
旷场实验是检测动物情绪行为的一种常用的经典实验方法,应用旷场实验评价颈部固定微量注射旋塞后对大鼠自主活动的影响。即将大鼠放置在高60 cm,底边长100 cm,内壁涂黑的无盖方箱装置内,其正上方2 m处安装一摄像机,镜头对准箱底。同时进行摄像和计时,显示器中观察大鼠5 min内的活动情况。分别于术前和术后7 d各测量一次。测试结束后采用自主活动视频分析软件分析录像,并记录结果。
1.8 统计学处理
2 结果
2.1 两组大鼠鞘内置管位置准确性及置管后运动功能变化情况
常规组有1例因反复穿刺,椎板结构破坏过多,置管失败,改良组均置管成功;运动功能分级:C组Ⅰ级75.9%,Ⅱ级20.7%,Ⅲ级3.4%,M组Ⅰ级96.7%,Ⅱ级3.3%,无Ⅲ、Ⅳ级,改良组运动功能分级Ⅰ级占比率显著高于常规组(P<0.05);利多卡因实验显示C组鞘内导管分别于置管后第14日、21日各有1例脱落,至置管后第30日,经亚甲蓝定位,C组有4例导管脱出,而M组导管均在位,两组相比有统计学差异(P<0.05,表1)。
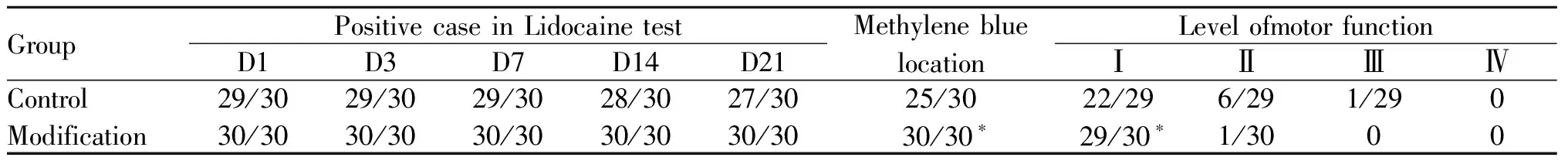
Tab. 1 Results of success rate in intrathecal catheterization , and catheter location and motor function(n=30)
2.2 两组大鼠经鞘内导管注药操作情况
常规组鞘内给药,需将微量针小心穿入鞘内导管,给药操作时间为(207.07±16.20)s,多长达3 min以上;而改良组经微量注射旋塞行鞘内给药方便迅速,给药时间为(57.90±5.73)s,即在60 s左右完成,两组在注药操作时间上相比具有显著差异(P<0.01)。
2.3 置管前后大鼠PWT变化情况
置管后7 d内,两组大鼠的PWT处于波动状态,至置管后第3日降至最低,与术前相比有显著差异(P<0.05),置管7 d后恢复稳定,与基础值无差异(P>0.05);改良组与常规组在鞘内置管前后各时点PWT变化无差异(P>0.05, 表2)。
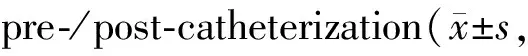
Tab. 2 Results of PWT on n=30)
2.4 微量注射旋塞对大鼠自主活动行为的情况
常规组在置管前后的旷场实验中各指标间比较均无统计学差异;改良组大鼠在微量注射旋塞放置前后的旷场实验中,总路程、中央区活动路程以及运动时间和速度等方面均无差异,并且中央区活动路程占比在置管前后无差异;两组间各指标之间相比也无差异(表3,图4)。
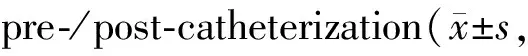
Tab. 3 Results of open-filed test on n=30)
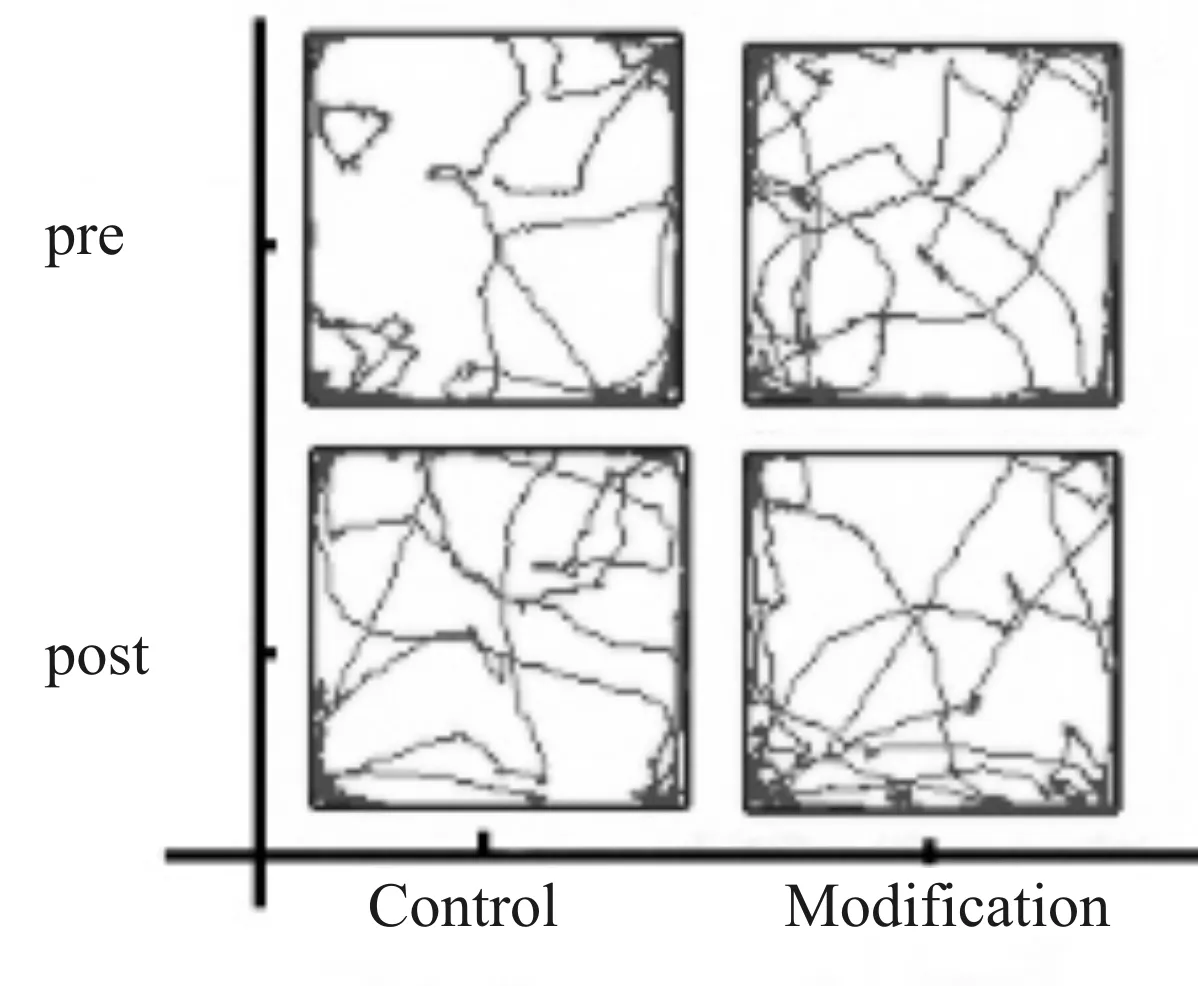
Fig. 4 Rat trajectory in the open field test on pre-/post-catheterization
3 讨论
大鼠鞘内置管技术在麻醉与镇痛、心血管调控的脊髓机制和药物脊髓作用等动物实验研究中具有重要的价值[6-7]。自大鼠鞘内置管模型建立40多年以来,国内外学者不断进行鞘内置管工具的设计与改进[8-9],但目前所使用的穿刺置管工具都不可避免的存在椎板结构破坏过多和穿刺效率低的缺点,为此笔者改良设计的专门用于大鼠鞘内的穿刺置管套件,在本实验中与常规穿刺工具相比,具有显著优点。首先,该套件操作时仅需在大鼠腰骶部切开3~5 mm,利用引导针定位穿刺点于目标椎间隙,再经探针于此处硬膜开一可供鞘内导管穿入的开口,不破坏椎板结构,并且限定探针前端超出引导针最大为2 mm,据报道[10]SD大鼠腰骶段椎管平均直径为2 mm,限定探针伸出长度可避免探针探查和刺破硬膜时对附着于椎管内侧壁神经根的损伤。同时,探针内有针芯封堵,可防止探针楔形尖端切割导致的神经损伤。常规组穿刺操作破坏了椎板的正常结构,若在穿刺间隙定位模糊的情况下反复穿刺,则造成脊椎破坏过多,损伤较大,甚至穿刺置管失败。从两组置管后的运动功能分级差异也显示该穿刺套件损伤较小。其次,该套件置管成功率与常规组相当,甚至更优。尽管两组大鼠鞘内置管后7 d内,机械刺激缩足阈值出现波动,但一周之后便趋于稳定,可能与鞘内穿刺操作以及导管置入后的局部刺激反应有关[11],故所涉及后肢感觉或运动功能检测的行为学实验,一般选择鞘内置管后一周再进行,以规避鞘内插管本身带来的影响。最后,引导针手持部设计有翼状尾部和与针尖楔形方向一致的标记:翼状尾部有助于穿刺时的手指着力,而标记针尖斜口方向有助于控制鞘内导管的走行方向。同时引导针管径匹配鞘内导管直径,可限制置管时鞘内导管的折弯或者盘曲,更有利于导管的顺利置入。由此可见,大鼠鞘内置管穿刺针套件在较小的创伤下,即可顺利、高效的完成鞘内置管操作,实用性较强。
大鼠鞘内置管模型建立的另一个重要方面即是鞘内导管的妥善固定、导管末端的保护以及给药操作的便利性。导管的妥善固定是进行后续实验的重要保证。早期鞘内插管成功后,导管末端经热熔或者不锈钢堵头封闭后直接游离放置体外,待需要鞘内给药时,即剪去末端部分,经由微量注射针施行给药。但此操作存在一系列缺陷:(1)末端未行保护的导管游离放置,极有可能被大鼠用前爪拖出。这在经腰骶部穿刺置管途径中更为明显,因为其椎管内导管行程较短,仅2~3 cm,Storkson等[12]报道经腰5-6椎间隙鞘内置管后4 d内超过50%以上的大鼠鞘内导管脱出或体外部分被破坏;(2)鞘内导管直径纤细,微量注射器针头注射给药时不易准确穿入,操作不便;(3)每次行鞘内给药操作均需剪除一段导管,若进行长期反复鞘内给药,则导管逐渐缩短,不能保证后续实验进行;(4)鞘内导管末端直接暴露于体外,虽然大鼠抗感染力强,对病菌耐受程度远高于人类,但几乎所有动物都不可避免的发生粪尿污染导管,可引起局部感染,甚至产生行为异常[13]。基于以上缺陷,后续学者也做了许多改进。Milligan等[14]选择在大鼠背侧固定一金属套管底座,用以保护体外导管。该法优点是末端导管有金属套保护,导管不易被拖出,但大鼠生性好动,背部额外装置加重负担,可能对行为学产生一定影响,同时也没有解决方便给药的问题;Jasmina等[15]在导管末端辅以一金属保护头封闭导管,并固定在大鼠背侧,方便多只饲养,节约成本,可以一定程度上避免社会隔离综合征[16];Xu等[17]则通过将导管末端放置于一金属固定器内,管的外部卷入保护器中,实现导管的保护,但该法注药操作极为繁琐;杜世伟等[18]重点针对给药便利性及抗感染角度设计出橡皮囊封闭末端导管,并将整体放置于大鼠腰部皮下固定,可避免大鼠撕咬及感染,方便给药,而且可反复进行穿刺注药操作,但实验时需要局麻下切开后取出给药,干扰了正常生理过程,对研究因素增加了额外的干扰。由此可见,尚未有一种改进方案可解决以上所有问题。本实验中,使用微量注射旋塞旋接鞘内导管,一方面可保护游离放置的导管末端,并“荷包”缝合紧固于大鼠颈部,可以避免鞘内导管被大鼠前爪拖出,虽然两组均采用章沿锋等[19]提出的将导管绕成环形固定于肌肉和筋膜上,以充分地缓解导管的张力,避免导管从椎管内脱出或位置改变,但显然,常规组仍有导管脱出和鞘内导管位置改变的情况,改良组因为微量注射旋塞旋接起到良好的保护作用,导管准确位于鞘内。另一方面,微量注射旋塞封闭鞘内导管游离端,使整个导管均位于皮下,并借助微量旋塞尾端的橡胶塞与外界隔绝,避免粪尿污染导管,当需行鞘内给药时,只清洁消毒旋塞尾端橡胶塞即可。再者,微量注射旋塞头端为自旋紧固设计,依靠固定器内部橡胶柱的形变可适配不同规格的微量导管,鞘内给药过程类似临床输液过程,只需将微量注射器针头刺入橡胶塞就可以完成鞘内给药,注药过程十分简便,从两组完成注药操作时间上的差异也可以看出,微量注射旋塞优势极为明显。
综上,微量注射旋塞较好的解决当前大鼠鞘内置管后的导管的保护、固定以及给药的问题,但颈部固定的微量注射旋塞毕竟作为外来内植物,是否会对大鼠的自主活动行为产生影响,我们通过旷场实验进行评估。旷场实验又称敞箱实验,是评价实验动物在新异环境中自主行为、探究行为与紧张度的一种方法。大鼠进入新环境后,会经历紧张、兴奋、探索、适应等心理过程,其活动表现为趋避性,好奇性及探索性的特点[20],因而旷场实验能够反映大鼠进入空旷区域时的自我情绪,是评价啮齿类实验动物运动功能和焦虑状态的经典方法。本研究结果说明微量注射旋塞的放置并未影响大鼠的自主活动与情绪状态。
总之,大鼠鞘内置管穿刺套件作为专门应对大鼠鞘内置管操作而设计的穿刺置管工具丰富大鼠鞘内置管操作手段,具有创伤小,效率高,实用性强的特点;而微量注射旋塞弥补当前大鼠鞘内导管处置过程中的诸多缺陷,并且还可拓展应用到涉及体腔内药物注射的其它小型实验动物。但我们也应认识到,大鼠生性好动、喜啃咬,颈部微量注射旋塞能完整保存的期限以及采用何种材质以防啃咬、破坏和实现多只饲养,这些仍值得我们进一步研究。
