有机磷阻燃剂TDCIPP对雌性大鼠甲状腺的潜在毒性作用*
2020-09-25孙景然樊祢祢韩殿鹏白家磊杜连群房彦军
孙景然,樊祢祢,张 桢,吴 瑾,韩殿鹏,白家磊,杜连群,房彦军 △
(1. 军事医学研究院环境医学与作业医学研究所,天津 300050; 2. 中北大学材料科学与工程学院,山西 太原 030051)
随着溴代阻燃剂(brominated flame retardants, BFR)在全球范围内的限制使用,作为替代品的三(2-氯乙基)磷酸酯(tris(2-chloroethyl) phosphate, TDCIPP)有机磷酸脂阻燃剂,已被多个生产领域中广泛应用[1]。有研究已经发现在水、大气、土壤、室内灰尘等各类环境介质中,甚至人类尿样、脂肪组织、乳汁中均可以检测到TDCIPP[1, 2]。目前环境中TDCIPP的暴露浓度已经开始危害人类的健康,越来越多的调查显示,有机磷酸酯类阻燃剂由于其不易降解、容易在生物体内富集等原因,已经开始威胁到生态环境的安全及人类的健康,相关研究发现该类新型阻燃剂具有内分泌毒性、甲状腺毒性、神经毒性和潜在致癌性[2]。本研究采用经口灌胃的体内染毒方式建立TDCIPP暴露动物模型,通过检测甲状腺组织的病理变化及甲状腺激素水平的改变来探讨TDCIPP对甲状腺的毒性作用,为更好的评价TDCIPP毒性作用机制提供理论支持。
1 材料与方法
1.1 动物与分组
将32只离乳3周的雌性SD大鼠随机分为4组:对照组(玉米油灌胃)、TDCIPP溶解于玉米油中,分为低剂量组(50 mg/(kg·d))、中剂量组(100 mg/(kg·d))、高剂量组(250 mg/(kg·d)),每组8只, 连续灌胃给药21 d,每天1次。末次给药后处死动物,取血后分别取出甲状腺和肝组织备用。
1.2 仪器与试剂
光学显微镜(OLYMPUS,日本),低温高速冷冻离心机(ASONE,日本),PCR扩增仪(ABIPrism,USA),ABI7300荧光定量PCR仪(ABIPrism,USA),紫外凝胶成像系统(Microvision,USA);甲状腺激素TT3、TT4、FT4、TSH试剂盒(北京北方生物研究所,中国),RNase-free DNase I试剂盒(TaKaRa,日本),BCA蛋白定量试剂盒(碧云天,中国),TDCIPP(Sigma美国),兔抗CYP3A1抗体、兔抗UGT1A6抗体 、兔抗TTR抗体、兔抗TRβ抗体(Abcam,UK)
1.3 甲状腺脏器系(指)数测定
动物处死后,立刻摘除甲状腺,生理盐水冲洗干净后用滤纸吸干残留液体并称重记录。质量都精确到0.1 g。甲状腺绝对质量= 甲状腺质量/动物质量
1.4 甲状腺组织的病理变化
甲状腺被摘除后,用10%的福尔马林液体固定至少48 h,然后用石蜡包埋,切片厚度约为4~5 μm,用苏木素和伊红进行染色,光学显微镜下观察病理改变并拍照。
1.5 甲状腺激素的改变
在末次给药结束后,用7%的水合氯醛(注射剂量为0.3 ml/100 g)腹腔注射麻醉动物,主动脉取血,3 000 r/min离心10 min,收集上清液于-80℃冷冻。血清三碘甲腺原氨酸(3,3’,5-triiodothyronine,T3),四碘甲腺原氨酸(3,3’,5,5’-tetraiodothyronine,T4),游离T4(free 3,3’,5,5’-tetraiodothyronine,FT4)和促甲状腺激素(thyroid stimulating hormone,TSH)浓度使用大鼠特异的ELISA酶联免疫试剂盒进行测量。
1.6 RNA提取和RT-PCR分析
称取适量的甲状腺组织,加入液氮和一定比例的TRIZOL试剂研磨。4℃离心机,12 000 r/min离心15 min,取上层无色水相层(含RNA)再加入等体积异丙醇,12 000 r/min离心10 min后获取RNA。用1 ml 75%乙醇清洗RNA沉淀1次后用20 μl DEPC水溶解,置于-80℃冰箱保存备用。提取的RNA纯度和质量分别利用紫外分光光度计测量A260/280 nm波长吸光值比值和EB染色的1%的琼脂糖凝胶电泳实验验证。第一链cDNA合成使用TaKaRa公司的Prime Script RT试剂盒,按照试剂盒说明使用。RT-PCR使用SYBR Real-time PCR Master-Mix-Plus试剂盒以及ABI7300PCR仪器进行,反应体系配备和反应过程详见说明书。所有RT-PCR数据均使用2-ΔΔCT方法进行处理。目的基因引物序列如表1所示。

Tab. 1 Primer sequences used for RT-PCR
1.7 蛋白提取和Western blot电泳
新鲜肝脏组织(200 mg)液氮研磨,加入含有蛋白酶抑制剂PMSF的组织裂解液RIPA试剂进行匀浆裂解。然后在4℃离心14 000 r/min离心10 min。蛋白浓度使用碧云天公司的BCA蛋白定量试剂盒进行定量。定量后的蛋白样品加入1/5样品体积的6×loading buffer(pH 6.8),100℃煮沸10 min。4℃,12 000 r/min离心10 min,静置备用。经电泳、转膜、洗膜后,抗体孵育(抗体种类见1.2)后,在暗室中进行显色。使用紫外凝胶成像系统(Microvision,USA)进行成像分析。
1.8 统计学处理
2 结果
2.1 大鼠体重和甲状腺组织质量的变化
与对照组比较,各个TDCIPP剂量组大鼠的体重无明显变化。称取甲状腺组织获得其绝对质量,通过公式甲状腺相对质量=甲状腺绝对质量/大鼠质量,在中剂量组和高剂量组,大鼠甲状腺的绝对和相对质量出现明显的增大,且呈剂量依赖性变化(P<0.05,表2)。
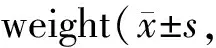
Tab. 2 Changes of rats’ body and thyroid n=8)
2.2 甲状腺的组织病理变化
HE染色结果可以发现TDCIPP染毒组大鼠甲状腺出现不同程度的病理损伤。在对照组中,甲状腺滤泡由立方形上皮细胞组成并充满胶质,所有滤泡细胞均整齐规则排列。低剂量组组织学未出现明显变化。而中、高剂量组大鼠的甲状腺组织切片中,滤泡细胞排列不规则,胶质较少,滤泡有增生和肥大现象,尤其是高剂量组中,滤泡增生严重,部分甚至缺少胶质。四组甲状腺细胞核均未见有异常病变(图1)。
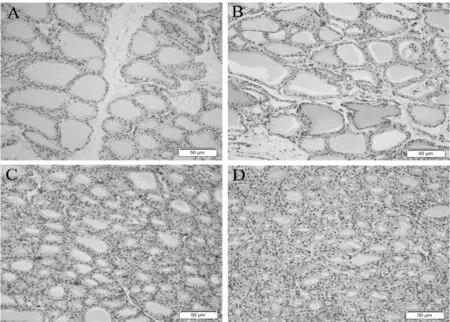
Fig. 1 Changes of rats thyroid induced by TDCIPP(HE ×400)
2.3 甲状腺激素的变化
血清TSH水平在低剂量组TSH的平均水平明显低于对照组(P<0.05),中剂量组与高剂量组TSH未出现明显变化,T3在高剂量组水平显著升高(P<0.05),其他各组与对照组相比均无统计学差异。三个TDCIPP暴露组中血清T4和FT4水平与对照组相比均无统计学差异(图2)。

Fig. 2 Changes of thyroxine induced by TDCIPP(n=8)
2.4 与甲状腺激素相关基因表达的变化
利用RT-PCR技术检测与甲状腺激素合成及转运相关的11个基因。其中有4个与甲状腺激素合成相关的基因:钠碘转运体(sodium iodide symporter, NIS),甲状腺过氧化物酶(thyroperoxidase, TPO),甲状腺球蛋白(thyroglobulin, Tg)和促甲状腺激素受体(thyroid stimulating hormone receptor, TSHR)作为目的基因来研究TDCIPP暴露是否能够影响大鼠甲状腺激素合成。结果显示:与对照组比较,三个TDCIPP暴露组中TPO mRNA水平的表达均高于对照组,其中中、高剂量组有统计学差异(P<0.05,P<0.01)。NIS和TG mRNA表达在低、中剂量组无明显差异,但在高剂量暴露组,二者表达显著高于对照组(P<0.05)。TSHr基因表达在低剂量暴露组明显下调(P<0.01),而在中剂量和高剂量组,TSHR表达却呈现出恢复到对照水平的趋势(图3)。
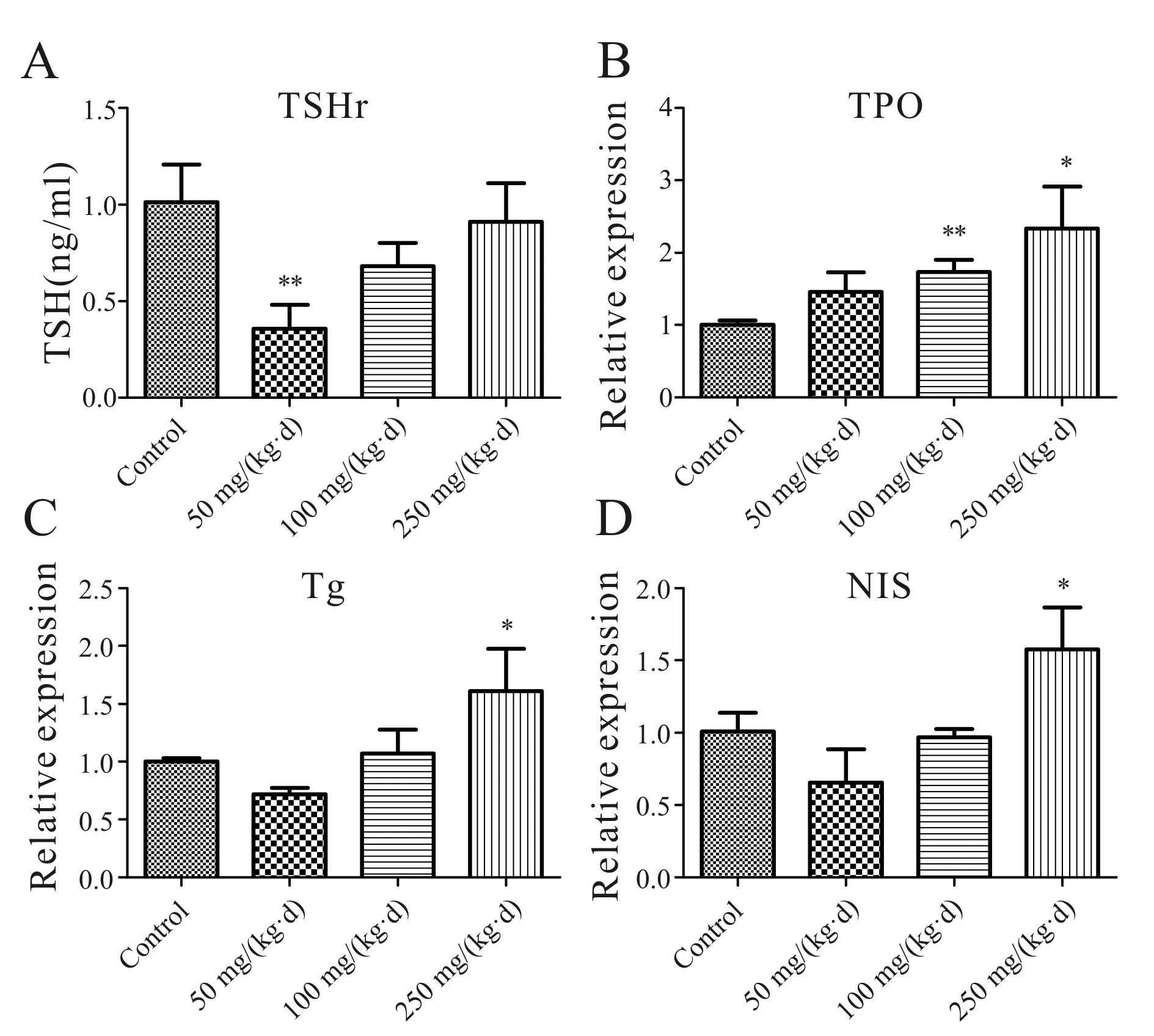
Fig. 3 Changes of gene expressions in thyroid tissue induced by TDCIPP(n=8)
有7个甲状腺激素转运基因:转甲状腺素蛋白(transthyretin, TTR)、甲状腺激素生物基因转化脱碘酶1(type 1 deiodinase, DIO1)、排泄基因(udp-glucuronosyl-transferase-1A1, 1A6; UGT1A1, UGT1A6),甲状腺激素受体(TRα和 TRβ)以及毒物代谢基因CYP4503A1(cytochrome-p450-3A1 )被选为目的基因用于研究TDCIPP暴露对大鼠甲状腺功能的影响。在被测的7个目的基因中,仅有4个基因出现有意义的改变。与对照组相比,CYP3A1基因和UGT1A6基因在三个暴露组显著上调,尤其在高剂量组明显,两基因分别上调3.7倍和2.3倍(P<0.05)。DIO1基因的表达在高剂量组上调1.6倍(P<0.05)。TRβ mRNA表达水平均低于对照组,但只有在高剂量组才具有统计学意义,下调约51%(P<0.05,图4)。另外三个目的基因(UGT1A1, TTR, and TRα)均未发现有意义的改变。
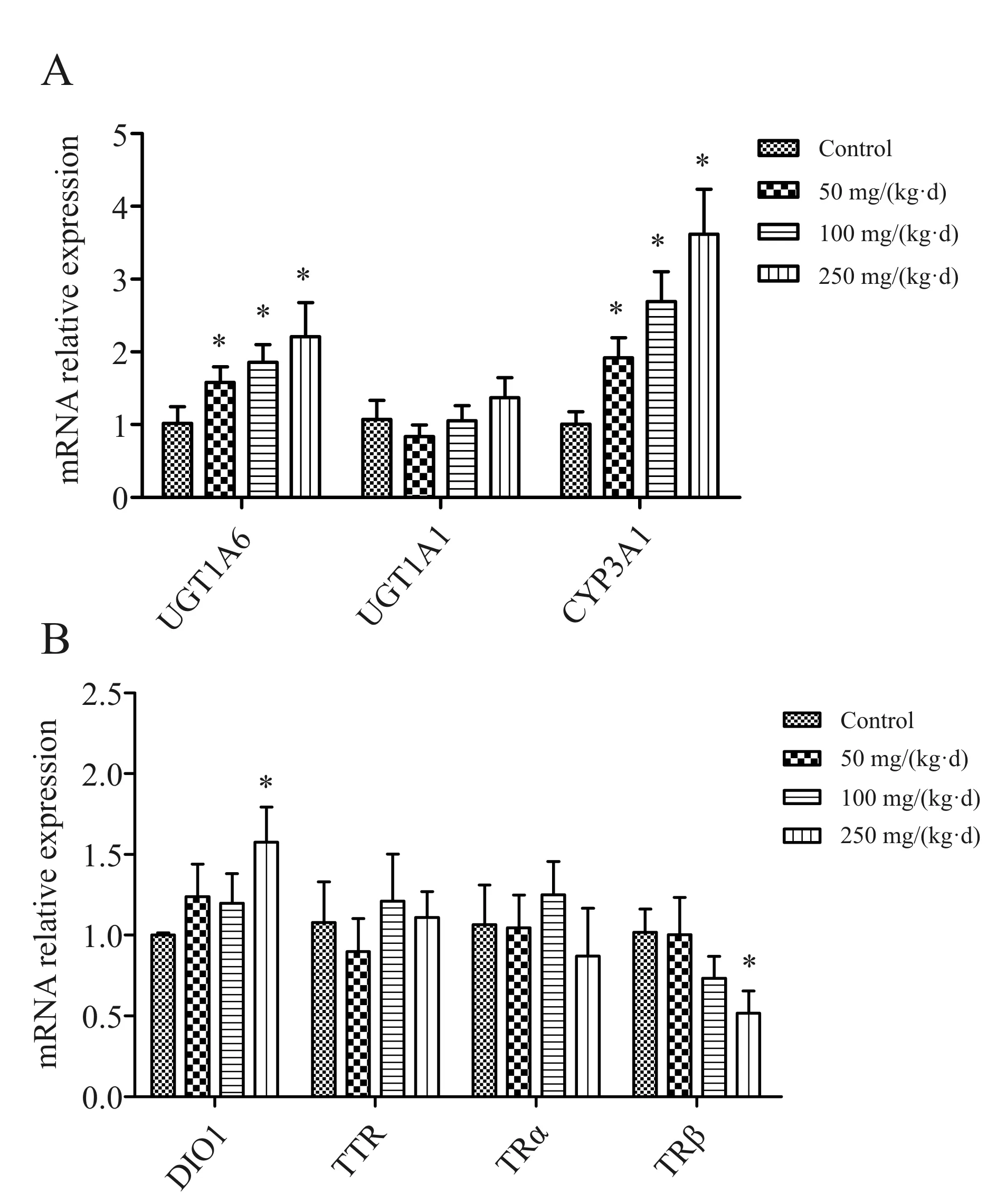
Fig. 4 Changes of genes correlate with thyroid induced by TDCIPP(n=8)
2.5 与甲状腺素相关蛋白的改变
运用Western blot 技术检测肝脏与甲状腺素生成相关的四个目的蛋白(TRβ,TTR, UGT1A6 and CYP3A1),选用GAPDH为内参蛋白。实验结果表明,与对照组比较,肝脏组织中TRβ蛋白表达呈现剂量依赖性下降趋势,中、高剂量组TRβ蛋白表达分别下降0.83倍和0.65倍,且具有统计学意义(P<0.05,P<0.01)。与TRβ蛋白表达趋势相反,肝脏组织中UGT1A6和CYP3A1蛋白表达水平呈现出有统计学意义的剂量依赖性上调趋势。与对照相比,其中UGT1A6分别上调1.4、1.65和1.8倍,CYP3A1分别上调1.4、2.4和3.3倍,差异有统计学意义(P<0.05,P<0.01)。TTR蛋白表达并未发现有统计学意义变化(图5)。
3 讨论
甲状腺是人体最大的内分泌腺体,具有维持调节人体正常体温、促进发育、调节物质代谢等作用。因此,甲状腺结构及功能的改变会涉及到体内甲状腺激素水平的变化,从而影响正常的集体功能[3]。
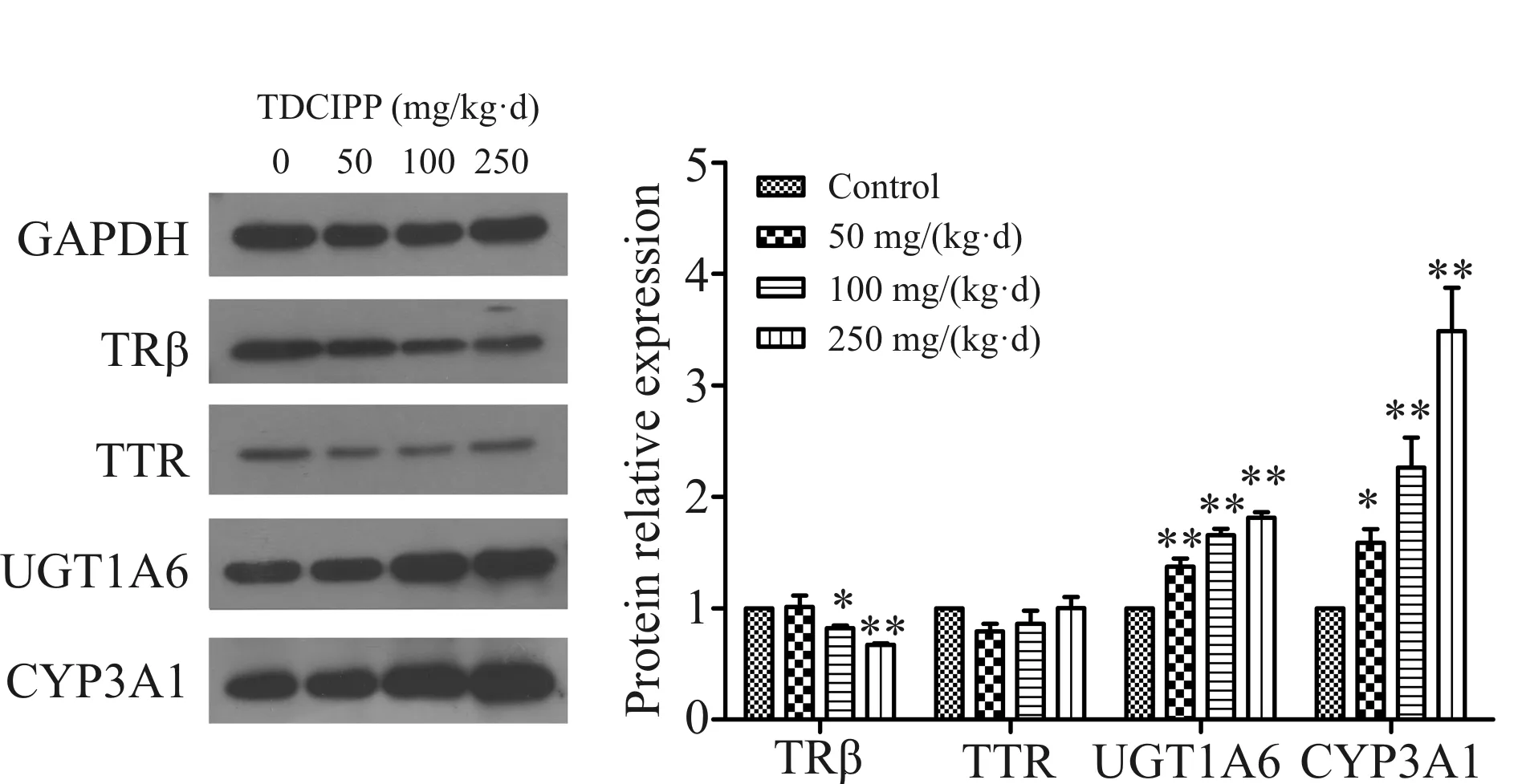
Fig. 5 Changes of proteins correlate with thyroid induced by TDCIPP in rat liver tissue (n=8)
本研究结果表明在TDCIPP的暴露下,低剂量组血清TSH水平明显降低,导致甲状腺激素分泌减少,从而引起血清中T3,T4水平下降趋势。然而血清TSH水平在高剂量组又明显升高。可能是由于低剂量TDCIPP暴露下大鼠血清T3和T4水平下降,而低水平的甲状腺激素循环负反馈调节下丘脑产生TRH,TRH作用于垂体使其释放TSH,因此TSH低剂量组升高。在TSH的持续刺激下,导致甲状腺出现增生等病理性改变;增生的甲状腺滤泡上皮细胞反过来又产生甲状腺激素。因此中、高剂量组的TSH的水平相对又有升高的表现,而T3水平在高剂量组出现显著性升高,这与TDCIPP暴露的斑马鱼模型中,血清T3水平升高,T4水平下降;鸡胚胎经过一定剂量TDCIPP处理后,同样降低血清T4水平,但不改变T3水平相似[4]。本研究中各剂量组大鼠的血清T4和FT4水平与对照组相比没有统计学意义,这与Moser等指出TDCIPP染毒的孕期Long-Evans 大鼠及其所产仔鼠血清T3和T4水平均未发现具有统计学意义的改变基本一致[5]。
甲状腺组织中,三个TDCIPP暴露组中TPO mRNA和蛋白水平的表达均高于对照组,NIS和TG mRNA表达在高剂量暴露组表达显著高于对照组。这可能是由于在TDCIPP的持续刺激下,甲状腺激素不能够满足机体需求时,甲状腺组织代偿需要,NIS、TG、TPO基因表达增多,以合成更多的甲状腺激素来满足机体的需要。另外与甲状腺激素水平相关的几个基因中,CYP3A基因编码单氧化酶类,该类酶能够催化外源化合物以及内源性胆固醇,UGT1A基因与肝脏代谢,甲状腺激素的胆汁清除密切相关[6]。这与此前报道TDCIPP暴露改变人工培养鸡的胚胎和肝细胞中CYP3A37, CYP2C45,UGT1A1 和UGT1A9基因的表达基本一致。在TDCIPP暴露下,机体T3和T4水平降低,引起与甲状腺TRβ受体相关通路的转录应答降低有关。这与TDCIPP暴露能够引起斑马鱼甲状腺TRα受体相关通路的转录应答有关报道一致[7],具体机制有待进一步研究。
总之, TDCIPP短期暴露可以对大鼠引起的潜在甲状腺毒性效应,上调细胞色素酶CYP3A1、葡糖苷酸转运酶UGT1A6基因和蛋白、脱碘酶DIO1基因表达,造成血清甲状腺激素T4和FT4下降趋势,甲状腺组织增生作为一种代偿机制,又会上调TG、NIS、TPO基因和蛋白的表达以便合成足够的甲状腺素,维持甲状腺激素稳态,保障机体正常生理功能。具体的过程和机制还有待于进一步研究。
