补骨脂素对TCP磨损颗粒所致大鼠成骨细胞损伤的干预作用及其机制*
2020-09-25陈宇峰董凡赫楼云玮寿今豪张慧婷周一超毛红娇
陈宇峰,董凡赫,楼云玮,寿今豪,张慧婷,周一超,严 明,毛红娇,张 云△
(1. 绍兴文理学院医学院,浙江 绍兴 312000; 2. 杭州电子科技大学自动化学院,浙江 杭州 310018)
人工关节假体植入体内后经过长期磨损、碰撞会产生大量的聚乙烯类、金属类和陶瓷类等磨损颗粒,这些微米粒径的细小颗粒可抑制成骨细胞的增殖、分化和功能[1-3]。同时,磨损颗粒还可诱导成骨细胞的凋亡,释放IL-6、PGE2和IL-18等炎症因子[4, 5],这些因子可促进破骨细胞的活化和骨吸收,造成假体周围骨溶解和关节无菌性松动。有研究表明,肌醇依赖酶1α(inositol dependent enzyme 1 alpha,IRE1α))是内质网膜上的3种跨膜信号蛋白之一,被激活后可剪切XBP1,并激活其下游细胞凋亡信号调节激酶 1(apoptosis signal regulating kinase1,ASK1)及 C-Jun氨基酸末端激酶(c-Jun N-terminal kinase,JNK),促进细胞凋亡。2014年Liu等[6]报道纳米合金颗粒在诱导假体周围成骨细胞凋亡过程中伴随着葡萄糖调节蛋白78(glucose regulated protein,GRP78)和IRE1α表达的上调,而腹腔注射内质网应激的抑制剂4-苯基丁酸可显著抑制上述反应,这说明IRE1α介导的内质网应激通路可能在磨损颗粒诱导的假体周围成骨细胞损伤过程中发挥重要作用,可作为治疗假体周围成骨细胞凋亡及损伤的治疗靶点。
补骨脂素(psoralen)是从豆科植物补骨脂(PsoraleacorylifoliaL.)的干燥果实中提取的有效活性成分之一。现代药理学实验表明补骨脂素具有抗肿瘤、抗氧化和抗炎作用[7, 8]。有研究显示补骨脂素具有雌激素样作用,可促进成骨细胞的增殖和分化[9]。最近,Chen等[10]报道,补骨脂素能显著抑制绝经后患有骨质疏松症妇女髋关节中的成骨细胞凋亡的现象,促进成骨细胞增殖和分化。但是,补骨脂素对TCP磨损颗粒诱导成骨细胞损伤的影响及机制目前尚不清楚。本研究通过TCP磨损颗粒与成骨细胞共孵育构建成骨细胞损伤的体外实验模型,研究补骨脂素对TCP磨损颗粒诱导的成骨细胞损伤的影响,并阐明内质网应激反应及IRE1α-XBP1s-JNK信号通路在其中所发挥的作用,以期为补骨脂素治疗假体周围骨溶解和关节松动提供理论依据。
1 材料与方法
1.1 实验动物与主要试剂
SPF级1日龄SD大鼠,购于浙江省军事医学科学院实验动物中心(实验动物许可证号:SCXK(浙)2014-0001,合格证号1712060013)。
TCP磨损颗粒由浙江大学化学系馈赠;补骨脂素(HPLC≥98%)购自上海源叶生物科技有限公司;DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;WST-1试剂盒、BCA试剂盒、RIPA裂解液、SDS-PAGE凝胶配制试剂盒和碱性磷酸酶(ALP)活性检测试剂盒购于上海碧云天生物技术研究所;茜素红S染液购自Solarbio Life Sciences公司;超敏ECL化学发光检测试剂盒和小鼠抗β-actin抗体购于杭州联科生物技术有限公司;兔抗GRP78/94抗体、兔抗IRE1α抗体、兔抗XBP1s抗体、兔抗JNK抗体、兔抗p-JNK(p-JNK)和小鼠抗β-actin抗体等购于美国Cell Signaling公司;PVDF膜购于美国Millipore公司。
1.2 成骨细胞的分离、培养与鉴定[11]
取1日龄SD大鼠断头处死经75%乙醇消毒5 mim后,剥离颅盖骨置于PBS液中,去除骨膜和软组织,用PBS冲洗2次,剪成1 mm3碎块;然后用 0.25%胰蛋白酶消化15 min,再用Ⅱ型胶原酶(1 mg/ml)37℃消化90 min,收集细胞悬液,加入等体积含10%FBS的DMEM培养基终止消化,1 000 r/min离心10 min,弃上清液。用含10%FBS的DMEM培养基重悬细胞并接种于培养瓶中,置于37℃、5% CO2的培养箱中进行培养。通过2~3次差速贴壁法去除成骨细胞中混杂的成纤维细胞,从而获得高纯度的成骨细胞。分离得到的成骨细胞分别应用0.4%台盼蓝染色和ALP染色进行活性检测和鉴定。
纯化后的成骨细胞接种于培养瓶中常规培养24 h后换液,待瓶内细胞的80%铺满瓶底时,加入0. 25%胰蛋白酶进行消化传代,后续实验用3~5代成骨细胞,接种密度为1×104cells/well。
1.3 模型的构建与实验分组
成骨细胞与TCP磨损颗粒(0.1 mg/ml)共孵育48 h构建成骨细胞损伤的体外实验模型。实验随机分组为5组:(1)正常对照组(Contro1):细胞正常培养,不做任何处理;(2)模型(TCP,0.1 mg/ml)组:按照上述损伤模型方法培养48 h;(3)补骨脂素干预组:补骨脂素(10-7mol/L、10-6mol/L和10-5mol/L)预处理4 h后,加入TCP(0.1 mg/ml)继续培养48 h。每组设4~6个复孔,并设置 3~4次独立重复实验。
1.4 WST-1法检测成骨细胞活性
成骨细胞接种于96孔培养板中培养24 h后,分别按照分组进行处理。然后加入WST-1(每孔20 μl)温室避光孵育1 h,置于酶标仪下测定OD450nm,并计算成骨细胞活性的变化,确定补骨脂素的最佳干预剂量。
1.5 流式细胞术检测成骨细胞凋亡
成骨细胞接种于24孔培养板中培养24 h,分别按照分组进行处理。通过消化获取成骨细胞,经 1 000 r/min离心10 min后去除培养基,PBS清洗2次。 然后加入5 μl Annexin V-FITC/10 μl碘化丙啶(PI),避光室温37℃温育15 min。最后加入200 μl PBS并混匀后上流式细胞仪检测各组成骨细胞凋亡情况。FITC的激发波长为488 nm,检测发射波长575 nm。
1.6 化学比色法检测成骨细胞内碱性磷酸酶(alkaline phosphatase,ALP)活性
ALP为成骨细胞分化时所分泌,ALP活性与成骨细胞的分化程度呈正相关[12]。成骨细胞接种于24孔培养板中培养24 h,分别按照分组进行处理。弃去上清,PBS清洗2次,0.1%TritonX-100作用30 min后收集裂解液,应用ALP试剂盒测定成骨细胞ALP活性。
1.7 矿化结节形成观察
成骨细胞接种于24孔培养板中培养24 h,采用补骨脂素(10-7mol/L、10-6mol/L、10-5mol/L)预孵育4 h后,分别加入TCP磨损颗粒(0.1 mg/ml)分别继续孵育14 d,隔日换药1次。14 d后,当见到较多不透明的矿化结节时取出培养板,PBS清洗3次,加入4%多聚甲醛固定10 min。弃固定液,PBS清洗3次后与0.1%茜素红染液孵育30 min,PBS清洗后置于显微镜下观察矿化结节形成情况。对橘红染色且边界较清晰,短径大于100 μm的结节进行计数,并比较各组矿化结节形成情况。
1.8 Western blot检测蛋白表达[13]
成骨细胞接种于24孔培养板中培养24 h,分别按照分组进行处理。去除上清液后每孔加入RIPA裂解液(80 μl)冰上裂解30 min。经13 000 r/min离心15 min上清液,利用BCA试剂盒检测各组蛋白浓度。各组蛋白经煮沸10 min,冷却后每孔上样30 μg蛋白,行15%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经10%脱脂牛奶常温封闭2 h后,分别加入兔抗GRP78/94抗体(1∶ 1 000稀释)、兔抗IRE1α抗体(1∶1 000稀释)、兔抗XBP1s抗体(1∶1 000稀释)、兔抗JNK抗体(1∶ 1 000稀释)和兔抗phospho-JNK(p-JNK)抗体(1∶ 1 000稀释)和小鼠抗β-actin抗体(1∶1 000稀释)4 ℃孵育过夜。次日用TBST洗涤3次后加入HRP标记的二抗(TBST配制)室温孵育2 h,TBST清洗3次加入ECL显色液,通过凝胶成像系统扫描分析各蛋白表达的变化。
1.9 统计学处理
2 结果
2.1 成骨细胞形态观察与鉴定
分离得到的细胞具有典型成骨细胞的形态特征,呈梭形或多边形,时有突起(图1A)。ALP染色后胞质中含有灰黑色颗粒状或块状沉淀,即ALP染色呈阳性(图1B),表明从1日龄SD乳鼠颅骨中分离得到细胞为高纯度的成骨细胞。另外,台盼蓝染色结果显示活细胞数为96.7%,可满足后续的实验研究。
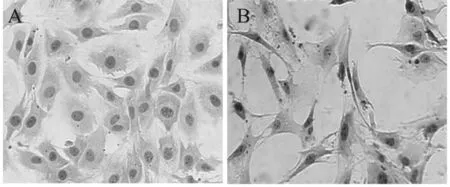
Fig. 1 Representative photograps of calvarial osteoblasts(×200)
2.2 补骨脂素对成骨细胞增殖的影响
与Control组比较,补骨脂素浓度在10-8mol/L-10-4mol/L时细胞活性明显增加,表明补骨脂素对成骨细胞增殖无明显抑制作用,且能促进细胞增殖。其中10-7mol/L、10-6mol/L和10-5mol/L促增殖作用最为显著(图2,P<0.05)。因此,本研究选取10-7mol/L、10-6mol/L和10-5mol/L为干预剂量,研究补骨脂素对TCP磨损颗粒诱导的成骨细胞损伤的影响。
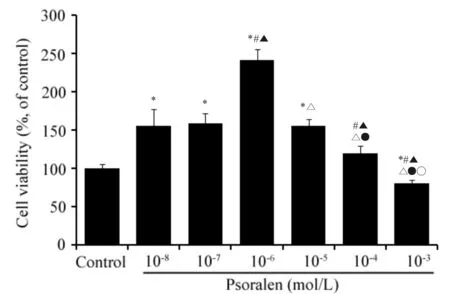
Fig. 2 Effect of psoralen on cell viability of calvarial osteoblasts ( n=4)
2.3 补骨脂素对TCP磨损颗粒诱导的成骨细胞增殖、ALP活性及矿化结节的影响
与Control组比较,TCP组成骨细胞活性、ALP活性和矿化结节形成数量明显减少(表1,P< 0.05);与TCP组比较,补骨脂素各组成骨细胞活性、ALP活性和矿化结节数目显著增加,其中补骨脂素(10-6mol/L)组抑制TCP磨损颗粒所致成骨细胞损伤的作用最强,而其余两组的抑制作用稍弱(表1,P<0.05)。
Tab. 1 Effect of psoralen on the decrease of cell viability, ALP activity and in the number of mineralized nodules caused by TCP particles in calvarial osteoblasts n=4)
2.4 补骨脂素对TCP磨损颗粒诱导的成骨细胞凋亡的影响
流式细胞术定量分析显示:与Control组比较,TCP组成骨细胞凋亡显著增加,凋亡率增加为Control组的7.19倍(图3,表2,P<0.05);与TCP组比较,补骨脂素组成骨细胞凋亡明显降低,其凋亡率分别减少为TCP组的73.72%(10-7mol/L)、39.61%(10-6mol/L)和58.93%(10-5mol/L),以补骨脂素(10-6mol/L)组抑制成骨细胞凋亡作用最强(图3,表2,P<0.05)。
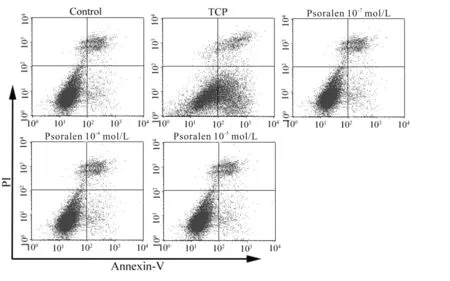
Fig. 3 Apoptosis analyzed by the flow cytometry
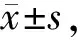
Tab. 2 Effect of psoralen on apoptosis of calvarial osteoblasts caused by TCP wear particles (%, n=4)
2.5 补骨脂素对TCP磨损颗粒诱导的成骨细胞IRE1α通路活化的影响
与Control组比较,TCP组成骨细胞发生内质网应激反应,并激活IRE1α-XBP1s-JNK信号通路,表现为内质网应激标志分子GRP78/94及IRE1α通路蛋白质IRE1α、XBP1s和p-JNK等表达均明显上调(图4,表3,P<0.05);与TCP组比较,补骨脂素(10-6mol/L 、10-5mol/L)组成骨细胞中GRP78/94、IRE1α、XBP1s和p-JNK等蛋白质表达明显下调,其中补骨脂素(10-6mol/L)组对上述蛋白质表达的影响最为显著,而补骨脂素(10-5mol/L)组的作用稍弱于补骨脂素(10-6mol/L)组,差异有统计学意义(图4,表3,P<0.05)。
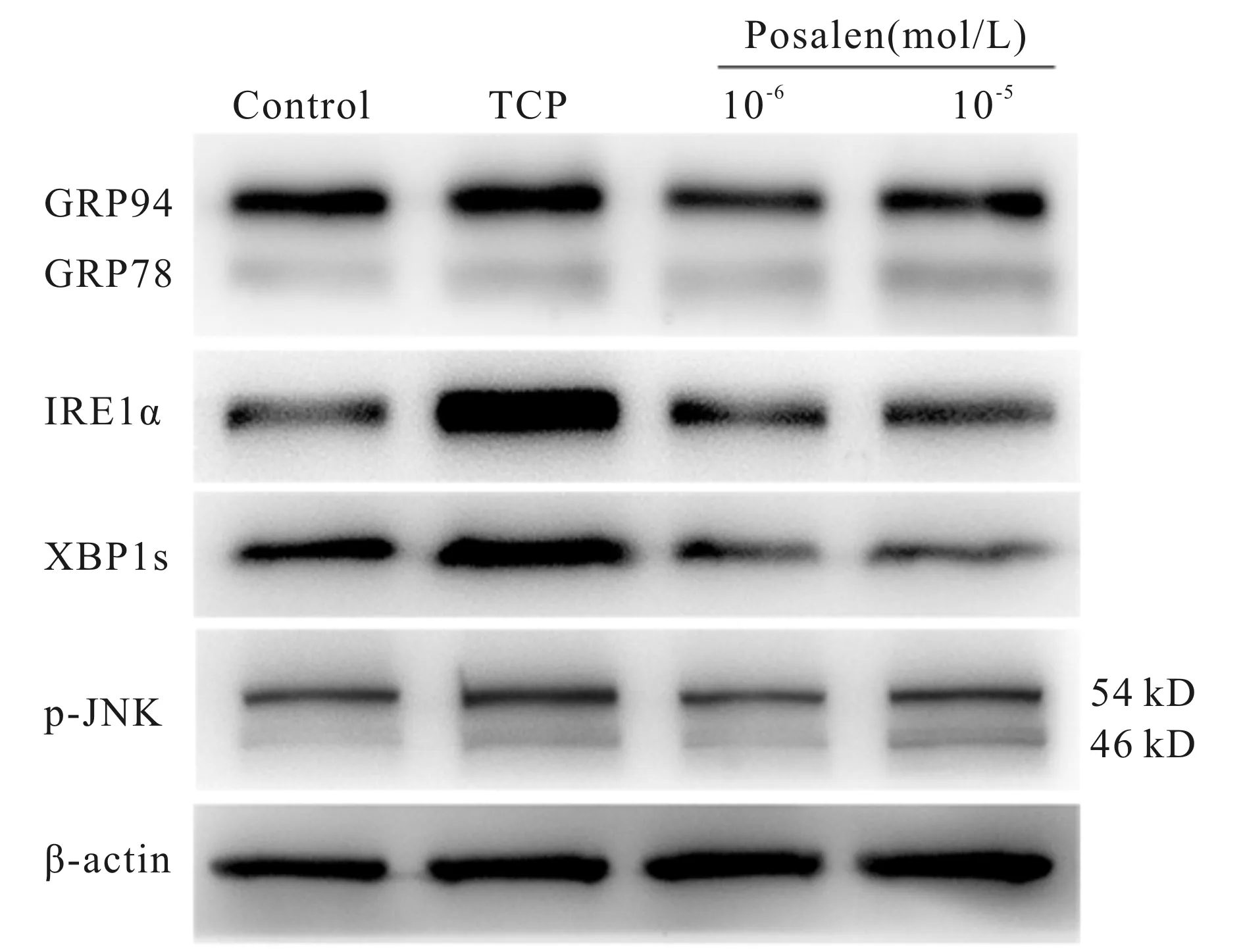
Fig. 4 Protein expressions of IRE1α signaling pathway examined by Western blot
GRP78/94: Glucose regulated protein 78/94; IRE1α: Inositol-requiring enzyme 1α; XBP1s: X-box binding protein1 spliced; p-JNK: phosphorylated c-Jun N-terminal kinase; TCP: tricalcium phosphate
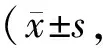
Tab. 3 Effect of psoralen on activation of IRE1α-XBP1s-JNK signaling pathway caused by TCP wear particles in calvarial osteoblasts n=4)
3 讨论
磨损颗粒诱导的假体周围骨溶解是导致假体晚期松动及关节置换失败的主要原因之一[14, 15]。有研究表明,PE、TCP和Ti等磨损颗粒可诱导成骨细胞损伤及凋亡[1-4],与翻修术假体周围成骨细胞损伤情况基本一致[16]。本研究结果也显示:TCP磨损颗粒与成骨细胞孵育48 h可明显抑制成骨细胞活性、ALP活性和矿化结节的生成,并诱导成骨细胞凋亡,释放PGE2、IL-6和IL-18等因子[1, 5],从而促进破骨细胞活化与骨溶解。提示:成骨细胞在磨损颗粒诱导假体周围骨溶解中发挥重要的作用,是防治假体周围骨溶解和关节松动的另一种靶细胞。
补骨脂素是从豆科植物补骨脂PsoraleacorylifoliaL的成熟果实中分离出的一种香豆素类化合物,具有促进成骨细胞增殖、分化,抑制破骨细胞性骨吸收并增加骨密度的雌激素样作用。有报道指出补骨脂素可刺激成骨细胞分泌Collagen I、OCN、OPN 和 ALP,剂量依赖性地上调BMP-2和BMP-4等基因的表达,并增加磷酸化Smad1、Smad5、Smad8和Osterix等蛋白水平,促进成骨细胞的成骨分化[9]。此外,补骨脂素还能抑制雌激素缺乏所致的成骨细胞凋亡[10],阻止破骨细胞生成及骨溶解。本文研究补骨脂素对TCP磨损颗粒诱导成骨细胞增殖、分化和凋亡的影响,结果表明补骨脂素可显著抑制TCP磨损颗粒诱导成骨细胞活性的降低、功能的损伤,减少成骨细胞凋亡,但是其调控机制目前还不清楚。
有研究证实内质网应激参与调控成骨细胞凋亡[16-19],可能在假体周围骨溶解和关节松动中发挥重要的作用。内质网是细胞内蛋白质合成、修饰和折叠的场所。缺氧、葡萄糖缺乏、蛋白转运异常及Ca2+耗竭等病理刺激均可诱导未折叠蛋白或错误折叠蛋白在内质网腔内大量堆积,引起内质网应激。IRE1α又称核酸内切酶,是ER膜上的I型跨膜蛋白,在非内质网应激条件下,IRE1α与内质网分子伴侣GRP78/94结合在一起,处于无活性状态。而当内质网应激反应时,IRE1α与GRP78/94解离后,剪切细胞质中XBP1形成剪切型 XBP1( XBP1s),后者进入细胞核与内质网应激元件结合,增强内质网应激分子伴侣GRP78/94蛋白的表达,恢复内质网功能[20]。但是,发生严重内质网应激时,活化后IRE1α还募集肿瘤坏死因子受体(TNF-receptor associated factor 2,TNFR2),并与凋亡信号调节激酶(ASK1)形成TRAF2-ASK1-JNK复合体,激活其下游JNK通路而诱导细胞凋亡[21, 22]。本研究结果显示:TCP组成骨细胞中GRP78/94、IRE1α、XBP1s和p-JNK等蛋白质表达明显上调,这说明在TCP磨损颗粒诱导成骨细胞凋亡过程中IRE1α-XBP1-JNK通路被激活。补骨脂素干预后成骨细胞中GRP78/94、IRE1α、XBP1s和p-JNK等蛋白表达显著下调,提示补骨脂素可显著减弱TCP磨损颗粒诱导的成骨细胞中内质网应激反应及IRE1α-XBP1通路的活化,抑制其下游JNK的磷酸化,从而阻止成骨细胞内质网应激性凋亡,其趋势与补骨脂素对成骨细胞的活性、ALP活性和矿化结节形成等指标的影响一致。
综上,补骨脂素可通过减弱IRE1α-XBP1s-JNK信号通路的活化而干预TCP磨损颗粒诱导的成骨细胞损伤,从而减轻假体周围骨溶解和关节晚期松动。本研究旨在为治疗假体周围骨溶解和关节松动提供新思路、新方法和新的治疗靶标。
