瘦素对糖尿病大鼠糖脂代谢及炎性因子的影响*
2020-09-25朱建忠隋月林刘媛媛乔跃兵
朱建忠,赵 灿,隋月林,刘媛媛,乔跃兵
(沧州医学高等专科学校解剖教研室,河北 沧州 061000)
糖尿病是以高血糖为主要特征的代谢性障碍类疾病,为临床上常见疾病。随着我国生活水平的不断提高,饮食结构的富营养化,使得糖尿病的发病率越来越高,且发病群体逐年趋近于年轻化[1]。瘦素是一种肽类激素,由肥胖基因编码,在脂肪组织中合成并分泌,对控制摄食,增加机体能量消耗,以及抑制脂肪的合成起到重要的作用[2]。研究表明人类的肥胖与瘦素(Leptin)抵抗关系密切,血清瘦素与胰岛素水平在糖尿病的发病过程中具有潜在作用[3]。Leptin前体是由167个氨基酸残基组成,N末端有21个氨基酸残基信号肽,通过抑制体内神经肽Y(neuropeptide Y,NPY)基因活跃程度,从而增强体内荷尔蒙黑色素刺激激素(alpha-melanocortin stimulating hormone,α-MSH)活跃度增强来调节体重[4]。以下丘脑为作用介质将Leptin与胰岛素紧密联系起来,形成Leptin-神经肽Y(NPY)-胰岛素负反馈环,胰岛素可促进瘦素的分泌,瘦素对胰岛素的合成和分泌发挥负反馈调节作用[5]。炎症介质在糖尿病发生、发展中发挥着重要的作用,炎症因子可导致B细胞功能受损,使机体血糖水平升高,而慢性高血糖状态同时也能进一步造成氧化应激增加,加强炎性反应。目前已有研究表明机体处于炎症状态时血清瘦素水平升高,瘦素在调节能量代谢的同时,还能对炎性因子调控和交感神经兴奋有重要作用。姚艳敏[6]等研究不同剂量瘦素对兔急性肺栓塞的炎症因子影响,结果提示经50 μg/ml瘦素处理后,炎症因子(TNF-α、IL -8)4 h明显下降,其认为可能与外源性瘦素通过降低中性粒细胞的聚集和浸润,减轻脂质过氧化和自由基损伤等关系密切。机体内瘦素水平失衡能引起肥胖和糖尿病等疾病的发生,炎症因子与细胞表明的受体结合后可干扰胰岛素受体信号正常转导,降低胰岛素敏感性。然而一定量外源性瘦素的摄入能发挥由“脂肪-胰岛素”内分泌轴激素双向调节反馈作用。高剂量瘦素预处理可能并未降低机体内实际瘦素水平,会加剧炎性反应及机体氧化应激状态。控制外源性瘦素摄入量也是研究过程中的重点。因此,本研究通过建立糖尿病大鼠模型,并给予不同剂量的外源性瘦素,探讨瘦素对糖尿病脂代谢的影响及炎症因子表达,为瘦素治疗糖尿病提供借鉴与参考。
1 材料与方法
1.1 材料与仪器
健康Wistar雄性大鼠60只,体重180~220 g,由河北医科大学动物中心提供,合格证为医动字第04057号。饲养于沧州医学高等专科学校动物房。饲养条件:大鼠分笼喂养,自由饮水进食,保持室内温度20~24℃,相对湿度维持在40%~50%,实验前将大鼠在动物房中适应性饲养7 d。
链脲霉菌素(STZ,Sigma公司);重组瘦素购自厦门慧嘉生物科技有限公司;胰岛素放射免疫分析试剂盒(100管/盒,上海荣生生物技术有限公司);甘油三酯(triglyceride, TG),血清总胆固醇(total cholesterol ,TC),低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C),高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C),脂质过氧化产物丙二醛(malondialdehyde peroxide,MDA),白细胞介素-6(interleukin-6,IL-6),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒购自南京建成生物工程研究所。
电子分析天平(Mettler Toledo);GF-800型全自动自动生化分析仪(武汉市天安医疗器械有限公司);HGM-111血糖仪(欧姆龙);GL-16G-Ⅱ型高速冷冻离心机(上海安亭科学仪器厂);超声匀浆机(上海乔枫实业有限公司)。
1.2 糖尿病大鼠模型建立及分组
选取60只大鼠适应性喂养7 d,随机选取10只大鼠作为对照组,对照组给予基础饲料(购自中国医学科学院协和动物研究所,其配方为:面粉25%、麦片25%、玉米面25%、豆面10%、鱼粉8%、骨粉4%、酵母粉2%、精盐1%)常规喂养。50只大鼠用作糖尿病造模,方法为持续高糖高脂饲料(江苏协同生物有限公司,生产批号:20190730,配方为:5 kg标准饲料含:基础饲料47.7%,麦麸20%,鱼粉5%,谷粉1%,食盐0.5%,胆固醇1%,牛胆盐 0.2%,蛋黄粉10%,猪油10%)喂养一个月,实验期间观察动物体重、饮食、饮水和尿量的变化[7]。大鼠造模前禁食、不禁水12 h,给予腹腔注射25 mg/kg STZ(以pH 4.2的0.1 mol/L枸橼酸缓冲液配成 0.25%浓度)一周后采血,以随机血糖≥13.8 mmol/L为糖尿病模型标准[8]。选取造模成功大鼠40只随机分为模型组、瘦素低剂量组(20 μg/kg)、瘦素中剂量组(50 μg/kg)和瘦素高剂量组(100 μg/kg)每组10只。模型组给予灌胃等剂量生理盐水,其它各组对应每日给予灌胃瘦素,持续给药5 d,并继续给予高糖高热量饲料喂养。
1.3 指标测定
于末次给药后,大鼠禁食12 h后尾静脉取血5 ml,摇匀,4℃加入抗凝剂,2 000 r/min低温离心10 min,取血清。大鼠血糖含量采用GOD-PAP法进行测定,放射免疫法测定血清中胰岛素含量,TG、TC、LDL-C、HDL-C采用全自动生化分析仪,ELISA方法测定MDA、TNF-α及IL-6。
1.4 Western blot检测脂肪组织中Leptin表达
末次给药后完成取血的大鼠,将大鼠断头处死后,选取大鼠股部皮下脂肪组织充分匀浆后,加入裂解液冰盒上裂解,超声波处理后12 000 r/min离心2 min,吸取上清液,测定总蛋白质含量。根据蛋白质浓度,将已溶解于加样缓冲液的总蛋白质经SDS-聚丙烯酰胺凝胶电泳分离,电泳结束后转移至硝酸纤维素膜上,脱脂奶粉封闭液封闭2 h,加入抗瘦素多克隆抗体Ⅰ抗(1∶500,兔抗鼠多克隆抗体,美国SIGMA公司)进行Western blot蛋白印迹杂交。置于4℃冰箱过夜,PBST洗膜,加抗兔Ⅱ抗(1∶5 000,碱性磷酸酶偶联的小鼠抗兔IgG,美国SIGMA公司)4℃孵育6 h,PBST洗膜,按照化学发光试剂盒说明书操作加入发光液,发光显色,用计算机图像分析软件(GelPro31)进行分析。
1.5 统计学处理
2 结果
2.1 瘦素对大鼠血糖及胰岛素水平的影响
对照组大鼠实验前后血糖水平维持正常没有显著变化。与对照组比较,模型组大鼠建模后FBG水平显著增加(P<0.01),表明糖尿病大鼠模型构建成功;与模型组比较,各组瘦素组均能降低大鼠FBG水平,且瘦素中、高剂量大鼠血糖显著降低(P< 0.05,P<0.01);瘦素高剂量组胰岛素水平显著降低(P<0.01),表明瘦素对胰岛素的合成和分泌发挥负反馈调节作用。与模型组比较,瘦素表达量显著降低(P<0.01)。对各组瘦素组间比较,给药后三组大鼠FBG及INS无统计学差异(P>0.05,表1)。
2.2 瘦素对大鼠血脂水平的影响
与对照组比较,模型组及各组瘦素组TC、TG和LDL-C水平显著升高(P<0.01),HDL-C水平均显著降低(P<0.01)。与模型组比较,瘦素高、中、低剂量组大鼠TC、TG、LDL-C水平有降低作用;HDL-C水平有升高作用;且中、高剂量组TC水平显著下降(P<0.05,P<0.01);高剂量组TG、LDL-C水平显著降低(P<0.05);高剂量组HDL-C水平显著升高(P<0.01)。不同剂量组瘦素组间比较,瘦素高剂量组在降低TC、TG、LDL-C水平,升高HDL-C水平优于中、低剂量组(P<0.05,表2)。
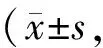
Tab. 1 Effects of leptin on FBG and INS in rats n= 10)
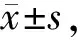
Tab. 2 Changes of blood lipid level in different groups of rats (mmol/L, n= 10)
2.3 瘦素对大鼠MDA、TNF-α、IL -6水平的影响
与对照组比较,模型组及各组瘦素组大鼠MDA、TNF-α、IL -6水平均显著升高(P<0.01);与模型组比较,瘦素低、中、高剂量组均能降低大鼠MDA、TNF-α水平,且瘦素高剂量组大鼠MDA、TNF-α水平显著降低(P<0.01);瘦素中、高剂量组的IL-6水平显著升高(P<0.05,P<0.01)。不同剂量瘦素组间比较,高剂量组MDA、TNF-α水平与低、中剂量组相比有显著性差异(P<0.05)。IL -6水平三组比较无统计学差异(P>0.05,表3)。
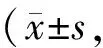
Tab. 3 The MDA, TNF - α, IL-6 levels in different groups of rats n= 10)
2.4 糖尿病大鼠脂肪组织中瘦素表达变化
Western blot检测糖尿病大鼠脂肪组织中瘦素表达情况。与对照组(38.38±12.19)相比,模型组(52.27±10.93)脂肪中瘦素水平表达显著升高。与模型组相比,瘦素高剂量组(40.13±9.87)、中剂量组(44.68±10.23)、低剂量组(47.35±12.09)依次表达降低。与模型组相比,瘦素高、中、低剂量组分别下降18.99%、16.67%和11.85%,表明在外源性瘦素作用与糖尿病大鼠,大鼠脂肪中瘦素表达呈现逐渐降低趋势(图1)。

Fig. 1 Leptin expression in adipose tissue detected by Western blot analysis
3 讨论
糖尿病是一种常见的代谢紊乱疾病,以胰岛素分泌或作用缺陷为主要特征,是引起心脑血管疾病高危险因素[9]。糖尿病易引发多种疾病,如合并心脑血管疾病、肾病、眼病,也有研究证实糖尿病易于诱发抑郁症,瘦素是脂肪细胞为保持能量平衡分泌的一种激素,为Ob基因(Obesity genes)编码的蛋白质产物,其参与机体摄食、体温及能量平衡的调控,调节脂类代谢及胰岛素分泌[10]。在许多疾病如肥胖、糖尿病等生理病理过程中均发挥着重要生物学活性。有研究发现人体内存在“脂肪-瘦素-胰岛素轴”,瘦素与胰岛素之间存在双向负反馈作用,在肥胖者体内存在高瘦素血症、瘦素抵抗和2型糖尿病中的胰岛素抵抗相并行,这与另外一种研究证明促进脂肪成熟细胞瘦素可能是抑制性信号相吻合,瘦素可能参与胰岛素抵抗和糖尿病的发生[11]。本研究检测糖尿病大鼠脂肪组织中瘦素表达情况,结果显示模型组脂肪组织中瘦素表达增高,瘦素高、中、低剂量组依次表达下降,表明在外源性瘦素作用于糖尿病大鼠,其脂肪瘦素表达呈现逐渐降低趋势。这可能与瘦素及胰岛素对机体代谢起到双向调节作用相关,外源性瘦素进入体内,脂肪组织内的瘦素水平反而增高,可能与通过调节机体内实际瘦素水平,发挥着由瘦素与胰岛素介导的“脂肪-胰岛素”内分泌轴激素双向调节反馈作用。目前另有部分研究证实[12],在给予外源性瘦素高剂量(含量>100 μg/kg)干预,会导致炎症反应加剧,使机体处于氧化应激状态,脂肪内瘦素表达明显降低,外源性瘦素干预用量选择为实验研究的重点。本研究结果发现,在造模成功的糖尿病大鼠中,给予不同剂量瘦素进行干预能显著降低大鼠FBG水平,瘦素高剂量组胰岛素水平显著降低(P<0.01)。与模型组相比,机体内瘦素水平也随着外源性瘦素干预表达逐渐降低。
糖脂代谢紊乱是糖尿病主要表现症状之一[13]。长期糖脂代谢紊乱可导致大鼠机体氧化应激和抗氧化防御体系失衡[14]。有研究表明瘦素能降低人肝L-02脂变细胞内TG的含量,呈剂量依赖关系,其作用机制可能与PPARα及其目标基因表达上调有关[15-16]。血清中瘦素水平与血脂、血压之间存在复杂的相互关系,正常体重组血清瘦素水平与TG呈正相关,在男性血清瘦素水平还与TC、TG、LDL-C呈正相关[17]。本研究结果显示在给予一定浓度瘦素干预能够改善血脂代谢紊乱,抑制胰岛素水平,这与“脂肪-胰岛素”轴脂肪增加可促进胰岛素分泌有相关性,其机制为通过抑制胰岛素分泌减少脂肪的合成与贮存。
瘦素在人体内对人体起到双向调节作用,瘦素水平上升易造成瘦素抵抗,加剧炎性反应。瘦素水平下降能促进信号传导的缺失,从而造成生理水平瘦素对心脏功能调节失衡。炎症是连接糖尿病与其并发症之间的纽带[18]。TNF-α为巨噬细胞分泌的小分子蛋白,是直接杀伤肿瘤作用最强的生物活性因子之一[19]。余帆等[20]对比不同剂量瘦素对2型糖尿病大鼠心肌功能影响,给予一定浓度外源性瘦素预处理能降低TNF-α水平,表明瘦素可以减轻炎症反应。IL-6为一种细胞因子能刺激参与免疫反应的细胞增殖、分化并提高其功能。糖尿病患者血浆中IL-6水平高于正常非肥胖者,且两者呈正相关,有研究在评估糖尿病患者疾病进展中,通过在外周给予瘦素后,能使血清IL-6水平升高,推测瘦素参与糖尿病发展机制可能与IL-6相关。TNF-α和IL-6可通过抑制胰岛素受体络氨酸激酶活性,降低胰岛素依赖的葡萄糖转运分子Glut4的表达,引起外周组织中胰岛素抵抗。MDA是重要的脂质过氧化代谢产物,可反应过氧化程度及自由基活性,糖尿病患者持续高血糖易引起氧化应激反应增强[21]。本研究结果提示,外源性瘦素干预能降低糖尿病大鼠MDA、TNF-α、升高IL-6水平,并可能改善由MDA和TNF-α所带来的炎症及机体应激状态,发挥出保护机体免受损害的作用,从而阻止糖尿病疾病进一步进展。
综上所述,瘦素在糖尿病发生、发展过程中起到重要的作用。瘦素的水平分泌异常是诱发糖尿病的因素之一。给予一定浓度外源瘦素干预能显著改善糖尿病大鼠糖脂代谢水平,显著降低MDA、TNF-α水平和升高IL-6水平。在临床糖尿病的治疗过程中,给予一定浓度外源性瘦素能减轻由炎症反应,氧化应激,血脂代谢紊乱,以及胰岛素抵抗所带来的损伤,降低糖尿病疾病进展的风险,为临床上治疗糖尿病提供理论依据。
