精胺对高糖引起的大鼠心肌纤维化的影响及其机制*
2020-09-25李法东邵小婷李思葳张欣颖赵冰冰徐长庆
扈 敬,李法东,邵小婷,李思葳,张欣颖,赵冰冰,徐长庆,魏 璨
(哈尔滨医科大学病理生理学教研室,黑龙江 哈尔滨 150086)
糖尿病是全球常见的以代谢紊乱为特征的疾病[1]。糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病的重要并发症,作为独立于高血压、冠心病等特异性心肌病,其发生机制十分复杂,可能涉及代谢紊乱、心肌纤维化、氧化应激、心肌细胞凋亡等[2]。心肌纤维化是糖尿病心肌病心肌重构的重要标志,也是导致心脏功能和结构改变的重要原因[3]。然而,糖尿病心肌纤维化的发生机制较为复杂,迄今尚不清楚。
心肌成纤维细胞(cardiac fibroblasts, CFs)在心肌间质含量丰富,约占总量90%,在心脏发育和重塑中发挥着重要作用[4]。正常情况下,心肌成纤维细胞少量分泌胶原蛋白,可维持心脏的结构、功能、生化、电传导等。糖尿病心肌病时,心肌成纤维细胞的过度增殖和基质胶原蛋白的过多分泌,可促进心脏纤维化,影响心肌的收缩和舒张功能[5]。因此进一步揭示心肌成纤维细胞增殖和胶原蛋白沉积的机制,成为诸多研究者的关注热点。
哺乳动物中普遍存在的多胺(腐胺、亚精胺和精胺),来源于氨基酸的低分子量有机阳离子化合物,参与调控基因表达、翻译、细胞增殖等过程,具有抗炎、抗氧化等作用,还可以调节某些离子通道的活性和细胞凋亡[6, 7]。其中精胺(spermine,Sp)具有四个正电荷,生物学效应最显著。本课题组前期研究证实,糖尿病心肌病大鼠多胺代谢紊乱,内源性精胺减少,进一步触发钙稳态失衡、内质网应激和氧化应激,引起心肌损伤;给予外源性精胺有明显心肌保护作用[8, 9]。但是,多胺(精胺)在糖尿病心肌纤维化中的作用尚未完全阐明。本文在前期实验基础上,探讨外源性精胺能否通过调节细胞周期对糖尿病心肌纤维化发挥保护作用。
1 材料与方法
1.1 实验动物及分组处理
选取 24 只体重220~250 g 雄性Wistar大鼠(哈尔滨医科大学实验动物中心),随机分成 3 组(n=8):正常对照组(Control)、糖尿病模型组(T1D)和精胺组(T1D+Sp)。适应性喂养 1 周后,禁食12 h,采用 STZ(60 mg/kg,溶于0.1 mol/L柠檬酸-柠檬酸钠缓冲液)一次性腹腔注射,制备 T1D 大鼠模型;Control 组注射相同体积的柠檬酸-柠檬酸钠缓冲液;T1D+Sp 组 STZ 注射前连续两周每天腹腔注射精胺(5 mg/(kg·d)),随后隔天注射精胺至 12 周。注射 STZ 3 d 后,大鼠尾静脉采血测空腹血糖(fasting blood glucose concentration,FBG),以 FBG ≥ 16.7 mmol/L认为是大鼠糖尿病模型复制成功[10]。其间,每周测量大鼠血糖与体重的变化。12周后,禁食12 h,处死各组大鼠,取血液样本及心脏组织。
1.2 超声检测大鼠心脏功能
注射 STZ 前和注射 12 周后分别进行超声心动图检查。各组大鼠麻醉后将胸毛剪掉,应用 GE-VIVID7-10S 探头,在 10 Hz 频率下分别检测大鼠的射血分数(ejection fraction,EF)和缩短分数(fractional shortening,FS)。
1.3 心脏组织 Masson 染色和 Sirius red 染色
将心脏组织以 10% 甲醛在 4℃ 下固定 12 h,制备成 5 μm 厚度的石蜡切片,逐级二甲苯脱蜡,梯度乙醇脱水。Masson 染色:用 Weigert 苏木精染核 5~10 min,充分水洗,Masson 丽春红酸性复红染 5~10 min,用 2% 冰醋酸浸洗片刻,1% 磷钼酸分化 3~5 min,不经水洗,直接用苯胺蓝染 5 min,用 0.2% 冰醋酸浸洗片刻,梯度乙醇脱水,二甲苯透明,中性树脂胶封片。用光学显微镜观察心肌组织中蓝色区域为胶原蛋白。Sirius red 染色:滴加 Sirius red 染液染色 1 h,用清水冲去切片表面的染色液体,保持干燥。用苏木精染色细胞核 10 min,梯度乙醇脱水,二甲苯透明,中性树脂胶封片。在光学显微镜下观察红色区域为胶原蛋白。
1.4 原代心肌成纤维细胞培养及分组
取出生 1~3 d 的Wistar 大鼠心脏,将其剪碎,用胰蛋白酶消化 8 min,然后加入 DMEM 培养基以终止消化。在相同操作 8 次后,4℃ 下 800 r/min 离心 10 min 收集细胞。孵育 2 h 后,丢弃上层未附着的细胞;将附着的细胞(CFs)接种在培养皿中,使用含有 10% 胎牛血清(FBS)和 1% 青霉素或链霉素的 DMEM 在孵箱中培养。为了确保 CFs 的纯度,将细胞传至第三代后使用。将细胞按5×105cells/well接种于 10 cm 培养皿中,并随机分成:正常对照组(Control):用 DMEM(含5.5 mmol/L葡萄糖)培养;高糖组(HG):用含有高葡萄糖(40 mmol/L)的 DMEM 培养;精胺组(HG + Sp):在 HG 前 30 min 在培养基中加入 5 μmol/L Sp 预处理。
1.5 CCK8检测心肌成纤维细胞活力
按照实验分组,将心肌成纤维细胞接种于 96 孔板中,细胞密度为 5×103cells/well。设立空白对照组,加药处理后在孵箱中培养 48 h,取出孔板用预冷 PBS 洗涤 3 次,把液体甩干后向每孔加入 10 μl CCK-8 溶液,避光在 37℃ 孵箱中孵育1 h,随后取出孔板在 450 nm 波长范围,使用酶标仪检测每个孔的 OD值。
1.6 ELISA检测细胞培养基中 Collagen-I/-III 含量
各组分别培养 48 h 后,收集各组培养皿中的培养基,4℃ 下 800 r/min 离心取上清液,分别加入 96 孔板中,设置 TMB 空白对照孔,并设置等比浓度的标准品孔和零孔,对应加入标准品液 100 μl。每个待测孔内分别加入样品稀释液 100 μl,用封板膜密封各孔,在 37℃ 温箱中孵育 90 min 后取出孔板,洗板,甩干至干燥。每孔均加入 Collagen-I/-III 抗体工作液 100 μl 并用封板膜密封。37℃ 温箱中孵育 90 min,洗板 3 次,甩干至干燥,每孔均加入 ABC 工作液 100 μl并用封板膜密封各孔。37℃ 孵育 30 min 后,洗板 5 次,甩干至干燥,加入 TMB 显色液 90 μl,37℃ 避光孵育 20 min。每孔加入 TMB 终止液 100 μl,孔内会呈现蓝色或黄色,使用酶标仪检测 450 nm 波长范围每孔的OD值,测得 Collagen-I/-III 在 CFs 培养基上清液中的含量。
1.7 Western blot蛋白检测
将各组加药处理的细胞培养皿用 2 ml 预冷 PBS 冲洗 3 次,在每个培养皿内加入含有 1% PMSF 蛋白酶抑制剂和 RIPA 蛋白强效裂解液的混合液 2 ml,用刮刀收集到 EP 管中,4℃ 下细胞裂解 30 min 后,高速离心机 4℃ 下 13 500 r/min 速离心 25~30 min,取上清液,BCA 法测定蛋白含量。SDS-PAGE 电泳分离蛋白,上样,电泳,溴酚兰抵达凝胶底部时停止电泳。用湿转法将蛋白转移至 PVDF 膜上,5% 脱脂牛奶封闭 1 h 后,裁剪目的蛋白条带。将目的条带加入相应的一抗(PCNA、CyclinD1、P27按 1∶ 1 000 配制),4℃ 过夜。TBST 洗膜后,加入二抗(1∶10 000 配制),室温孵育 1 h。TBST 洗膜,ECL 法显色。测量条带灰度值,分析计算各组目的蛋白的相对表达量。
1.8 统计学处理
2 结果
2.1 大鼠血糖、胰岛素和心脏功能相关指标改变
与 Control 组相比,T1D 组大鼠血糖升高,胰岛素水平、射血分数(EF)和缩短分数(FS)明显降低。与 T1D 组相比,精胺对血糖和胰岛素水平影响不明显,但是明显改善 EF 和 FS(P<0.05,表1)。
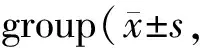
Tab. 1 Changes of blood glucose,insulin and heart function related indicators in each n=8)
2.2 大鼠心脏胶原含量变化
Masson染色显示:与 Control 组相比,T1D 组大鼠胶原表达量从(3.25±0.44)%增加为(15.15± 1.40)%;与 T1D 组相比,T1D+Sp 组胶原表达量下降到(7.06±0.88)%。Sirius red 染色显示:Control 组、T1D 组和 T1D+Sp 组大鼠心肌组织的胶原表达量分别为(2.68±0.70)%、(14.52±1.68)%和 (6.05±1.13)%(P<0.05,图1)。
Fig. 1 Masson and Sirius red staining of myocardial tissue in each group were observed by ordinary optical microscope(×40 QUOTE ×400)
2.3 心肌成纤维细胞的活力变化
与 Control 组相比,HG 组 CFs 活力显著升高;与 HG 组相比,HG+Sp组细胞活力明显下降(P< 0.05,表2)。
2.4 心肌成纤维细胞胶原分泌变化
与 Control 组相比,HG 组 CFs 培养基中 Collagen-I/-III 的含量明显增加;与 HG 组相比,HG+Sp 组培养基中 Collagen-I/-III 的含量明显下降(P< 0.05,表2)。
Tab. 2 Cell viability of CFs detected by CCK-8 and changes of Collagen-I/-III content in culture medium analyzed by n=6)
2.5 心肌成纤维细胞的细胞周期蛋白变化
分别以 PCNA、CyclinD1 和 P27 与 Actin 的比值作为观察参数。与 Control 组相比,HG 组 PCNA 和 CyclinD1 表达增加,而 P27 的表达降低;与 HG 组相比,HG+Sp 组 PCNA 和 CyclinD1 表达下调,P27 显著上调(P<0.05,图2,表3)
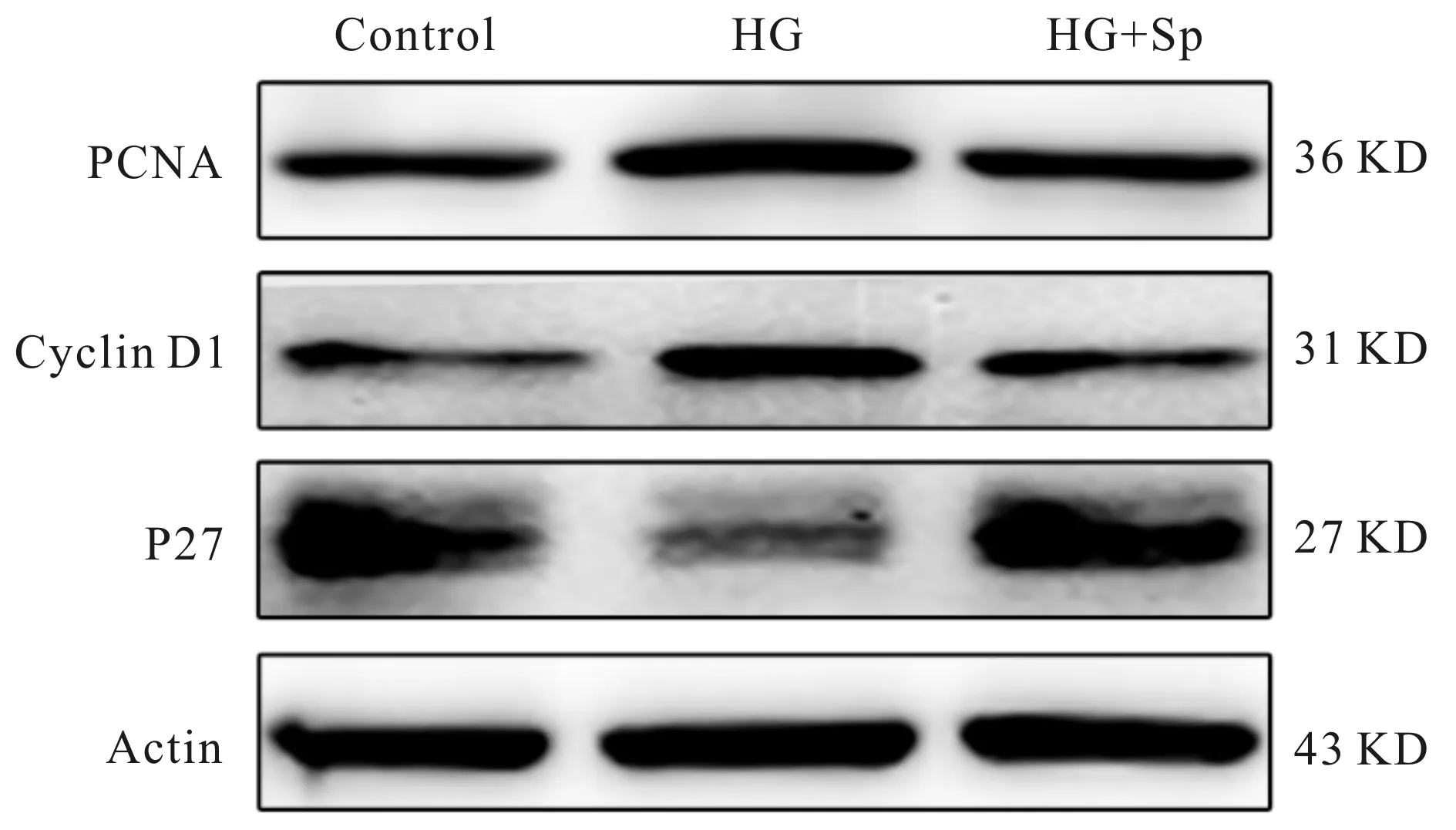
Fig. 2 Comparison of cell cycle related protein in CFs
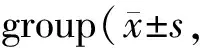
Tab. 3 Comparison of cell cycle related protein expressions in each n=6)
3 讨论
血糖升高是糖尿病的主要临床表现,长期高血糖可引发糖尿病心肌病(diabetic cardiomyopathy, DCM)的发生。作为 DCM 主要特征之一的心肌纤维化可通过心肌间质胶原过度沉积,导致心肌舒张和收缩功能障碍,最终发生心力衰竭[11]。本课题组前期研究证实,外源性精胺对高血糖性心肌损伤、心肌缺血/再灌注损伤、心肌肥大等心血管性疾病具有保护作用[6-10]。但是,精胺对糖尿病心肌纤维化的作用和相关机制尚未阐明。
本研究采用一次性腹腔注射 STZ 建立 T1D 大鼠模型,模型组大鼠血糖明显升高,胰岛素水平下降,说明模型复制成功;大鼠心脏射血分数(EF)和缩短分数(FS)明显降低,而心肌胶原纤维沉积增加,提示大鼠发生了 DCM。给予精胺预处理可以减轻大鼠心功能障碍和胶原沉积,说明精胺改善 DCM 大鼠的心功能障碍与减轻胶原纤维沉积引起的心肌纤维化有关。
DCM的心肌纤维化以 CFs 增殖并大量分泌胶原蛋白为显著特征,抑制 CFs 增殖成为减轻心肌纤维化的关键。本研究用 HG 处理 CFs 模拟体外模型,通过 CCK-8 检测 CFs 的活力,并用 ELISA 检测细胞培养基中胶原的含量。结果显示,与 Control 组相比,HG 组 CFs 的活力和培养基中胶原含量显著增加;精胺预处理可以减轻上述变化。可见,CFs 的实验结果和上述的大鼠实验结果相一致。
细胞周期在细胞增殖中起重要作用。增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)是细胞核中的 DNA 聚合酶辅助蛋白,在 DNA 合成期(特别是 G1 期到 S 期)中作用至关重要[12]。PCNA 也是细胞增殖的主要标志物, 参与调控细胞周期和 DNA 复制过程[13]。CyclinD1 是控制静止细胞从G0期再进入 G1 期的关键因子,被认为是一种原癌基因,其主要作用为促进细胞增殖[14]。P27 是细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)的负调节因子,可阻断细胞周期的 G1-S 转变[15]。CyclinD1 和 P27 相互作用,可以调控细胞的增殖和凋亡[16]。本实验检测了各组 PCNA、CyclinD1 和 P27 的蛋白表达情况。与 Control 组相比,HG 组 PCNA 和 CyclinD1 表达显著上调,P27 的表达下调;给予精胺预处理减轻上述的蛋白表达变化。这也提示,精胺可以通过调节细胞周期,抑制 CFs 的过度增殖,进而减轻糖尿病心肌纤维化。
综上所述,DCM 中 CFs 的异常增殖和胶原蛋白过度沉积是导致心肌纤维化的重要机制。给予精胺预处理,通过调控细胞周期相关蛋白的表达,抑制糖尿病大鼠 CFs 的增殖能力和胶原沉积,改善心脏功能。精胺具有减轻糖尿病心肌病心肌纤维化的心脏保护作用,其机制与调节细胞周期有关。该发现为临床防治 DCM 提供新靶点和新方法。
