AKT/FOXO1信号通路在限热卡高脂饮食改善肥胖小鼠肝脏胰岛素抵抗中的作用
2020-09-25王鑫蕾倪晓晴苏建友袁瑾赵小芹周冉冉崔世维蒋燕秋顾云娟
王鑫蕾 倪晓晴 苏建友 袁瑾 赵小芹 周冉冉 崔世维 蒋燕秋 顾云娟
南通大学附属医院1内分泌科,2老年医学科,3检验科(南通226001)
肝脏是维持机体糖脂代谢平衡的重要器官,肝脏胰岛素抵抗在2型糖尿病发生发展过程中起到关键作用[1-2]。当肝脏发生胰岛素抵抗时,肝细胞胰岛素受体及其底物的酪氨酸磷酸化程度下降,从而导致肝脏糖原异生及肝糖输出增加[3]。脂肪肝与肝脏胰岛素抵抗关系密切,而高脂饮食是脂肪肝的重要病因之一[4]。研究表明,限热卡高脂饮食能有效的改善机体糖脂代谢[5],减少肝脏脂肪含量,降低肝脏糖异生基因PEPCK及G6Pase的表达而增强胰岛素信号传导,减少肝糖异生[6]。然而限热卡高脂饮食对机体肝糖异生及肝脏胰岛素抵抗影响的作用机制尚未明确。
AKT/FOXO1是胰岛素调节肝脏糖原异生及肝糖输出的信号通路之一[7],当胰岛素与肝细胞表面的胰岛素受体特异性结合,激活胰岛素受体底物(IRS),使下游PI3K/AKT信号通路活化,下游转录因子FOXO1 磷酸化而致其由细胞核排斥至细胞质[8],从而阻断下游糖异生基因(PEPCK和G6Pase)的转录调控,致肝脏糖原异生及肝糖输出减少[9],而限热卡高脂饮食是否通过信号通路AKT/FOXO1对肝糖异生及相关下游基因起作用尚未明确。本研究将对高脂饮食喂养诱导的肥胖小鼠进行不同程度的限热卡高脂饮食干预,探讨信号通路AKT/FOXO1 在限热卡高脂饮食改善小鼠肝糖异生及肝脏胰岛素抵抗中所起的作用,为临床使用限热卡高脂饮食方案治疗脂肪肝患者提供理论依据。
1 材料与方法
1.1 动物及饲料4周龄雄性C57BL/6J小鼠35只体质量(20.3±1.8)g 购自南京市江宁区青山动物繁殖场。饲料购自北京科奥生物科技有限公司,高脂饲料:基础料73.8%,其中玉米等能量饲料占20%,猪油15%,蛋黄10%,胆固醇1%,胆盐0.2%;高脂低热量饲料:基础料73.8%,其中玉米等能量饲料占10%,粗纤维占10%,猪油15%,蛋黄10%,胆固醇1%,胆盐0.2%;高脂极低热量饲料:基础料73.8%,其中玉米等能量饲料占0%,粗纤维占20%,猪油15%,蛋黄10%,胆固醇1%,胆盐0.2%。
1.2 动物饲养及分组35只小鼠适应性饲养1周后,随机处死5只小鼠作为基线对照。对照组(n=10)以标准饲料喂养,高脂组(n=20)以高脂饲料喂养,12周后,两组随机处死小鼠各5只。对照组继续以标准饲料喂养,实验组则随机分为继续高脂组(Continue high fat diet,CHFD组,n=5)、低热卡高脂组(low calorie high fat diet,LCHFD组,n=5)、极低热卡高脂组(very low calorie high fat diet,VLCHFD组,n=5),12周后处死。小鼠均自由进水,每周称重一次,饲养室内温度为(25±1)℃,相对湿度30%~40%,12 h 交替照明。
1.3 标本收集与处理于饲养0、12、24 周对空腹12 h的小鼠进行采血或处死。小鼠采血时采用套管针自腹主动脉采血,缓慢抽血至5~7 mL 以上,3 000 r/min 离心15 min,取上清,-80℃冰箱保存。小鼠处死后取肝脏,称重。部分肝脏用等渗盐水清洗后置于-80℃冰箱冻存,部分肝脏用4%甲醛固定,石蜡包埋,常规切片。
1.4 生化指标测定使用日立7170 全自动生化分析仪以酶法测定谷丙转氨酶(ALT)、空腹血糖(FPG)、总胆固醇(TC)、甘油三酯(TG)。空腹胰岛素(FINS)以放射免疫法检测,试剂盒购自罗氏诊断产品(上海)有限公司。
1.5 胰岛素抵抗评估HOMO-IR= FPG(mmol/L)×FINS(mIU/L)/22.5[10]。
1.6 肝脏组织病理肝脏组织切片HE染色及油红染色,观察肝细胞脂肪浸润情况。
1.7 Real-time PCR检测mRNA表达量Trizol 提取总RNA,各取5 μL RNA 进行逆转录,再分别取5 μL cDNA 进行实时聚合酶链式反应(Real-time PCR)。根据GenBank 设计引物,FOXOl 上、下游引物序列分别为:5′-GCATCCATGGACAACAACAG-3′和3′-TGATGGTGCTAGCGTTTGAG-5′;PEPCK 上下游引物分别为5′-GTTCAATGCCAGGTTCCCAG-3′和3′-TTGCAGGGCCAGTTGTTGAC-5′;G6Pase 上、下游引物序列分别为:5′-TGGTTGGGATTCTGGGCTGT-3′和3′-TCTACACCCAGTCCCTTGAG-5′;以β-actin为内参,上、下游引物序列分别为:5′-TGTGATGGTGG-GAATGGGTCAG-3′和3′-TTTGATGTCACGCACGA-TTTCC-5′,基因表达水平以2-ΔΔCt法进行计算。
1.8 Western blot测蛋白表达量检使用Western blot小鼠肝脏组织中FOXO1、p-FOXO1、AKT及p-AKT的表达水平。小鼠处死后分离部分肝组织,匀浆离心后取上清,考马斯亮蓝测定蛋白浓度。灌胶,电泳,转膜,加一抗及二抗后显影,采用凝胶图像成像分析仪灰度扫描定量分析,以β-actin为内参。抗体购自Santa Cruz 生物有限公司。
1.9 统计学方法应用SPSS 16.0 软件进行数据处理与统计分析,计量数据采用均数±标准差表示。组内比较采用单因素方差分析,两组比较使用q检验,P<0.05 差异有统计学意义。
2 结果
2.1 限热卡高脂饮食对小鼠体质量的影响CON组与HFD组小鼠从喂养开始,体质量均逐渐增加,至喂养第4 周HFD组小鼠与CON组小鼠体质量相比差异无统计学意义,至喂养第8周及第12周,HFD组小鼠体质量显著高于对照组(均P<0.001)(图1A)。
喂养第12周后,CON组继续以标准饲料喂养,实验组则随机分为CHFD组、LCHFD组及VLCHFD组继续喂养12周,至喂养第24周,CHFD组小鼠体质量显著高于CON组(P<0.001),尽管CHFD组、LCHFD组、VLCHFD组三组小鼠体质量逐渐下降,但LCHFD组体质量显著高于CON组(P<0.001),而VLCHFD组小鼠体质量与CON组小鼠体质量相比则差异无统计学意义(P>0.05)(图1B)。
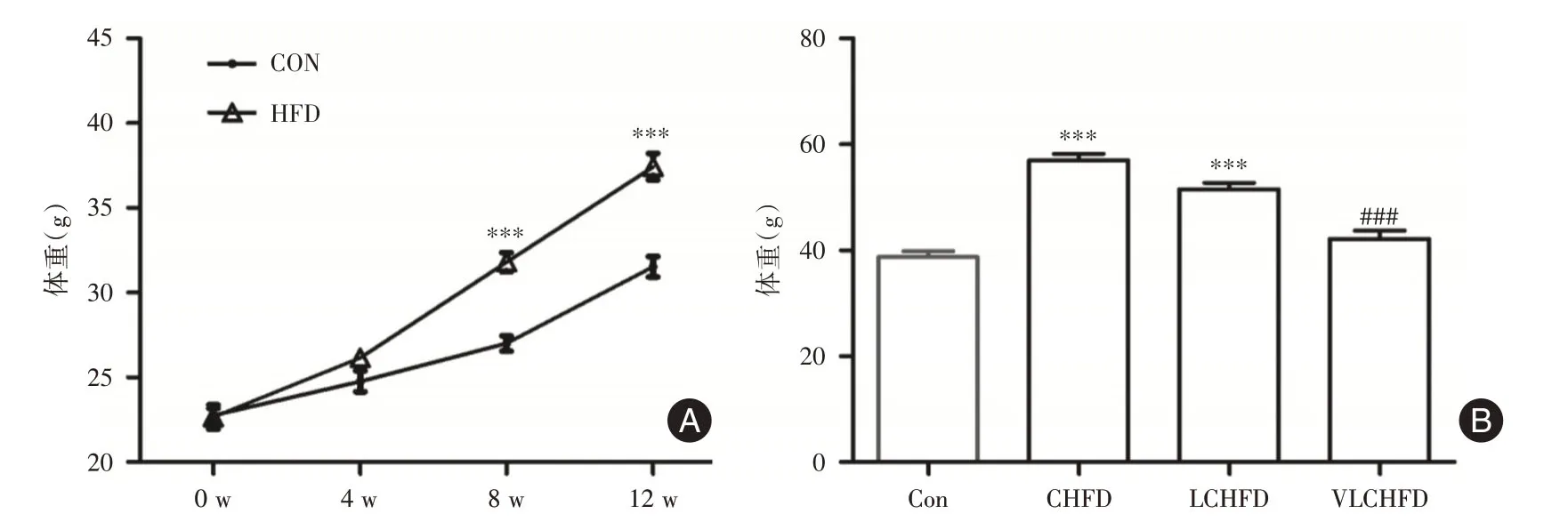
图1 各组小鼠喂养过程中的体质量变化及比较Fig.1 Weightchangesand comparisons offourgroups during the feeding process
2.2 限热卡高脂饮食对小鼠生化指标的影响喂养24周后,CHFD组小鼠FPG、ALT、TC及TG显著高于CON组(均P<0.05),仅VLCHFD组FPG 与CON组相比差异无统计学意义(P>0.05)。而FPG、ALT、TC及TG 在CHFD组、LCHFD组及VLCHFD组均逐渐下降,且LCHFD组及VLCHFD组分别与CHFD组相比差异均具有统计学意义(均P<0.05,表1)。
表1 喂养24周后四组小鼠生化指标及胰岛素抵抗程度的比较Tab.1 The comparisons of biochemical indices and insulin resistance of four groupsat 24-week ±s

表1 喂养24周后四组小鼠生化指标及胰岛素抵抗程度的比较Tab.1 The comparisons of biochemical indices and insulin resistance of four groupsat 24-week ±s
注:与CON组比,*P<0.05,**P<0.01,***P<0.001;与CHFD组比,#P<0.05,##P<0.01,###P<0.001
ALT(U/L)TC(mmol/L)TG(mmol/L)FPG(mmol/L)FINS(mIU/L)HOMA-IR(mIU·mmol/L2)CON 21.35±3.01 1.71±0.14 0.72±0.07 4.83±0.28 2.73±0.11 0.64±0.03 CHFD 47.04±5.23***3.43±0.65**1.84±0.11**11.98±0.34***5.82±0.16**3.10±0.08**LCHFD 37.90±4.45**##3.13±0.27**#1.35±0.06**#8.25±0.47**#4.07±0.13**#2.67±0.10**VLCHFD 33.21±4.11***#2.81±0.35**##1.23±0.46**#4.56±0.15###3.07±0.06*##1.49±0.07*#
2.3 限热卡高脂饮食对小鼠胰岛素抵抗程度的影响喂养24周后,CHFD组小鼠FINS、HOMA-IR 显著高于CON组(均P<0.01),而FINS、HOMA-IR 在CHFD组、LCHFD组及VLCHFD组 均 逐 渐 下 降。LCHFD组及VLCHFD组的FINS分 别与CHFD组相比差异均具有统计学意义(均P<0.05),而HOMAIR 仅VLCHFD组与CHFD组相比差异有统计学意义(P<0.05,表1)。
2.4 限热卡高脂饮食对小鼠肝细胞脂肪浸润的影响喂养24周后,四组小鼠肝脏组织HE染色(图2)及油红染色(图3)均结果表明,CHFD组小鼠肝细胞脂肪空泡变性程度显著,LCHFD组及VLCHFD组小鼠肝细胞脂肪空泡变性程度逐渐下降且改善明显。
2.5 限热卡高脂饮食对小鼠肝脏糖异生基因表达的影响喂养24周后,CHFD组小鼠Foxo1、Pepck及G6p-ase的基因表达显著高于CON组(均P<0.001),而VLCHFD组Foxo1及G6p-ase的基因表达与CON组相比差异无统计学意义(P>0.05)。Foxo1、Pepck及G6p-ase的基因表达在CHFD组、LCHFD组及VLCHFD组均逐渐下降,且LCHFD组及VLCHFD组的上述基因表达均显著低于CHFD组(均P<0.001,图4)。
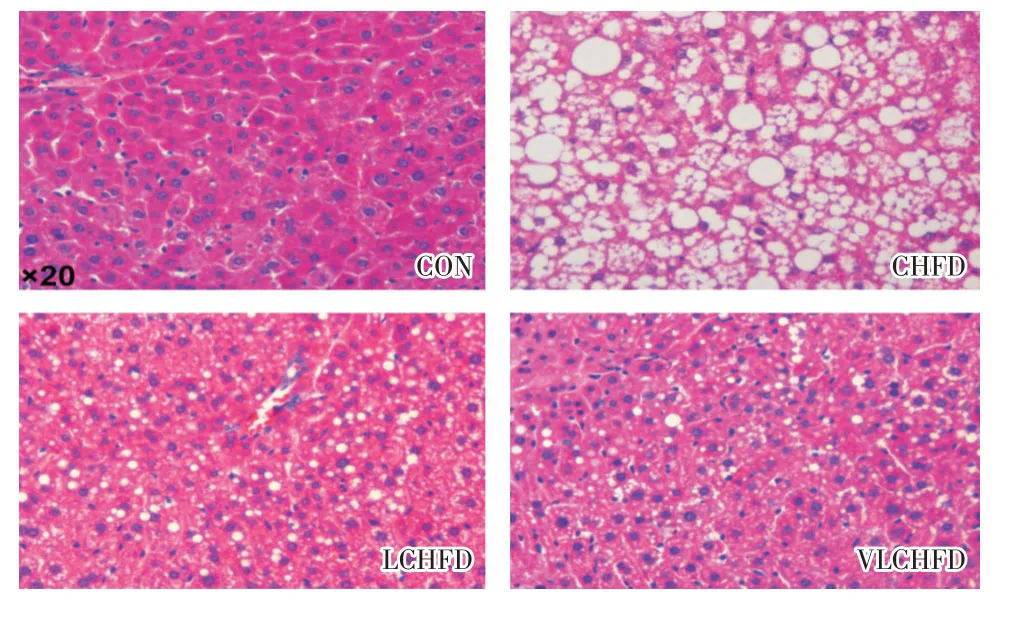
图2 喂养24周后四组小鼠肝脏组织HE染色Fig.2 Hematoxylin-eosin staining of mice liver tissues at 24-week

图3 喂养24周后四组小鼠肝脏组织油红染色Fig.3 Oil red staining of mice liver tissues at 24-week
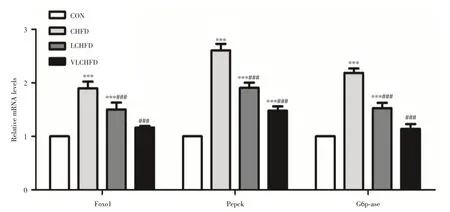
图4 喂养24周后四组小鼠肝脏糖异生基因表达的比较Fig.4 The comparisons of expressionsof genes about hepatic gluconeogenesis in four goups miceat 24-week
2.6 限热卡高脂饮食对小鼠信号通路AKT/FOXO1磷酸化的影响喂养24周后,CHFD组小鼠p-FOXO1表达水平下降,p-FOXO1/FOXO1 降低,与CON组比较差异有统计学意义(P<0.001),随着热卡限制的增加,CHFD组、LCHFD组及VLCHFD组p-FOXO1/FOXO1 逐渐增高,VLCHFD组与CON组相比P>0.05,LCHFD组、VLCHFD组与CHFD组相比差异均有统计学意义(均P<0.001)。而p-AKT/AKT的表达水平CHFD组较之CON组显著下降(P<0.05),随着热卡限制的增加,CHFD组、LCHFD组及VLCHFD组逐渐增高,LCHFD组与CON组相比差异无统计学意义,LCHFD组、VLCHFD组与CHFD组相比差异均有统计学意义(均P<0.001,图5)。
3 讨论
脂肪肝与肝脏胰岛素抵抗密切相关,非酒精性脂肪肝是脂肪肝病因分型之一,且是目前最常见的慢性肝脏疾病[11]。当肝脏游离脂肪酸酯化合成甘油三酯超过肝脏甘油三酯分解代谢,形成极低密度脂蛋白时,非酒精性脂肪肝逐渐形成[12]。高脂饮食致肝内甘油二酯增加,甘油二酯作为第二信使激活蛋白激酶Cε,使胰岛素受体激酶减少,从而导致胰岛素激活IRS的酪氨酸磷酸化水平下降,引起肝糖原合成及肝糖输出增加[13]。因而高脂饮食不仅是非酒精性脂肪肝的重要诱因,也是肝脏胰岛素抵抗形成的重要因素[14]。该实验中,通过高脂饮食喂养将非酒精性脂肪肝小鼠造模成功,且脂肪肝小鼠出现了糖脂代谢紊乱、胰岛素抵抗程度升高。肝脏糖原合成、分解及肝糖输出是调节机体空腹血糖水平重要因素之一[15],该实验中随着小鼠饲养热卡逐渐减少,小鼠肝细胞脂肪变性程度逐渐减轻,小鼠空腹血糖、血脂均逐渐降低。HOMA模型利用空腹血糖及胰岛素评估空腹状态胰岛素敏感性及胰岛β细胞功能,而空腹血糖及胰岛素之间的关系主要反映了肝糖输出与胰岛β细胞功能的关系,故而HOMA-IR 能在一定程度反映肝脏胰岛素抵抗[16],该实验中随着小鼠饲料热卡的逐渐减少,HOMA-IR 逐渐下降,提示小鼠肝脏胰岛素抵抗逐渐改善。

图5 喂养24周后四组小鼠肝脏信号通路AKT/FOXO1 蛋白定量的比较Fig.5 The comparisons of protein quantificationsof hepatic AKT/FOXO1signal pathwayin four groups miceat 24-week
调整饮食成分是非酒精性脂肪肝有效且可长期持续的治疗方法[17],限热卡饮食即为有效的饮食干预方法之一,限热卡饮食不仅能控制体质量[18],也能有效逆转非酒精性脂肪肝[19],而热卡限制的低碳水化合物高脂饮食与传统的热卡限制的低脂饮食相比,对肝内脂肪含量下降的作用相似[20],该实验中采用的限热卡高脂饮食不仅使小鼠体质量下降,糖脂代谢紊乱改善,且随着热卡减少,小鼠肝细胞脂肪变性程度逐渐减轻,转氨酶下降,这与以往研究结果是相符的[20]。
本研究通过对高脂饮食喂养成功的非酒精性脂肪肝小鼠进行限热卡高脂饮食干预后,发现随着摄入热卡不同程度的减少,小鼠体质量、血糖、血脂、脂肪肝空泡变性的程度及胰岛素抵抗程度逐渐改善,与此同时,LCHFD组及VLCHFD组小鼠FOXO1、PEPCK及G6Pase 基因表达水平亦逐渐下降,而AKT及FOXO1 蛋白磷酸化则水平逐渐升高,上述结果表明AKT/FOXO1信号通路在肥胖小鼠限热卡高脂饮食改善肝脏胰岛素抵抗中的起到一定程度的作用。根据以往研究,限热卡高脂饮食通过AKT/FOXO1信号通路改善肝脏胰岛素抵抗主要机制如下:(1)限热卡饮食促进体内糖脂分解及利用,使PI3K/AKT信号通路活化,从而使转录因子FOXO1 磷酸化阻断下游糖异生基因PEPCK及G6Pase的转录调控,使肝脏糖原异生及肝糖输出减少[9,21],本研究结果与该机制相符。(2)肥胖和糖尿病机体线粒体及内质网功能紊乱,诱发氧化应激产物增加,导致肝脏、骨骼肌及脂肪组织胰岛素抵抗[21-22],促进并发症的发生发展[23],当热量限制后,由肝脏合成依赖于FOXO1的抗氧化蛋白,如SOD表达增加[24],改善肝脏胰岛素抵抗[25]。故而,本实验中限热卡高脂饮食也可能通过激活AKT/FOXO1信号通路改善肥胖小鼠氧化应激状态而增加肝脏胰岛素敏感性。
本研究初步明确了信号通路AKT/FOXO1 在限热卡高脂饮食改善小鼠肝糖异生及肝脏胰岛素抵抗中具有重要作用,但抑制信号通路AKT/FOXO1后,限热卡高脂饮食肥胖小鼠肝糖异生及肝脏胰岛素抵抗的变化尚未明确,也是本实验的局限之处。在后续研究中,课题组将通过PI3K/AKT/FOXO1信号通路抑制剂及肝脏特异性敲除FOXO1 基因小鼠,进一步阐明AKT/FOXO1信号通路在限热卡高脂饮食对小鼠肝脏胰岛素抵抗所起的作用。
综上所述,限热卡高脂饮食不仅能有效的控制肥胖小鼠的体质量、血糖及血脂,也能有效地逆转肥胖小鼠的非酒精性脂肪肝,减少肝糖异生,改善肝脏胰岛素抵抗,而AKT/FOXO1信号通路在这一过程中起到了重要作用。
