线粒体脑肌病伴高乳酸血症和卒中样发作综合征的肌肉病理和电镜特征
2020-09-24吴世陶石伟伟郭亚培刘恒方
吴世陶,刘 方,石伟伟,张 敏,郭亚培,刘恒方
线粒体脑肌病伴高乳酸血症和卒中样发作(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes,MELAS)是由于线粒体DNA(mtDNA)或核DNA(nDNA)突变而导致线粒体结构和功能异常的一组综合征。MELAS综合征临床表现复杂,容易漏诊和误诊,肌肉活检病理具有十分重要的诊断价值。电镜能够观察肌肉细胞的微观结构,为诊断MELAS综合征提供形态学依据。我们总结33例MELAS综合征患者肌肉病理及电镜的特征,以提高对它们的认识。
1 资料与方法
1.1 一般资料 收集2013年1月-2019年1月郑州大学第五附属医院和郑州大学第一附属医院经肌肉病理和基因测序同时确诊的33例MELAS综合征的资料,其中男20例,女13例,年龄4.2~39岁,病程2 m~10 y,多为青少年起病,主要临床表现为癫痫、卒中样发作、头痛、身材矮小、不耐受疲劳、视力下降、听力下降和多毛等。33例患者均发现基因突变位点。研究获得郑州大学第五附属医院伦理委员会的批准,且患者或家属签署知情同意书。
1.2 肌肉病理 患者或者监护人签署知情同意书,局麻下获得骨骼肌标本,根据病情取材部位为肱二头肌或者腓肠肌。新鲜标本分两部分,一部分行肌肉组织病理染色;另一部分行电镜检查。新鲜肌肉标本经液氮冷却的异戊烷迅速冷冻,-80 ℃保存,染色时制成8 μm冷冻切片,进行苏木精-伊红(HE)、改良Gomori (MGT)、还原型辅酶Ⅰ四氮唑还原酶(NADH)、琥珀酸脱氢酶(SDH )、细胞色素C氧化酶(COX)、过碘酸雪夫氏(PAS)和油红O(ORO)染色,显微镜200倍下进行病理分析,发现破碎红纤维(RRF)后随机选取10个视野计算RRF出现率,RRF出现率=(RRF个数/肌纤维总数)×100%。15例新鲜标本经2.5%戊二醛固定,行透射电子显微镜检查。
2 结 果
2.1 肌肉病理 光镜下HE染色可见部分肌纤维变性、坏死、萎缩,18例可见破碎红纤维,其胞浆出现嗜碱性颗粒沉积。25例改良Gomori染色可见破碎红纤维;26例NADH染色可见破碎红纤维,氧化酶活性增高;28例SDH染色可见破碎蓝纤维,氧化酶活性明显增高;26例可见SSV现象,其中2例未见到破碎蓝纤维和破碎红纤维;22例COX染色光镜下见到氧化酶活性消失或减低,即COX阴性肌纤维;15例PAS显示糖原成分轻度增高;24例ORO染色可见脂肪成分增多(见图1)。
2.2 电镜 15例MELAS综合征患者电镜下均可见到肌原纤维排列紊乱、间质水肿,线粒体数量明显增多,大部分聚集在肌膜下或者肌原纤维间,线
粒体嵴紊乱、体积增大,部分患者可见巨大线粒体,均可见到线粒体内结晶样包涵体呈“停车场”样排列(见图2)。其中13例出现大量脂滴,9例糖原颗粒增多。此外,8例出现线粒体空泡化,5例溶酶体异常、脂褐素沉积,3例线粒体嵴呈同心圆排列,2例肌浆网扩张。

注:患者16,女,30岁,A:改良Gomori染色可见较多破碎红纤维;B:COX染色可见破碎红纤维氧化酶活性消失;C:患者29,男,7岁,SDH染色可见大量破碎蓝纤维(黄箭头)和SSV现象(红箭头)(×200)
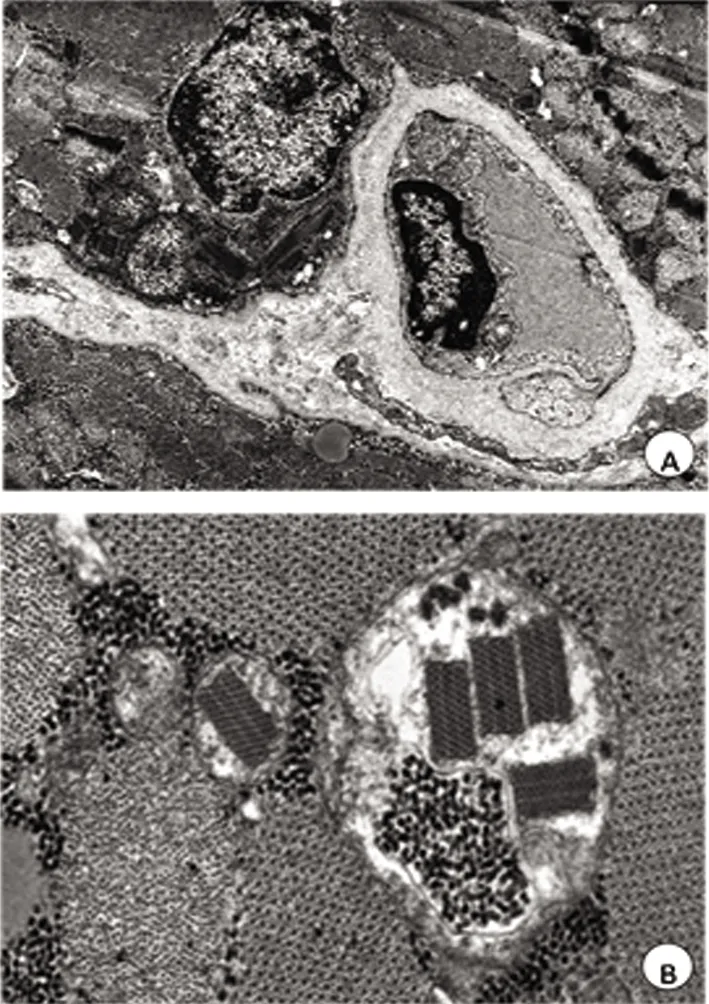
注: A:线粒体数量增多、体积变大、肿胀、线粒体嵴紊乱;B:线粒体内大量结晶样包涵体呈“停车场”样排列(×10000)
3 讨 论
肌肉病理对MELAS综合征具有十分重要的诊断价值。本研究采用多种染色方法来观察MELAS综合征的病理改变,每种染色方法都有自己的特征。光镜下HE染色可见肌纤维大小不一,部分肌纤维变性、坏死、萎缩,与部分患者的肌酸激酶和乳酸脱氢酶升高相关。破碎红纤维(RRF)是指肌纤维内尤其是肌纤维膜下异常聚集的线粒体在改良Gomori染色上呈红色且有破碎感,它的发生是由于线粒体功能障碍导致细胞能量供应不足、线粒体代偿性增生以及大量聚集。研究报道80%~100%的MELAS综合征患者肌肉活检病理可以看到RRF[1]。本研究中75.8%(25/33)患者改良Gomori染色可见到大量典型的RRF,与既往研究基本一致[2]。但是,RRF并非线粒体病的特征性改变,RRF还可见于肌营养不良症、多发性肌炎、包涵体肌炎、肌原纤维病、脂质沉积性肌病、中央轴空病和50以上的健康人等[3~5]。有学者认为RRF出现率大于4%才能诊断为线粒体病[6],本研究也以RRF出现率大于4%为诊断标准。但是,肌肉活检病理未发现RRF并不能排除MELAS,因为肌肉活检取材具有局限性,RRF的分布具有随机性。
酶学染色发现RRF的敏感性更高,本组研究酶学染色方法主要为NADH、SDH和COX染色。本组病例中78.9%(26/33)患者NADH染色可见破碎红纤维,氧化酶活性增高,NADH是线粒体代谢过程中重要的酶,所以在异常线粒体聚集的肌纤维中表现明显。肌纤维内或者肌纤维膜下异常聚集的线粒体在SDH染色上呈蓝色,故称为破碎蓝纤维(ragged-blue fibers,RBF)。本组研究中84.8%(28/33)患者SDH染色可见到大量典型的RBF,氧化酶活性明显增高,且RBF出现率较高,大约为10%,部分患者RBF的出现率高达30%,可见SDH染色发现异常线粒体的敏感性更高。此外,78.9%(26/33)患者见到肌间小动脉血管壁深染,即SSV现象,其中2例未见RRF和RBF,后经基因检测确诊为MELAS综合征,说明SSV现象是MELAS综合征肌肉病理的一个重要特点,SSV现象与RRF、RBF具有同等的诊断意义。Bennett等[7]报道大约85%的MELAS综合征患者出现SSV现象。SSV现象提示小动脉平滑肌的线粒体异常,有报道认为SSV不仅存在于肌肉小动脉,也存在于脑小动脉血管,可使脑动脉血管壁的通透性增加而导致卒中样发作[8,9]。COX是线粒体代谢过程中必不可少的一种酶,本组研究中66.7%(22/33)患者COX染色可见氧化酶活性消失或减低,即COX阴性肌纤维,这是MELAS综合征肌肉病理的另外一个重要特点。
糖原累积症、脂质沉积性肌病和线粒体病是最常见的代谢性肌病,糖原、脂质和线粒体共同参与细胞能量代谢[10,11]。本组研究中,45.5%(15/33)患者PAS染色显示破碎红纤维深染,提示糖原成分增多,说明线粒体代谢异常时糖原代谢也存在障碍。本组研究发现72.7%(24/33)患者ORO染色发现较多非破碎红纤维的肌纤维内脂肪成分增多,其中破碎红纤维内脂肪成分明显增多,提示MELAS综合征的肌纤维内脂质异常堆积,会影响线粒体内某些酶的功能,也是肌肉不耐受疲劳的一个原因。此外,肌纤维内脂质增加明显者还应注意与脂质沉积性肌病相鉴别。
电镜能够十分清晰地看到肌纤维的微观结构,能够更好地观察线粒体的异常。本组15例MELAS综合征患者电镜下均可见到线粒体内结晶样包涵体呈“停车场”样排列,是MELAS综合征的典型特征。结晶样包涵体的主要成分为线粒体肌酸激酶,其形成主要是因为线粒体ATP产生减少,线粒体肌酸激酶的功能发生代偿而表达过度、酶活性降低而堆积的结果。线粒体肌酸激酶以二聚体及八聚体两种形式存在,在一定条件下两者可以相互转化,pH较低时主要以八聚体的形式存在[12]。MELAS综合征患者线粒体产生ATP不足,无氧酵解增加,产生大量的乳酸和H+,pH值降低,二聚体向八聚体转化增多,促进了结晶样包涵体的形成。此外,结晶样包涵体是线粒体损伤不可逆性的标志[13]。MELAS综合征患者电镜下线粒体数量增多、体积增大、肿胀,线粒体肿胀可能和线粒体膜通透性转换孔(mitochondrial permeablity transition pore,mPTP)有关。线粒体膜通透性转换孔(mPTP)是位于线粒体内膜与外膜之间的一组通道蛋白复合体,pH下降、钙超载和过量的活性氧都可使mPTP过度开放,从而导致线粒体基质的内渗透压增高,引起线粒体肿胀[14]。总之,电镜发现线粒体的异常比肌肉病理更加敏感,但是,由于电镜取材较少,而且再经过超薄切片,电镜正常者并不能排除MELAS综合征。
综上所述,破碎红纤维(RRF)、SSV现象和COX阴性肌纤维是MELAS综合征主要的肌肉病理改变。SDH染色是发现破碎红纤维最敏感的方法,SSV现象可以是MELAS综合征唯一的肌肉病理改变,具有诊断价值。电镜下线粒体数量增多、体积增大、嵴结构紊乱,结晶样包涵体呈“停车场”样排列是MELAS综合征的典型改变。充分认识MELAS综合征的肌肉病理和电镜特征,有利于提高MELAS综合征的诊断,减少漏诊和误诊。
