轻木植物组织培养研究
2020-09-23李翠新孟德中
李翠新,何 德,孟德中
(西南林业大学 生命科学学院,昆明 650224)
轻木(OchromalagopusSwartz)又名百色木,为木棉科常绿乔木,是世界上最速生的树种之一,是世界上最轻的商品木材,原产于南美洲的赤道热带地区,厄瓜多尔轻木的产量占世界首位[1].轻木木材的性质决定了木材的用途,可用于航天、航海等领域,也可在工业及民用领域广泛应用,如模型制造和风力发电机叶片等的用材[2].我国适合轻木生长的环境现仅局限于云南、台湾、海南等少数省份,而由于台风的关系,仅云南西双版纳地区引种栽培较成功[3].我国所需轻木大多来自厄瓜多尔,市场多被美国垄断,因此轻木国产化已迫在眉睫.但轻木的自然繁殖速度慢,种子繁殖率又极低,后代变异较大,导致国内轻木缺口很大.
植物组织培养是20世纪初兴起的一项高新生物技术,是在细胞全能性基础上发展而来,具有在不受其他干扰的情况下研究被培养部分的生长和分化规律的优点,且取材少,短生长周期内通过人为控制培养条件可得到大量繁殖[4-5].相较于草本植物的组织培养[6-7]而言,木本植物的快繁要更困难[8],但也积累了丰富的研究经验.近年来,在许多木本植物上,如刺楸[9]、酸枣[10]、北美海棠[11]、桃树[12]、荔枝[13]等植物的离体再生技术的研究上都取得了重要的研究成果.但轻木的组培快繁研究在国内外还未见报道.获得轻木的植物再生系统将有助于轻木在我国推广种植,对维护种植资源、改善森林生态环境、保障国民经济持续健康发展具有重要意义.
1 材料和方法
1.1 材料
轻木种子购自云南省中国科学院西双版纳植物园.
1.2 方法
1.2.1 种子发芽处理 将轻木种子置于65 ℃热水中处理,直至水温自然降温至25 ℃,继续维持25 ℃浸泡24 h.移入超净工作台用75%的乙醇浸泡1 min,无菌水冲洗2~3次,再用0.1% HgCl2浸泡15 min,消毒完成后再用无菌水冲洗5次,每次不少于3 min,最后将处理后的种子接种到未添加激素的MS空白培养基中,每瓶接1~2颗种子.待种子发芽展开4~5片叶片,以叶片作为外植体进行愈伤组织的诱导.
1.2.2 愈伤组织的诱导 取在无菌条件下种子萌发生长的叶片,在无菌条件下将叶片切成约 0.5 cm2的小块,接种在添加不同质量浓度的6-BA培养基上,进行叶片愈伤组织的诱导.诱导培养基:1号(MS+0.5 mg/L 6-BA),2号(MS+0.3 mg/L 6-BA),3号(MS+0.1 mg/L 6-BA).MS培养基均含蔗糖3%,卡拉胶0.5%,pH均为5.8.每个处理15瓶,每瓶接种叶片3~4片,培养30 d后观察并统计愈伤组织诱导情况.
1.2.3 不定芽诱导及继代增殖 愈伤组织在上述最佳诱导培养基1号上转接2~3次后进行不定芽诱导.以1号培养基为基础,加入不同质量浓度的TDZ和NAA,配制5种增殖培养基:5号(MS+0.5 mg/L 6-BA)即为上述的1号培养基,6号(MS+0.5 mg/L 6-BA+0.01 mg/L NAA),7号(MS+0.5 mg/L 6-BA+0.1 mg/L NAA),8号(MS+0.5 mg/L 6-BA+0.02 mg/L TDZ+0.005 mg/L NAA),9号(MS+0.5 mg/L BA+0.02 mg/L TDZ+0.008 mg/L NAA).每个处理15瓶,每瓶接种愈伤组织3个,45 d后根据诱导的不定芽数计算增殖系数.在筛选出的最佳培养基上再不断进行继代增殖.
1.2.4 壮苗和生根 继代增殖产生的不定芽进行芽丛切割后,用MS空白培养基进行壮苗培养,然后以1/2 MS为生根的基本培养基,调节不同质量浓度的NAA和TDZ,筛选最佳生根培养基.配置生根培养基为:10号(1/2 MS+0.02 mg/L TDZ+0.005 mg/L NAA),11号(1/2 MS+0.01 mg/L TDZ+0.005 mg/L NAA),12号(1/2 MS+0.02 mg/L TDZ+0.008 mg/L NAA),13号(1/2 MS+0.005 mg/L NAA),14号(1/2 MS+0.08 mg/L NAA).每个处理20瓶,每瓶接种1~2个再生苗,30 d后统计生根率及生长情况.
2 结果与分析
2.1 种子发芽率
用于试验的轻木种子共计201粒,在MS空白培养基上能发芽的仅36粒,发芽率为17.9%,轻木种子发芽困难,发芽率比较低,利用种子发芽来获得大量轻木实生苗存在难度.种子发芽情况如图1所示.

图1 轻木种子发芽情况Fig.1 Seed germination of Ochroma lagopus
2.2 叶片愈伤组织的诱导
将轻木种子萌发生长出的叶片切成约0.5 cm2的小块,接种到3种不同的诱导培养基上,培养10 d后,叶片的切口边缘开始向外翘卷,开始出现少量白色愈伤组织,18 d开始大量白色愈伤组织,随着培养时间的延长,愈伤组织逐渐从白色变成绿色,30 d统计愈伤组织诱导情况,3种培养基诱导叶片愈伤组织情况如表1和图2所示.由表1可以看出,添加不同质量浓度6-BA的培养基,其叶片愈伤组织数显著不同,其中愈伤组织诱导率随着6-BA浓度的增加而增大.在1号培养基上愈伤组织诱导率最高,达83.3%,其诱导的愈伤组织表面湿润,质地疏松.而在3号培养基上诱导效果最差,其愈伤组织诱导率仅为31.0%.本试验得出1号培养基MS+0.5 mg/L 6-BA为轻木的最佳愈伤组织诱导培养基.

图2 叶片外植体形成愈伤组织Fig.2 Callus formation from leaf explants
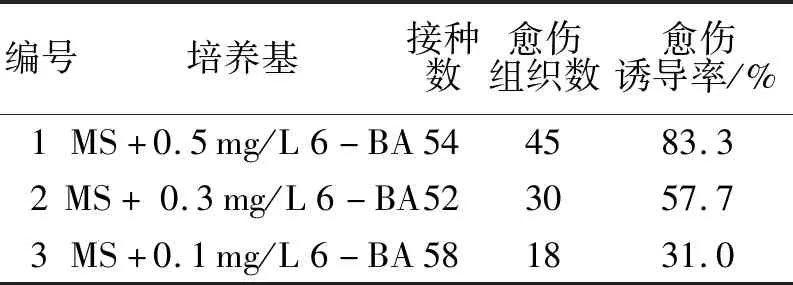
表1 不同培养基对轻木叶片愈伤组织诱导Tab.1 Callus induction from leaves of Ochroma lagopus in different media
2.3 叶片愈伤组织不定芽诱导及继代增殖培养基的筛选
在最佳愈伤组织诱导培养基的基础上,调节NAA和TDZ的质量浓度,进行愈伤组织不定芽的诱导.培养15 d左右,5种培养基上的愈伤组织仍继续增殖,并伴有少量不定芽的产生.经过45 d的培养,通过统计每种培养基上不定芽总数,发现不同培养基诱导不定芽的结果不同,不定芽诱导结果如表2所示.其中5号为基础培养基,6号和7号培养基中只添加有不同质量浓度的NAA.在5、6、7号3种培养基上,每块愈伤组织均能分化出不定芽,但不定芽增殖系数平均值1.1左右,分化能力均较弱.比较6~9号培养基发现,增加NAA质量浓度,不定芽的分化数下降,添加TDZ,有助于不定芽的分化.在8号和9号培养基中调节了NAA和TDZ的质量浓度,在8号培养基中,愈伤组织分化不定芽数增殖系数3.48,不定芽长势好(如图3所示);比较得出8号培养基(MS+0.5 mg/L 6-BA+0.02 mg/L TDZ+0.005 mg/L NAA)为最优愈伤组织不定芽诱导培养基.将带芽愈伤组织块切割成2 cm2左右的小块,接种在筛选出的8号培养基上继续培养45 d,芽丛进一步继代增殖.
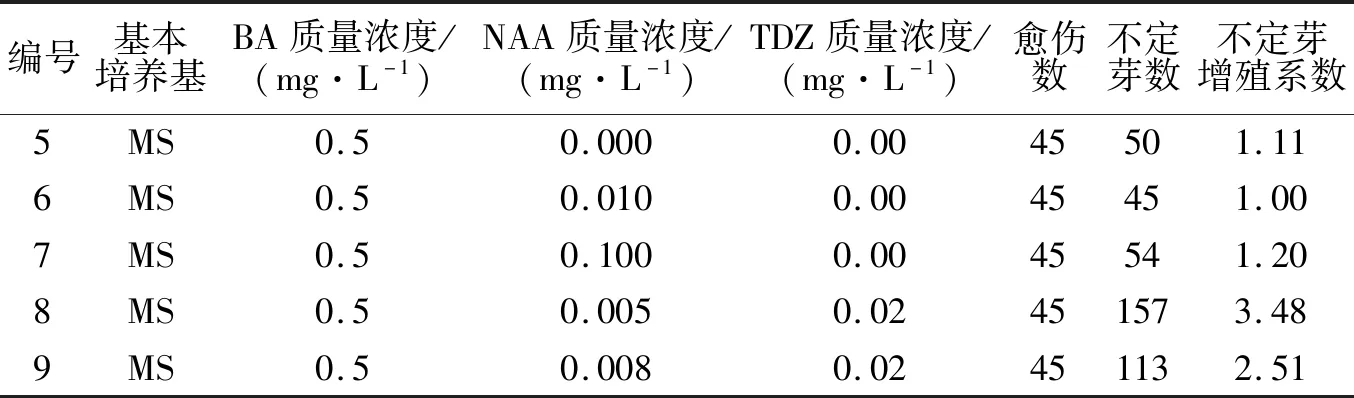
表2 不同培养基对愈伤组织不定芽的诱导Tab.2 Induction of adventitious buds from callus in different media
2.4 生根培养基的筛选
将继代增殖生长的芽丛切割后用MS空白培养基进行壮苗培养,幼苗长势良好,茎秆粗壮且伸长明显,叶片伸展开,颜色绿而且叶片较大.在壮苗培养过程中,幼苗的基部继续长出少量愈伤组织,有可能是因植株中残存激素造成的影响(如图4所示).将壮苗后的不定芽再次从基部切苗后接种到不同的生根培养基10~14号中,培养14 d后开始有根萌出.继续培养16 d后统计生根情况,结果如表3所示,在13号和14号培养基中没有添加TDZ,只添加NAA时,苗木的生根情况好于添加了NAA和TDZ的培养基10~12号,并且随着NAA质量浓度的加大,生根率也有适当提高.14号培养基生根率达82.1%,有多条长的白色主根,须根数量也较多,在苗根部切口仍有少量愈伤组织产生(如图5所示).

图4 不定芽的壮苗培养 图5 14号培养基上的轻木生根苗 Fig.4 Strong seedling culture of adventitious buds Fig.5 Rooting seedling of Ochroma lagopus on No.14 medium
在前期使用MS培养基壮苗时并不能诱导苗根的分化,原因可能是无机盐浓度过高或是盐中毒.当使用1/2 MS培养基作为基本培养基时生根情况明显好转.在本次设计的五种生根培养基中,14号培养基1/2 MS+0.008 mg/L NAA为最适的生根培养基.
表3 生根培养基中生根结果
Tab.3 Rooting results in rooting medium

编号NAA质量浓度/(mg·L-1)TDZ质量浓度/(mg·L-1)接种数生根苗数生根率/%生根状况描述100.0050.0220840.01条短小白色主根,须根少.110.0050.01251144.01条短小白色主根,须根少.120.0080.02261142.3多条短小白色主根,须根少.130.0050.00241666.7多条较长的白色主根,须根数目较多.140.0080.00282382.1多条长的白色主根,须根数目较多.
3 结论与讨论
由于轻木生长的环境现仅局限于云南、台湾、海南等少数省份,直接获取轻木植株的组织进行组培研究比较困难.本研究利用轻木种子发芽长叶后,以叶片作为外植体进行组织培养,解决了轻木取材难的问题.
以MS为基础培养基,主要研究了不同质量浓度的6-BA对诱导愈伤组织的影响.愈伤组织诱导率随着6-BA浓度增加而增大,最佳愈伤组织诱导培养基为MS+0.5 mg/L 6-BA,诱导率最高,达83.3%.诱导培养基中能添加的6-BA最大质量浓度,还需要进一步试验.
以MS为基础培养基,只添加有不同质量浓度的NAA,愈伤组织分化能力均较弱.调节NAA和TDZ的质量浓度诱导愈伤组织不定芽,培养基MS+0.5 mg/L 6-BA+0.02 mg/L TDZ+0.005 mg/L NAA诱导的不定芽数最多,长势好,增殖系数达3.48,添加激素TDZ有利于不定芽的分化.
在生根试验过程中,利用1/2 MS做基础培养基,减少了因无机盐浓度过高引起的盐中毒.在1/2 MS培养基中只添加NAA,有利于生根,且随着NAA质量浓度的加大,生根率也有适当提高,试验设计的培养基1/2 MS+0.008 mg/L NAA生根率最高,达82.1%.继续增加NAA的质量浓度,能否有利于生根率,还需要进一步的试验.
本试验成功获得了轻木的组织培养生根苗,是国内外首次报道有关轻木的组织培养,既满足市场对轻木苗木的需求提供了技术支持,也为今后轻木国产化、产业化以及发展利用提供了一定基础研究.
