滤泡辅助性T细胞在重症肌无力伴胸腺瘤患者胸腺中的表达
2020-09-23宋阳叶晓玲陈佶朱勇俊徐朋亮伍宁陈刚苗锋巫伟伟陈志明
宋阳 叶晓玲 陈佶 朱勇俊 徐朋亮 伍宁 陈刚 苗锋 巫伟伟 陈志明
重症肌无力(myasthenia gravis,MG)是T细胞依赖的、乙酰胆碱受体抗体介导的发生于神经肌肉接头处传递功能障碍的自身免疫病[1]。80%~90%的MG患者的胸腺有病理学异常[2],其中65%~75%有淋巴结增生的胸腺滤泡和生发中心增殖[3],15%~20%的患者伴发胸腺瘤。胸腺是人体重要的免疫器官,在免疫耐受及T细胞成熟等方面发挥重要作用[4-5]。胸腺切除是治疗MG的重要方法,多数患者术后病情明显缓解,其确切机制仍不清楚。
近年研究发现,T淋巴细胞亚群之一的滤泡辅助性T细胞(T follicular helper cells,Tfh)不仅能辅助B淋巴细胞产生抗体,而且是代表淋巴组织中效应T细胞的最大和最重要的亚群[6-7]。Tfh细胞具有特异性表达趋化因子受体5(C-X-C chemokine receptor type 5,CXCR5)和可诱导共刺激分子(inducible co-stimulator,ICOS)、促使滤泡B细胞归巢/迁移和辅助B细胞等显著特点。Tfh细胞产生辅助性细胞因子,如白介素-21(interleukin-21,IL-21),通过与其受体的作用刺激B淋巴细胞分化成为产生特异性抗体的浆细胞。Tfh细胞功能失调可能参与免疫相关疾病的发病机制[8]。在甲状腺炎、系统性红斑狼疮、类风湿性关节炎、系统性干燥综合征和自身免疫性肾病等疾病中,Tfh细胞数目、比例以及相应蛋白的表达量均明显增高[9-12]。
然而,胸腺瘤瘤旁胸腺组织中Tfh细胞在MG伴胸腺瘤的疾病发展过程中的作用及其免疫机制尚不清楚。本研究通过分析MG伴胸腺瘤、无MG胸腺瘤患者瘤旁胸腺组织以及萎缩胸腺组织中Tfh细胞及其蛋白分子CXCR-5、Bcl-6、ICOS、PD-1的表达差异,探讨MG伴胸腺瘤瘤旁胸腺环境中Tfh活性程度及其参与MG伴胸腺瘤发病的免疫机制。
材料与方法
一、病例和分组
选取2013年1月—2015年4月在复旦大学附属华山医院心胸外科诊断为MG伴胸腺瘤、胸腺瘤不伴MG以及接受心脏手术的住院患者。
1. MG伴胸腺瘤(MG组):30例,均必须符合以下标准[13]。入选标准:①符合MG诊断标准,即骨骼肌易疲劳,包括咽喉肌和/或延髓肌;②症状有波动性,伴明显晨轻暮重特点;③重复神经电刺激显示低频(3~5 Hz)刺激时衰减达到或超过10%;④胆碱酯酶抑制剂治疗有效;⑤18岁<年龄<65岁,男女不限;⑥无任何既往病史;⑥无恶性肿瘤、精神性疾病以及其他严重内科疾病;⑦签署知情同意书;⑧术后病理学检查确诊为胸腺瘤。排除标准:①3个月内曾使用免疫抑制治疗,如糖皮质激素或硫唑嘌呤片等;②3个月内曾使用血浆置换术或静脉用丙种球蛋白治疗;③怀孕或哺乳期;④合并其他自身免疫病或炎性疾;⑤近3个月参与其他临床试验。
2. 胸腺瘤不伴MG(NMG组)和心脏手术(对照组):NMG组患者20例,对照组患者10例。入选条件:①无其他恶性肿瘤、精神疾病以及严重内科疾病;②3个月内未使用过激素或者免疫抑制剂;③两组年龄、性别差异无统计学意义;④签署知情同意书。
二、主要试剂与仪器
PerCP-Cy5.5 标 记 的 兔 抗 人CD4 抗 体(Abcam),Alexa Fluor647标记的鼠抗人CXCR5抗体(Abcam),兔抗人PD-1抗体(Abcam),兔抗人ICOS抗体(Abcam),兔抗人Bcl-6抗体(Abcam),BCA蛋白定量检测试剂盒、荧光显微镜(USA)。
三、方法
1. 免疫荧光技术:取切除的胸腺瘤患者瘤旁组织和心脏手术患者萎缩胸腺组织,常规制作石蜡切片,免疫荧光染色,观察胸腺组织中Tfh细胞及CXCR5和PD-1的表达情况。采集免疫荧光图像(×200)输入至显微图像分析仪,利用计算机图像分析系统测定胸腺Tfh细胞比例及其细胞膜上CXCR5和PD-1的平均荧光强度(mean fluorescent intensity,MFI)。
2. 免疫组织化学法:取切除的胸腺瘤患者瘤旁组织和心脏手术患者萎缩胸腺组织,常规制作石蜡标本切片,SP法免疫组织化学染色,观察胸腺淋巴细胞ICOS和Bcl-6的表达水平。细胞膜被染成棕黄色者为ICOS蛋白表达阳性细胞;细胞质或细胞核被染成棕黄色者为Bcl-6蛋白表达阳性细胞。采集免疫组织化学图像(×400)输入至显微图像分析仪,利用Image-Pro Plus测定胸腺淋巴细胞ICOS和Bcl-6染色程度,即平均积分光密度值(mean integrated optical density,MIOD)。
3. 蛋白质印迹法:对胸腺瘤患者瘤旁组织和心脏手术患者萎缩胸腺组织中提取蛋白质进行检测。通过BCA测定法测定蛋白质裂解物的浓度。将总计10 μg的蛋白质上样到12%Tris-甘氨酸凝胶上,并转移到硝酸纤维素膜上,在含0.1%Tween-20和5%牛奶的PBS中封闭2 h,然后在4 ℃下与稀释的抗体孵育过夜。在37 ℃下加入二抗1 h。测定目的条带的灰度值与内参β-actin的灰度值进行比较,该比值作为每个标本Tfh细胞PD-1和Bcl-6蛋白的相对表达量。
四、统计学处理
应用GraphPad Prism 6.0软件进行统计学分析。实验数据以±s表示,组间比较采用Kruskal-Wallis秩和检验。P<0.05为差异有统计学意义。
结 果
一、临床资料
3组患者一般资料及胸腺瘤WHO病理分型、Masaoka临床病理分期和重症肌无力MGFA分型情况详见表1。
二、三组胸腺组织中Tfh细胞比例
免疫荧光结果显示:MG组瘤旁组织中Tfh细胞比例显著高于NMG组,分别为(20.7±1.1)%和(12.1±1.0)%(P=0.000 5)(图1,标尺:500 μm)。
三、CXCR5和PD-1表达的免疫荧光检测结果
与N M G 组相比,M G 组瘤旁组织中T f h细胞C X C R 5 和P D-1 的表达明显增强,分别为0.113±0.008 vs 0.049±0.006(P<0.000 1)和0.101±0.006 vs 0.041±0.005(P<0.0001)(图2,标尺为500 μm)。
四、Bcl-6和ICOS表达的免疫组织化学检测结果
与NMG组和对照组相比,MG组Tfh细胞Bcl-6表达明显增强,分别为0.267±0.024 vs 0.108±0.011(P<0.000 1)和0.267±0.024 vs 0.077±0.010(P<0.000 1);NMG组与对照组Tfh细胞Bcl-6表达水平的差异无统计学意义(P=0.094)。与NMG组和对照组相比,MG组Tfh细胞ICOS表达明显增强,分别为0.174±0.013 vs 0.112±0.008(P=0.006)和0.174±0.013 vs 0.020±0.003(P<0.000 1);NMG组Tfh细胞ICOS表达水平明显高于对照组(P<0.000 1)。各组免疫组织化学染色情况见图3(SP法,标尺为100 μm)。
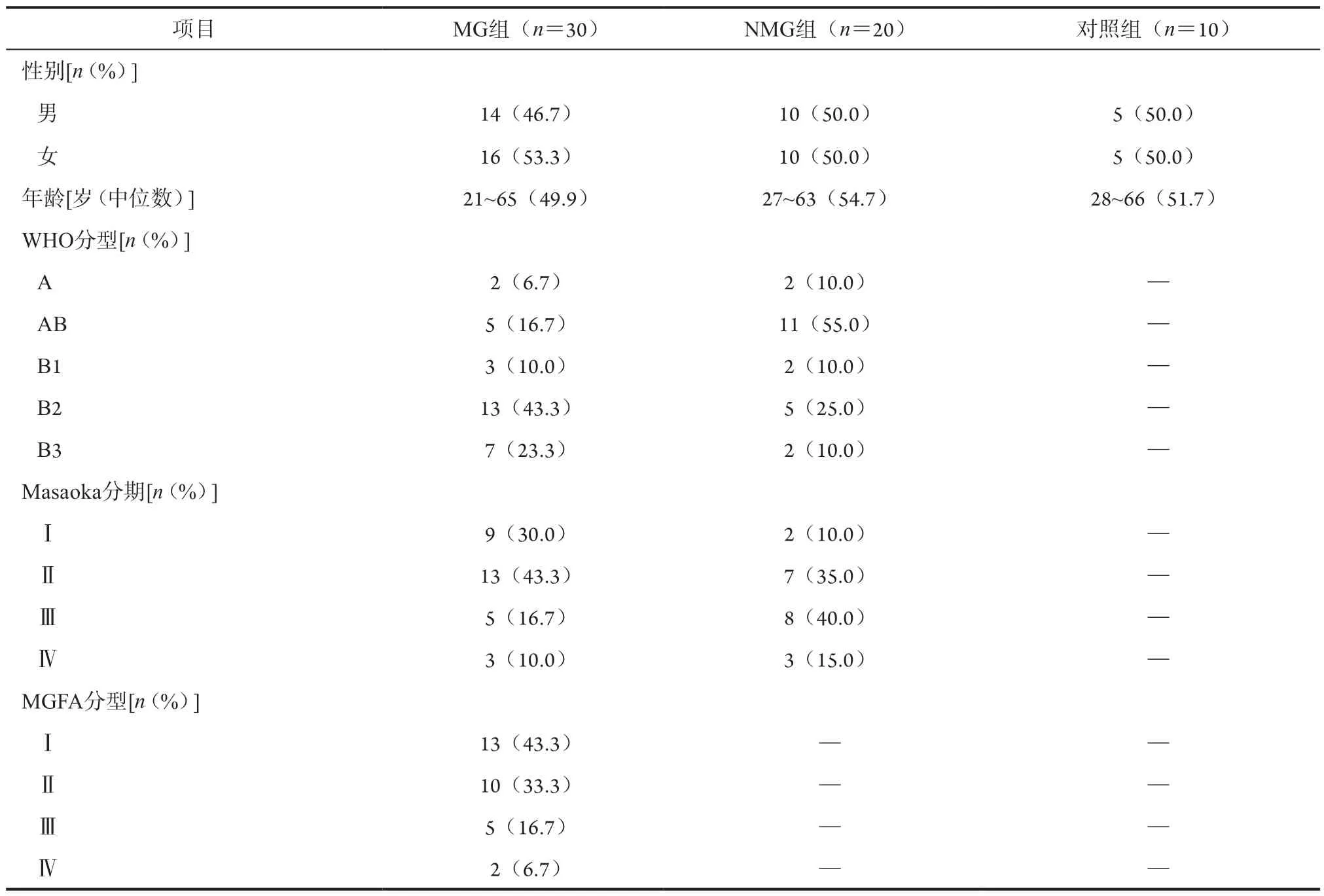
表1 三组患者的临床资料

图1 CD4+CXCR5+Tさ细胞在胸腺瘤伴MG患者中高表达

图2 Tさ细胞膜蛋白CXCR5和PD-1在MG伴胸腺瘤中高表达

图3 胸腺组织中Tさ细胞蛋白分子Bcl-6和COS的表达差异
五、Bcl-6和PD-1蛋白表达的蛋白质印迹法检测结果
蛋白质印迹法检测(图4)结果显示:M G组、NMG组和对照组Tfh细胞Bcl-6蛋白相对表达量分别为0.731±0.036、0.54±0.048和0.52±0.046,P D-1 蛋白相对表达量分别为0.8 0 7±0.0 4 0、0.613±0.067和0.495±0.047。以上结果表明:MG组Tfh细胞Bcl-6蛋白表达水平显著高于NMG组和对照组(P=0.036,P=0.003),该结果与免疫组织化学的检测结果一致;MG组Tfh细胞PD-1蛋白表达水平显著高于NMG组和对照组(P=0.022 7,P<0.000 1)。NMG与对照组Tfh细胞Bcl-6和P D-1 蛋白表达水平的差异无统计学意义(P=0.616,P=0.163)。

图 4 Bcl-6和PD-1蛋白质印迹法检测结果
讨 论
Tfh细胞是CD4+T细胞的一个特殊亚型,因其细胞膜上高表达CXCR5分子,所以将其定义为CD4+CXCR5+T细胞[13]。到目前为止,尚未有研究证明胸腺瘤瘤旁胸腺环境中Tfh细胞及其CXCR5、Bcl-6、ICOS、PD-1是否参与MG伴胸腺瘤疾病的病理过程。因而,本研究收集胸腺瘤伴MG和不伴MG患者胸腺瘤组织标本和心脏手术患者萎缩胸腺标本,通过免疫荧光染色、免疫组织化学和蛋白印迹方法检测胸腺瘤瘤旁胸腺环境中Tfh细胞及其蛋白表达水平,探讨Tfh细胞是否通过不同的免疫反应途径参与MG的发病过程。
Tfh细胞能够促进B淋巴细胞通过异常途径活化,并产生自身免疫性抗体,从而参与自身免疫病的发生和发展。有研究[14-15]发现,Tfh细胞及其蛋白分子的表达量在系统性红斑狼疮、IgA肾病、乙型肝炎等患者外周血中明显高于其相应对照组。MG患者外周血中的Tfh细胞比例明显高于正常对照组,并且Tfh细胞与血清中乙酰胆碱受体抗体(AChR-Ab)水平呈正相关[16]。本研究发现,在MG组的瘤旁胸腺组织中,Tfh细胞比例较NMG组和对照组明显增高,Tfh细胞可能通过异常活化而提高自身免疫活性,从而辅助B淋巴细胞产生自身免疫性抗体,参与MG的进展。
Bcl-6是Tfh细胞表达的重要信号转录蛋白分子,它能够促进生发中心Tfh细胞的活化及B淋巴细胞的成熟[17],其表达量增加不仅促使B淋巴细胞和辅助性T细胞的结合[18],还可诱导CXCR5的产生[19]。Bcl-6在一定程度上抑制小分子RNA,从而促进Tfh细胞表型所需的表面分子CXCR5、PD-1的表达[20]。本研究发现,MG组患者瘤旁胸腺组织Bcl-6表达水平较NMG组和对照组明显增高。这些数据表明,瘤旁胸腺组织中Tfh细胞内高表达的Bcl-6可能参与MG的发展,但在MG的发病机制中Bcl-6特定角色还有待阐述。
ICOS是Tfh细胞膜表面高表达的共刺激蛋白分子,通过与B淋巴细胞表面的配体结合,在T细胞依赖的B淋巴细胞成熟过程中起重要作用[21-22]。最近研究发现,ICOS及其受体提供早期信号诱导Bcl-6的产生而促进CXCR5的表达;ICOS表达减少或者缺失也会引起CXCR5水平明显下降,其在Tfh细胞分化的过程中发挥重要作用[21]。另外,ICOS表达减少或者缺失将导致细胞核内Bcl-6明显减少,虽然CD4+T细胞活化和增殖不受影响,但是无法分化为正常的Tfh细胞。本研究结果证明,MG组瘤旁胸腺中ICOS表达水平明显高于NMG组和对照组,而NMG组瘤旁胸腺中ICOS表达水平明显高于对照组,说明ICOS在MG伴胸腺瘤中表达增加并参与疾病过程。
PD-1是近年来被发现的Tfh细胞高表达的标志蛋白分子,它可能调节生发中心的形成,并且是Tfh细胞向B淋巴细胞提供的直接诱导信号[23]。PD-1及其配体PD-L1和PD-L2在调节体液免疫反应的过程中发挥重要作用。PD-1蛋白分子在Tfh细胞高表达,它通过与B淋巴细胞表达的PD-L2相互作用,调节Tfh细胞和浆细胞的数量及功能:PD-1表达量增加可抑制Tfh细胞的功能,维持滤泡性B细胞产生IL-21;其表达量下降虽然可增加Tfh细胞的数量,但同时由于减少了重要细胞因子的合成而导致Tfh细胞部分功能受损[23]。在携带单核苷酸多态性(single nucleotide polymorphism,SNP)患者体内使用低剂量的PD-L1刺激T细胞,结果产生了功能缺陷的PD-1介导的T细胞抑制反应[24]。最近研究发现系统性红斑狼疮疾病活动期的患者及其亲属外周血PD-1的表达量明显降低,为SLE患者体内PD-1的重要抑制功能提供了直接的证据[25]。另有研究表明,与正常对照组相比,类风湿关节炎患者体内CD4+和CD8+T细胞膜上PD-1蛋白表达水平明显降低[11]。然而,部分研究并未发现PD-1抑制Tfh细胞的功能,但是证实了PD-1信号通路通过维持Tfh细胞与调节性T细胞间的平衡而调节抗体的产生,PD-1信号通路减少使得T淋巴细胞反应无法控制,最终导致自身免疫病的发生[22]。然而,在本研究中,MG组胸腺中PD-1表达水平明显高于NMG组和对照组,PD-1增高可能是PD-1信号通路出现异常的结果,从而影响了Tfh细胞和调节性T细胞间的平衡而参与MG的病理过程。
综上所述,伴MG的胸腺瘤患者瘤旁胸腺组织中蛋白表达量较不伴MG的胸腺瘤患者明显增加,推测胸腺瘤瘤旁胸腺环境中Tfh细胞或者其细胞亚型可能通过上调自身的免疫活性,促进B淋巴细胞产生自身抗体而参与MG的发生和进展。因此,对CD4+CXCR5+T细胞及其细胞亚型、活化B淋巴细胞的检测,不仅有助于评估患者免疫状态,亦有助于进一步阐明MG伴胸腺瘤组织中和外周血中的Tfh细胞之间的功能差异,认识它们与MG的临床评分之间的相关性,以及导致Tfh细胞升高和发生免疫失衡的原因和机制。
