食管鳞癌组织中LIV-1蛋白的表达及预后分析
2020-09-23周士祥李凤蔡彭张群汪庚明孙谦丁建明周育夫李多杰
周士祥 李凤 蔡彭 张群 汪庚明 孙谦 丁建明 周育夫 李多杰
蚌埠医学院第一附属医院放疗科(安徽蚌埠233004)
食管癌是我国高发的消化道恶性肿瘤,发病率和死亡率分别居第6 位和第4 位,男性发病率是女性的2.25 倍,在60 ~64 岁发病人数最多[1-2]。在我国,80%以上食管癌患者组织学类型为鳞癌,腺癌较少见,与西方欧美国家食管癌患者有很大区别。手术切除是早期食管癌患者标准治疗策略,大部分食管鳞癌患者由于早期无特异性症状,而且缺乏特异性肿瘤预测标志物,确诊时往往已经发展成晚期,此时可手术切除患者比例低,死亡率高,预后差,5年生存率不到30%[3]。食管鳞癌生物学特性是恶性生长并且早期局部浸润、侵袭、转移,预后差,因此,寻找新型生物标志物对食管鳞癌患者早期诊断、判断预后及治疗至关重要。
锌离子转运体LIV-1 蛋白(又称SLC39A6、ZIP6),在乳腺癌[4]、肝癌[5]、宫颈癌[6]等实体瘤中高表达,且LIV-1 高表达的患者死亡风险显著高于低表达患者。但到目前为止关于LIV-1 蛋白在食管鳞癌中的研究比较少,缺乏作为早期诊断、判断预后和治疗食管鳞癌的靶基因证据。因此,本研究回顾性分析局部中晚期食管鳞癌患者术后标本,对LIV-1 蛋白表达水平不同的食管鳞癌患者的临床特征、预后进行对比分析。
1 资料与方法
1.1 病例资料收集2012年5月至2016年3月蚌埠医学院第一附属医院病理科收治并存档的139 例食管鳞癌患者术后石蜡组织标本和36 例癌旁正常食管上皮组织,术后病理分期为T3N0-3M0 的患者,术前未做放化疗。并收集患者社会人口学资料、病史、影像学资料及术后病理资料,2019年5 ~6月通过电话进行随访,终点事件为疾病进展和全因死亡,所有实验方案均经蚌埠医学院第一附属医院伦理委员会批准,并按照相关指南和规定进行,所有患者均填写书面知情同意书。
1.2 实验试剂试剂为兔抗LIV-1 单克隆抗体,来源于abcam(美国公司)。S-P 试剂盒、免疫显色试剂(DAB 显色液)来源于福州迈新生物技术开发有限公司。
1.3 方法
1.3.1 LIV-1 在食管鳞癌组织中表达分析石蜡包埋标本取自4%福尔马林固定的食管鳞癌组织和癌旁组织(前期收集记录的139 例食管鳞癌组织和36 例癌旁组织)。然后对139 例食管鳞癌组织和36 例癌旁组织进行HE 染色。按4 μm 的厚度对石蜡标本进行连续切片,将石蜡包埋的4 μm 切片在65 ℃下持续烘烤1 h(防止掉片),然后将石蜡切片浸入二甲苯溶液中,分别静置10 min 进行脱蜡,后将石蜡切片依次放入不同梯度的酒精中分别静置5 min 脱二甲苯,玻片放入水中浸洗3 次进行水化,严格按照试剂盒说明书的具体操作步骤进行免疫组织化学染色。然后根据LIV-1 蛋白表达水平不同进行分组,分成LIV-1 蛋白高表达组和LIV-1 蛋白低表达组。
1.3.2 免疫组化评分标准采用免疫组化Envision 试剂盒检测LIV-1 蛋白在食管鳞癌组织中的表达情况,按照试剂盒说明书上免疫组化的步骤进行上述操作,用abcam 试剂公司提供的照片为阳性对照,滴加PBS 缓冲液代替一抗作为阴性对照,LIV-1 蛋白染色结果以细胞浆或细胞核中出现棕黄色颗粒为阳性。对LIV-1 蛋白染色标记的表达结果均以组织中阳性细胞比例、阳性细胞百分比和阳性细胞染色强度进行判断,免疫组化染色结果描述[7-8]:≥++ 被定义为高表达,<+为低表达。每张切片在高倍镜下观察并计算LIV-1 阳性细胞数,得分用阳性染色细胞百分比与细胞染色强度的计分成绩来判断,有差异的结果则由两位病理科专家讨论后达成一致。
1.4 统计学方法计量资料若符合正态分布,用均数±标准差表示,非正态分布用M(P25,P75)表示,组间比较用两独立样本t检验、Satterthwaite 近似t检验或Wilcxon 秩和检验;计数资料用例数(%)表示,组间比较采用χ2检验。生存曲线用Graphpad prism8 绘制,两组间比较采用Log-rank 检验,Cox 比例风险回归模型评价LIV-1 蛋白表达与终点事件的关系,所用变量进行单因素分析,多因素分析纳入单因素分析中P≤0.10 及认为有临床意义的变量;统计学分析采用IBM SPSS 26.0 软件,进行双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 不同LIV-1 蛋白表达水平的食管鳞癌患者临床特征本研究纳入139 例食管鳞癌患者术后组织标本并进行LIV-1 蛋白表达水平检测。患者年龄40 ~78 岁,平均63.3 岁,男110 例(79.1%),女29 例(20.9%),LIV-1 蛋白高表达73 例(52.5%),低表达66 例(47.5%)。LIV-1 蛋白高表达与低表达组间年龄、性别、肿瘤位置、分化程度、淋巴结状态差异无统计学意义(P>0.05),见表1。
2.2 临床组织病理学结果在癌旁食管上皮组织中,LIV-1 蛋白的表达主要着色在基底细胞胞浆上,而食管鳞癌组织LIV-1 蛋白的表达主要着色在细胞浆及细胞核。139 例食管鳞癌组织及36 例癌旁正常组织(正常组织距离食管癌细胞边缘大于5 cm)病理结果见图1。
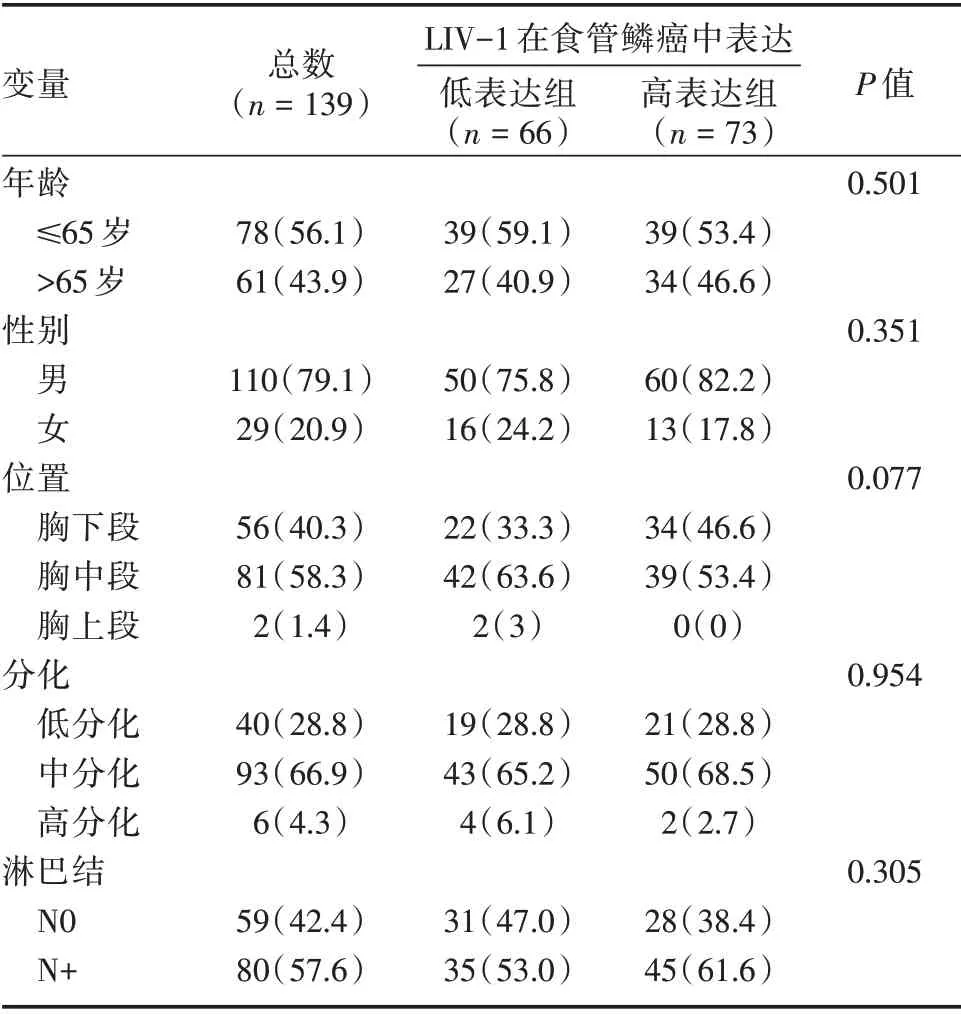
表1 LIV-1 蛋白表达与食管鳞癌患者临床病理特征Tab.1 The expression of LIV-1 protein andclinicopathological characteristics of patients with esophageal squamous cell carcinoma 例(%)
2.3 癌旁食管上皮组织与食管鳞癌组织LIV-1 蛋白表达情况免疫组化结果显示在癌旁食管上皮组织中LIV-1 蛋白高表达率为11.11%,食管鳞癌组织中高表达率为52.5%(表2)。
2.4 生存分析在中位随访时间31(2,91)个月后,获得139 例(100%)患者生存资料,低表达组的总生存期(OS)与无病生存期(DFS)明显高于高表达组(图2A、D)。根据淋巴结状态进行亚组分析提示:在淋巴结阴性组中,LIV-1 蛋白低表达食管鳞癌患者的OS 与DFS 高于LIV-1 蛋白高表达食管鳞癌患者(图2B、E);而在淋巴结阳性组中,LIV-1蛋白表达高低与OS 和DFS 无关(图2C、F)。Cox单因素回归分析提示,LIV-1 蛋白高表达的死亡风险显著高于低表达组(HR= 1.789,95%CI:1.141~2.804,P= 0.011),见表3。多因素回归分析仍提示,LIV-1 蛋白高表达的死亡风险显著高于低表达 组(HR= 1.633,95%CI:1.040 ~2.566,P=0.033),见表3。

图1 食管鳞癌临床组织病理切片Fig.1 Clinicopathological section of esophageal squamous cell carcinoma
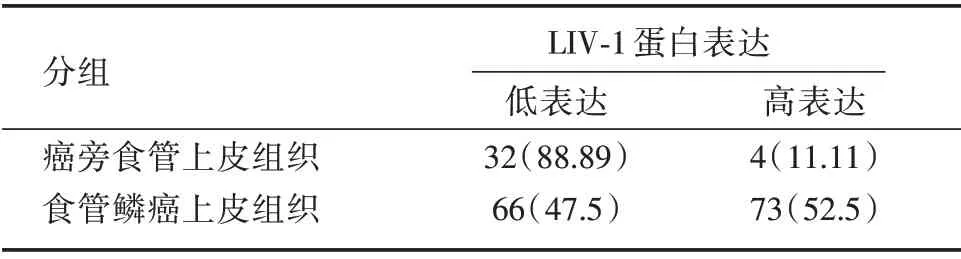
表2 LIV-1 蛋白在癌旁食管上皮组织和食管鳞癌组织中表达的强阳性率Tab.2 Dysregulation frequency of LIV-1 protein expression in non-tumor esophageal and esophageal squamous cell carcinoma tissue 例(%)
3 讨论
本研究回顾性分析了139 例食管鳞癌患者一般临床特征及预后分析,并对LIV-1 蛋白低表达与高表达两组患者特征进行了比较。结果发现LIV-1蛋白高表达与低表达两组间年龄、性别、肿瘤位置、分化程度、淋巴结状态差异无统计学意义,而LIV-1 蛋白低表达组OS 与DFS 明显高于高表达组。
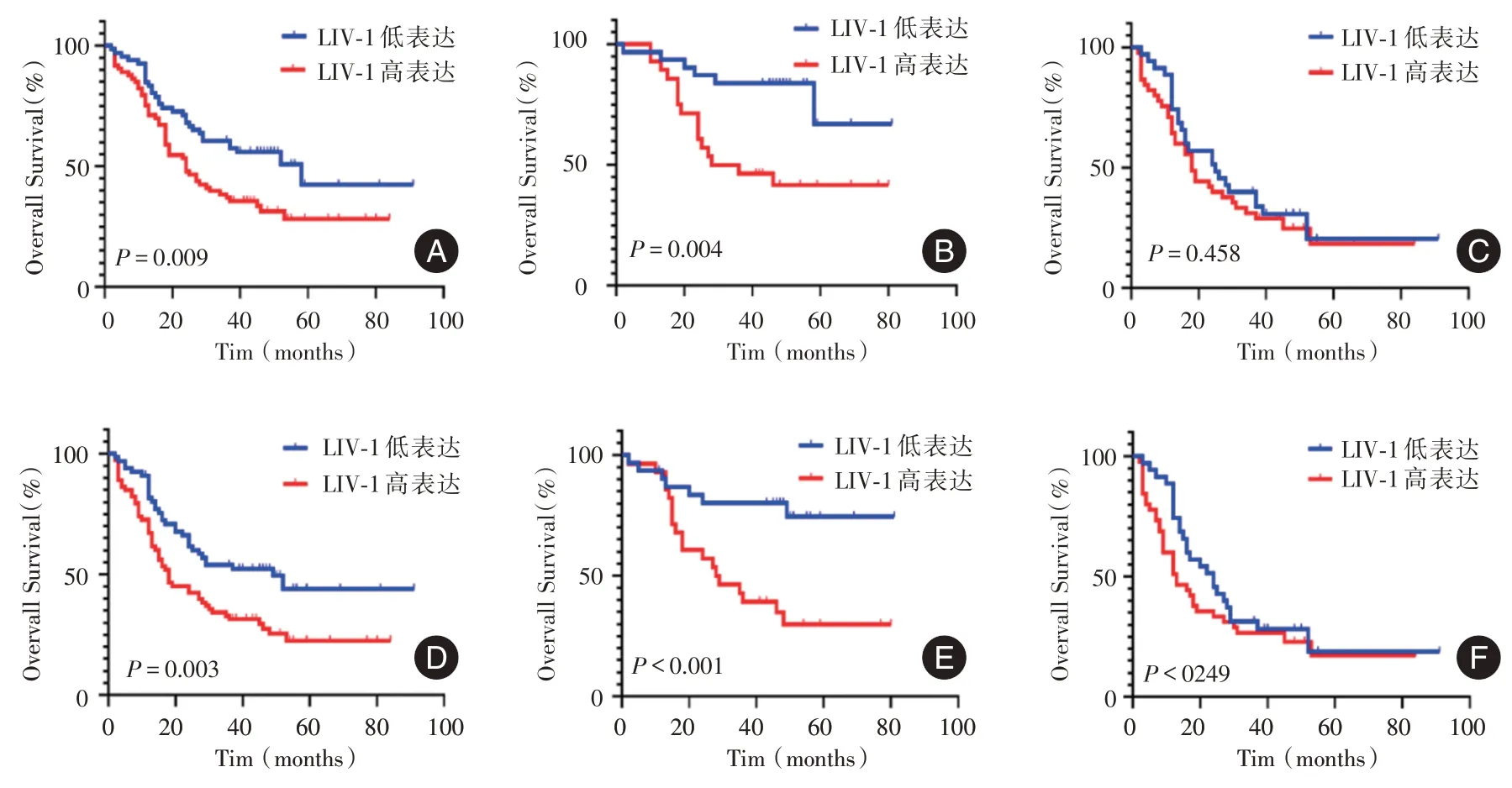
图2 预后生存分析Fig.2 Survival analysis of prognosis
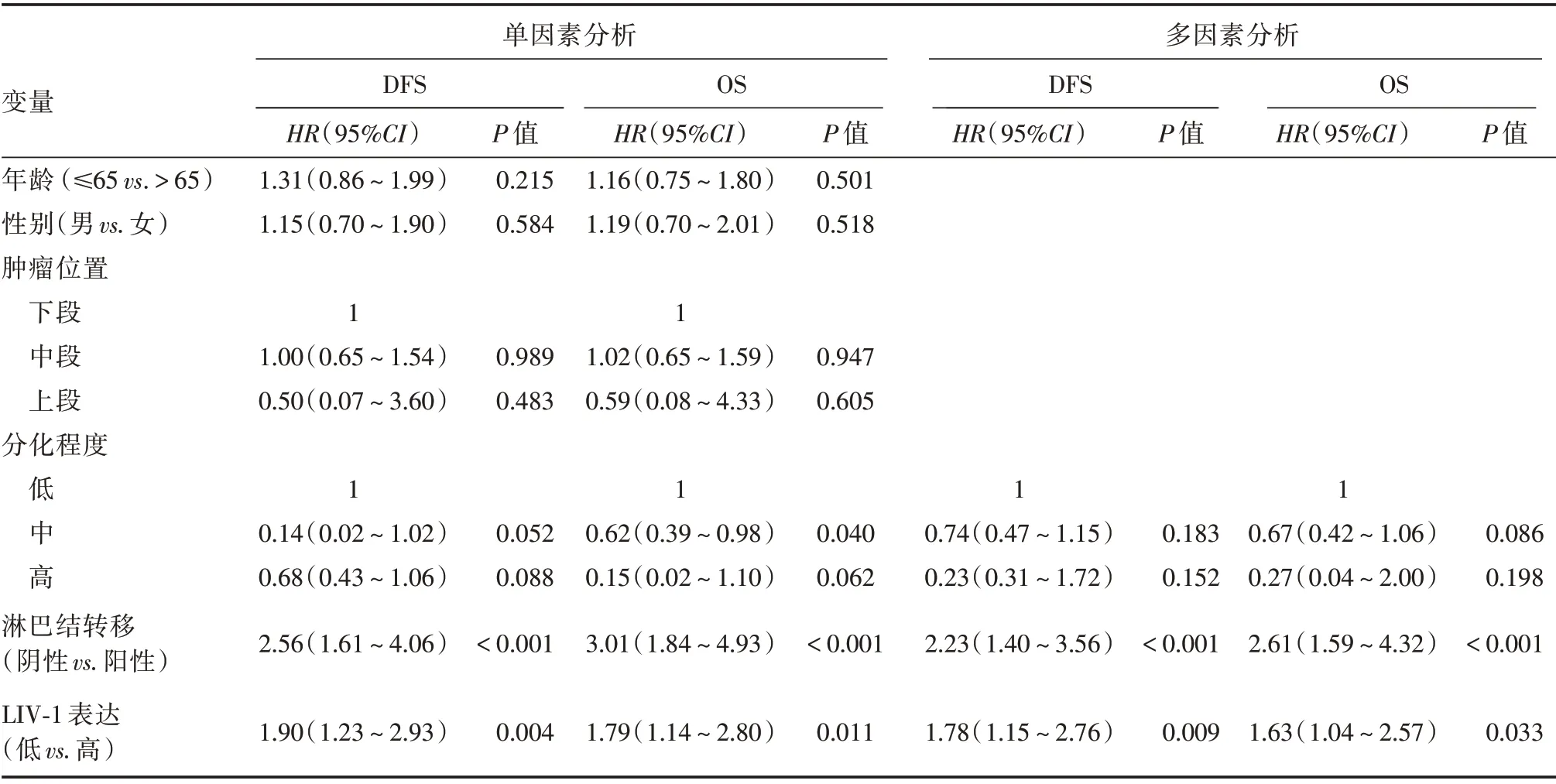
表3 食管鳞癌患者无病生存期与总生存期COX 回归单因素和多因素分析Tab.3 Univariate and multivariate Cox regression analyses of the prognostic variables in ESCC patients
LIV-1 基因属于ZIP 家族中锌转运蛋白(LZT)的新亚家族成员,是MANNING 等[9]最早于1988年在人乳腺癌细胞系中发现一种大小为4.4 kb 可被雌激素诱导的新基因。LIV-1 基因位于细胞膜上,主要功能是维持细胞内外锌离子浓度稳定,把细胞外的锌离子转运到细胞内。锌离子作为机体内的必要微量元素,在细胞分裂、细胞之间信息转录调控、DNA 和蛋白质合成过程中具有重要作用,是细胞生长和分化必不可少的离子,在很多生物学过程中,锌离子充当酶的催化辅助因子或蛋白质成分,比如含锌指的蛋白质[10]。在某些恶性肿瘤细胞中,细胞内锌离子浓度的增加或LIV-1基因表达失活可能是细胞凋亡抵抗和细胞加速生长的决定性因素[11-12]。而且研究报道[13]在斑马鱼胚胎和人类癌细胞中LIV-1 基因控制着上皮间质转化过程,上皮间质转化过程是恶性肿瘤发生浸润、转移过程中的重要生物学事件,在上皮间质转化过程中LIV-1基因是STAT3下游靶点,LIV-1基因与锌指蛋白Snail 共同抑制钙黏附蛋白E 的表达。
食管鳞癌的发生发展和预后受遗传、生活方式和环境的影响[14-15],某些基因的单核苷酸多态性可能通过某种方式改变蛋白质表达水平或活性,促进恶性肿瘤发生。WU 等[7]首次报道了与汉族食管鳞癌患者生存相关的新遗传位点,rs1050631和rs7242481,位于18q12.2 染色体上LIV-1 基因。CHENG 等[16]进一步探究LIV-1 基因促进食管鳞癌发生发展的机制,在细胞水平和动物实验中,检测经典信号传导通路ERK1/2 和AKT 信号通路下游效应,比如MMP1、MMP3、MYC 和SLUG 信号分子的表达情况。发现不论是在动物实验中还是食管鳞癌组织标本中LIV-1 mRNA 表达水平与MMP1、MMP3、MYC 和SLUG 信号分子的mRNA 表达水平呈正相关,说明LIV-1 基因可能通过调控AKT 和ERK1/2 信号通路促进食管鳞癌细胞的增殖、侵袭和转移。
WU 等[7]发现在食管鳞癌患者中,LIV-1 基因是食管鳞癌独立预后因素,LIV-1 蛋白高表达的患者死亡风险显著高于LIV-1 蛋白低表达患者,本研究也提示LIV-1 蛋白高表达的死亡风险显著高于低表达组。CVI 等[17]发现LIV-1 蛋白在食管上皮癌前病变和食管鳞癌组织中均高表达,且与食管鳞癌分化程度、淋巴结转移密切相关,并发现LIV-1 蛋白高表达是食管鳞癌独立预后因素,在食管癌前病变时,LIV-1 蛋白就出现高表达现象。本研究中,在癌旁食管上皮组织中,LIV-1 蛋白基本上处于低表达状态,LIV-1 蛋白高表达率为11.11%,食管鳞癌组织中高表达率为52.5%,并发现LIV-1 蛋白是食管鳞癌的独立预后因素,但是LIV-1 蛋白高表达及低表达组间的食管鳞癌患者分化程度、淋巴结转移差异无统计学意义。在本实验中亚组分析结果得出,在淋巴结阴性组中,LIV-1 蛋白低表达组食管鳞癌患者OS、DFS 显著高于高表达组;而淋巴结阳性组,LIV-1 蛋白低表达组和高表达组食管鳞癌患者OS、DFS 差异无统计学学意义,可能原因为LIV-1 基因在早期食管癌患者中对预后有一定影响,促进肿瘤的浸润、侵袭和转移,而淋巴结转移的患者中,大部分属于中晚期患者,预后普遍都很差,LIV-1 基因在这部分患者对预后的影响未能体现出来。亚组分析结果的不同提示,LIV-1 蛋白在食管鳞癌患者早期阶段更具有预测价值。GAO 等[8]报道在胃腺癌术后患者中,LIV-1 基因rs1050631 遗传位点与胃腺癌患者术后预后相关,LIV-1 基因可能促进胃腺癌患者复发或转移,LIV-1基因rs1050631 遗传位点CT 和TT 基因型患者复发风险和死亡风险显著高于CC 基因型患者。LIV-1 蛋白高表达可能是消化道肿瘤患者预后差的独立预后因素。
近期有研究表明LIV-1 基因在T 淋巴细胞活化过程中具有重要作用,LIV-1 基因通过调节细胞内锌离子浓度的稳定影响T 淋巴细胞的激活和凋亡,将来可能以LIV-1 基因作为免疫调节的治疗靶点[18-19]。SUSSMAN 等[20]报道以LIV-1基因为靶点的新型抗体偶联药物SGN-LIV1A 有望用于治疗难治性转移或复发型乳腺癌患者。BAGHERI 等[21]在兔子体内合成针对LIV-1 基因的抗体,可以识别LIV-1 基因靶标并与其天然蛋白结合。目前食管鳞癌患者药物治疗效果欠佳,无特异性靶向药。在食管鳞癌患者中LIV-1 蛋白高表达率显著高于正常食管上皮组织,相信不久的将来以LIV-1 基因为靶点的药物可以为食管鳞癌患者带来曙光。
综上所述,LIV-1 蛋白低表达是食管鳞癌改善预后因子,对食管鳞癌早期诊断、潜在靶点的治疗具有重要意义,但是距离找到针对LIV-1 基因靶点的药物治疗食管鳞癌患者仍需要很长的路,需要更深层次的研究。
