鱼类逆境情况下MicroRNA表达研究进展
2020-09-23陈一竹杨长幸马文文冯梦霞董文广高云霓顾钱洪周传江
陈一竹,杨长幸,马文文,王 月,冯梦霞,董文广,汪 曦,张 曼,董 静,高云霓,顾钱洪,周传江
( 河南师范大学 水产学院,河南省水产动物养殖工程技术研究中心,水产动物疾病控制河南省工程实验室,河南 新乡 453007 )
鱼类因其生活环境的多变性,在其生活史中经常受到各种环境胁迫,因环境条件改变产生的不利变化都会使动物产生应激反应。疾病、有机体损伤、低氧、重金属和环境污染等均会打破鱼体原有的平衡,影响鱼类生长甚至生存。而脊椎动物进化出了能够依靠转录因子和细胞因子进行自我保护的复杂免疫反应[1],这些免疫反应的激活信号通路主要通过核转录因子NF-κB激活[2],因此在逆境中转录水平表达量的变化就具有重要的参考意义。鱼类因正常生活环境被改变而受到不利环境因素刺激后,会进行自我保护,通过调控自身转录水平来适应环境的改变。研究表明,MicroRNAs在哺乳动物、植物、低等脊椎动物等生物体中广泛存在,参与生物体细胞分化、生长发育、疾病发生与免疫调节、抗低氧等生命活动过程,并扮演着重要角色[3-6],笔者主要总结鱼类逆境适应中相关MicroRNA研究进展,以期为探究鱼类适应逆境机制提供参考。
1 MicroRNA的发现历程
MicroRNA(miRNAs)是由Victor等于1993年最早发现的,其通过线虫胚胎发育时间控制缺陷性遗传筛选试验,鉴定出一个通过抑制lin-14蛋白表达来控制线虫发育时间的小分子RNA——lin-4(miRNAs家族成员之一)[7-9],但在随后的一段时期内并没有引起人们的重视。直到后来又一个miRNA——let-7被发现,研究者们才开始深入了解、研究该家族及其功能作用机制[10-12]。研究者通过试验与生物信息学预测,发现它们在进化上处于高度保守状态[13-14],这预示着这个小分子家族可能具有十分广泛和重要的作用。自let-7被发现之后,研究者们发现并证实了miRNA广泛存在于多种动植物中,目前在拟南芥(Arabidopsisthaliana)、鲤鱼(Cyprinuscarpio) 、斑马鱼(Daniorerio)、虹鳟(Oncorhynchusmyliss)以及人(Homosapiens)中均有发现并鉴定出多个miRNA[15-19]。
2 MicroRNA命名及其特征
根据MicroRNA注册中心 (http://www.sanger.ac.uk/Software/Rfam/mirna/)的注册要求,当对一个全新的miRNA进行注册登记时,会基于miRNA的序列相似性给出数字标识符。例如,在黑腹果蝇(Drosophilamelanogaster)中鉴定出了miR-318,则之后鉴定出不同于之前鉴定的miRNA会给予连续标号的名称,如miR-319。在不同生物体中的同源序列可命名为相同的名称。
基于被切除的约22个核苷酸序列的相似性,成熟序列相同的将会被命名为同一个名称,例如果蝇中的miR-6-1和miR-6-2(从它们分开的基因位点给出数值后缀)[20]。如果有1个或2个碱基变化的序列,分配名称的后缀如miR-181a和miR-181b[13],有更多碱基差异的同源序列,通过分析初级转录物发夹部分序列相似性或与作者讨论确定名称。
从一个miRNA的发夹前体中切除得到的2个miRNA[来自于不同的“臂”(arm)]在表达过程中不占主导地位的加注“*”,例如黑腹果蝇中的miR-56和miR-56*[21]。在未确定哪个在表达过程中占主导地位之前,目前主张以加后缀“-3p”表示3′(arm),“-5p”表示5′(arm)的形式表示,例如miR-140-3p。但以前的报道中有用miR-142-s和miR-142-as表示5′(arm)和3′(arm)[22]。
由于最初发现的非编码小RNA分子在发育时序调控上具有相似的作用而被称为小时序RNA(stRNA)。此后,越来越多新的非编码小RNA分子被发现,与lin-4和let-7来源相同、长度相似(均为21~25 nt),且内源性表达具有进化上的高度保守性。但这些新发现的小RNA分子并不具有lin-4和let-7所具有的时序表达性,而倾向于在特异性细胞或组织中表达[23]。因此,研究者们认为此类分子并不仅仅只是时序性调控生物发育,应具有更为广泛的功能。于是学者们将之称为miRNA,特指那些具有以下特征的小分子RNA:来自于具有茎—环结构前体的一条手臂上;成熟的miRNA 5′端有一个磷酸基团,3′端为羟基;内源性表达长度为21~25 nt的小RNA分子;进化上具有保守性(图1)。
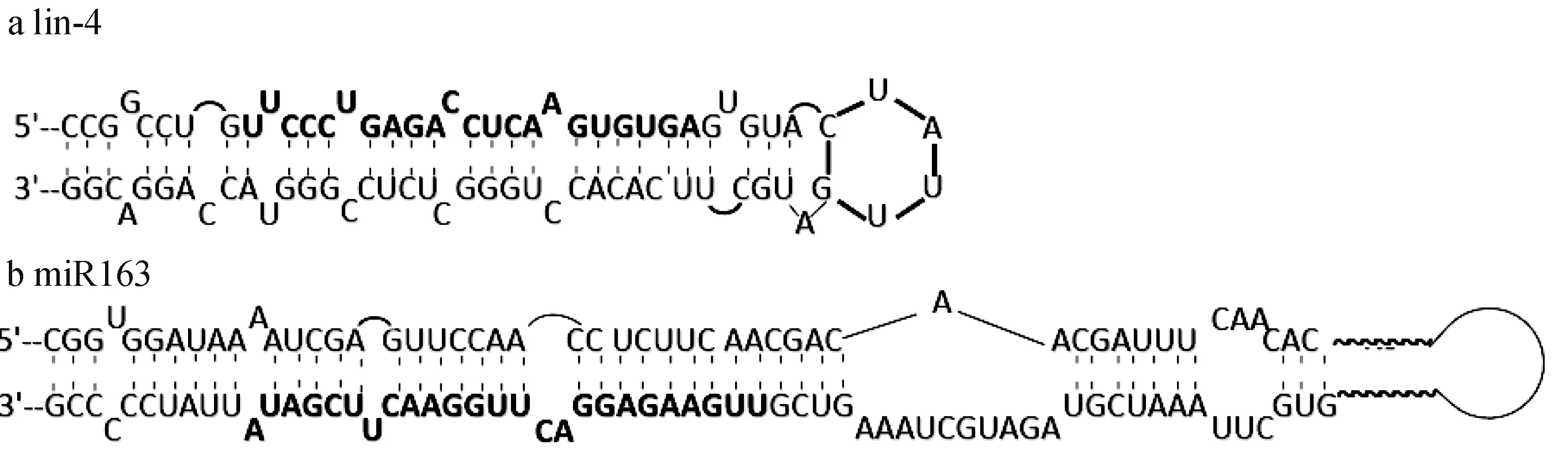
图1 计算机预测的编码MicroRNA的发卡结构
3 MicroRNA的调控、功能及靶基因
miRNA是一类非编码的内源小分子RNA,长度约为21~25 nt,作为非编码RNA中的一员,它在鱼类生长发育和逆境胁迫响应等过程中发挥着重要作用[19,25-27]。它可以通过mRNA剪切和抑制蛋白质翻译的方式调控靶基因[6,28],因此,寻找与逆境胁迫响应相关的重要miRNA并探索其如何介导鱼类逆境调控机制显得十分迫切。
第一个关于硬骨鱼miRNA的研究是对斑马鱼miR-430功能的探讨。试验中通过注射miR-430用于拯救大脑MZdicer(maternal-zygotic dicer)缺陷突变体,推测miR-430在斑马鱼形态形成中扮演着关键的角色[29]。目前,研究者们普遍认为miRNA通过与靶基因(通常认为其目标mRNA分子存在3′端非编码区域)互补匹配,使该mRNA分子的翻译受到抑制或者直接降解该mRNA;当互补程度较低时便会使mRNA的翻译抑制;高度互补时会导致靶mRNA的降解[6,30]。随着miRNA被大量发现,学者们对miRNA功能的研究也越来越感兴趣。一些使用反向遗传学方法发现的miRNA,通过基因突变或在miRNA的靶位点上引入突变来抑制miRNA的作用,进而观察机体表型变化来探究其功能线索[31]。各方面的信息暗示着miRNA的功能作用并不仅仅限制于单个方面,越来越多的报道表明miRNA参与细胞生理学各个方面,有着多方面功能潜力[32]。此外,同一个靶基因可以由多个miRNA共同调控,同样,同一个miRNA也存在着多个不同的靶基因,因此某些基因功能的表达是多个miRNA共同作用的结果(图2)。研究发现,miRNAs在生物体细胞增殖、胚胎形成、生长发育、脂肪代谢及疾病的发生过程中发挥着十分重要作用[13,33-36],但对其详细调控机制目前尚不清楚。

图2 miRNA调控靶基因作用示意
虽然虹鳟、斑马鱼和鲤鱼等少数鱼类部分miRNA已经被鉴定[16-18],但目前关于鱼类miRNA的研究仍相当匮乏。有关鱼类miRNA方面的研究有待进一步加强,根据miRNA收录网站(http:∥www.mirbase.org/index.shtml)的数据显示,已经收录的miRNA数量多达38 589条(2018年3月18日最新更新),成熟的miRNA超过30 000个,涵盖271个物种,但仅仅只有很少的鱼类miRNA序列被收录,各个研究者根据研究目的和研究重点不同,内容有交叉的研究更少。
4 鱼类逆境下MicroRNA研究进展
鱼类生活在不同的环境中,其生命活动面临多重因素的影响,比如温度变化、低氧、机体损伤、细菌感染、水体中内源性藻类异常增殖、多种来源的外来污染物,如重金属和农药的胁迫等,机体调动相关的miRNAs参与这些因素调控过程。
4.1 温度对鱼类MicroRNA表达的影响
温度变化能影响miRNA的mRNA作用于靶细胞,从而适当改变信号通路影响mRNA的翻译去帮助机体适应温度变化[38]。Beauchemin等[25]研究发现,斑马鱼在热诱导下,其体内miR-101a在转录水平表达有显著的增加,并发现hsp70(热胁迫下,有利于机体适应环境的重要蛋白)诱导能改变miR-101a转录水平表达量,重要的是长期每天热处理未显著影响斑马鱼的生存。Biggar等[39]通过冷冻处理来检测锦龟(Chrysemyspicta)的适应性保护机制,检测到在低温胁迫下有miRNAs有特殊的表达变化,经20 h的冷冻处理,在其肝组织检测到cpm-miR-16在转录水平表达量上调,而cpm-miR-34a和cpm-miR-133转录水平的表达显著减少,且发现cpm-miR-16和cpm-miR-21能有效地提高新陈代谢,并在冷冻室适应中具有独特的功能。这都揭示出miRNA在鱼类适应温度胁迫中可能起着重要的作用。
4.2 低氧对鱼类MicroRNA表达的影响
缺氧可以诱导细胞急性和慢性缺血导致细胞损伤和死亡[40-41]。据报道,一些缺氧相关的蛋白会将氧信息变化传递给下游的信号效应器,这些蛋白质可以帮助鱼类感知氧浓度大小,有利于鱼类在一定范围内适应环境中氧浓度,超出浓度范围会导致细胞编程性死亡[42-43]。据研究表明,miRNA在细胞凋亡中扮演着关键角色(如miR-20a,miR-21,miR-146a,miR-222等均为细胞中重要的抗凋亡miRNAs)[44-47]。Xu等[48]通过低氧诱导心肌细胞凋亡的试验发现,miR-1、miR-21、miR-146a、miR-20a等在抑制心肌细胞凋亡过程中发挥着重要的作用,且miRNA之间存在协同作用,在低氧诱导过程中,单独接种miR-20a和miR-21 (40 nmol/L) 的细胞活力分别恢复8.2%和7.5%,当同时接种miR-20a和miR-21 (20 nmol/L) 时能使细胞活力恢复21.6%。通过接种miR-1、miR-21、miR-146a,在不同组内分别抑制其活性,miR-1和miR-21共同阻止了低氧诱导心肌细胞凋亡。在miR-1和miR-21表达组中,p53的mRNA水平显著降低(p53蛋白能调节细胞缺血性凋亡,因此,抑制p53蛋白凋亡信号是一个潜在的策略以防止缺血所致的心肌损伤)[49-50]。Nallamshetty等[51]在青鳉(Oryziaslatipes)的低氧胁迫试验中发现总共14个miRNA在转录水平表现出明显变化,其中9个上调和5个下调,此外,还发现mir-204-5p可调节细胞凋亡相关基因,如HIPK1。Camps等[52]通过低氧胁迫癌细胞16、32、48 h,观察到hsa-miR-222-5p, hsa-miR-145-3p与 hsa-miR-4521分别出现下调,并检测到hsa-miR-145-3p作用于靶基因调节缺氧状态下线粒体的活动。这些结果表明,miRNA在机体适应低氧环境中扮演着重要角色。迄今为止,关于鱼类的miRNA在适应低氧环境中功能作用的研究仅有少量报道,因此,探究鱼类的miRNA在适应低氧环境中的功能作用研究具有重要的科学价值。
4.3 机体损伤对鱼类MicroRNA表达的影响
某些鱼类在成年后依然保留良好的组织器官再生能力[53-54],如斑马鱼的心肌损伤后(心室切除、低温损伤)能完全再生。血统追踪试验揭示了心肌细胞去分化是形成新的心肌细胞的主要来源,为了应对损伤,已有的成熟心肌细胞进行肌动蛋白的分解过程,重新进入细胞周期和增殖[55-57]。在进一步受伤的部位由纤维组织局部去分化形成的细胞替换受伤的心肌细胞[58]。研究表明,miRNA在心脏细胞受伤后再生的早期阶段扮演着重要的角色。Beauchemin等[25]在心室受伤6 h后的斑马鱼中检测到miR-101a、miR-19b、miR-29a、miR-214、miR-222、miR-203b和miR-738在转录水平表达均有上调。通过深入研究证实了心肌细胞的去分化和增殖与miR-101a表达下调密切相关,在心脏细胞受伤后miR-101a的表达会立刻下调来响应心肌细胞受损,在3~6 h后,miR-101a表达会稳步降至最低水平。Yu等[59]的研究结果显示,mir-133b在成年斑马鱼的脊髓再生中起着决定性作用,在斑马鱼脊髓损伤再生中,mir-133b通过内源性调控RhoA(是一个轴突生长的抑制剂,以及其他神经突相关的生长分子),它通过直接与RhoA mRNA相互作用降低RhoA蛋白水平,促使脊椎轴突再生,从而促进斑马鱼脊椎损伤的恢复。
4.4 细菌感染等疾病对鱼类MicroRNA表达的影响

目前研究已证实,miRNA参与人类及其他动物的免疫和疾病防御中发挥重要作用,如Koscianska等[19]研究强直性肌营养不良Ⅰ型(DM1)时发现miR-206 与miR-148a共同发挥着重要的作用。而与人类免疫和疾病防御相关的部分miRNA,在鱼体内也多有存在,但对其在鱼体内功能的研究却少有报道,有待深入研究其功能及作用机制。
4.5 藻毒素对鱼类MicroRNA表达的影响
Brzuzan等[66]通过真白鲑(Coregonuslavaretus)的微囊藻胁迫试验,在检测其肝脏中miRNA的转录水平表达发现,miR-122在肝脏的代谢通路和调控中起着关键性的作用,miR-122通过抑制靶基因或调控细胞基因的表型来调控肝脏的功能。在其肝脏中miR-16a也出现显著的上调,而miR-16a在鱼类免疫中起着至关重要的作用[16]。Lakomiak等[67]通过在白鲑鱼体内注射微囊藻毒素试验发现,接触MC-LR会改变miR-34a在真白鲑肝脏中的表达模式,使肝脏中的miR-34a表达上调。在微囊藻毒性试验中,通过沉默miR-34a和bcl-2的表达会引起蛋白质的磷酸化退化,导致细胞凋亡。Li等[17]通过使用不同质量浓度微囊藻毒素胁迫斑马鱼发现,斑马鱼肝脏中多个miRNA转录水平表达受到影响。通过qRT-PCR检测用0、50、200 mg/L和800 mg/L微囊藻毒素胁迫处理24 h后斑马鱼肝脏miRNA表达量变化,结果显示,dre-miR-27b和dre-miR-21表达上调,dre-miR-122和dre-miR-148a在所有组中均表达上调。
4.6 重金属对鱼类MicroRNA表达的影响
重金属污染物威胁着鱼类的生长发育、繁殖等,并可对其生理功能、机体组织结构和遗传特征等造成重大影响。铜、镉等是常见的重金属污染物。Wang等[68]在使斑马鱼暴露于氯化铜污染的试验中发现,在不同质量浓度的氯化铜溶液中miRNA的表达水平有明显差异。通过设置6、16 ng/mL Cu2+和40 ng/mL Cu2+的梯度试验,用1龄相同大小的斑马鱼,在合适的密闭环境中暴露于铜污染下24 h,经研究发现,随着铜离子质量浓度的增加miRNA的转录水平表达发生了变化。如miR-183在16 ng/mL、40 ng/mL Cu2+组中的转录水平表达出现下调(16 ng/mL、40 ng/mL Cu2+分别下调了52%和45%)。而miR-183在内耳感觉神经中起着重要的作用,敲除miR-183会导致内耳感觉神经受损[69]。在3个试验组中,分别有1个、7个、23个miRNA转录水平的表达出现上调,1个、3个、5个miRNA转录水平的表达出现下调,尤其是通过上调miR-203a、miR-199、miR-16a、miR-16c和miR-25发现可能会造成斑马鱼mRNA水平钙信号减少。
4.7 农药及有机物对鱼类MicroRNA表达的影响

从以上研究可知,在这些不利因子影响下,鱼类适应外界不利环境过程中,miRNA发挥着重要的作用。
5 展 望
逆境引发鱼类各种适应性反应,旨在缩小影响或适应逆境造成的破坏并恢复正常的生理机能,根据其刺激的类型及其持续时间不同,反应的种类也不尽相同。近年来,关于鱼类逆境相关的研究逐渐增多,然而鱼类的抗逆性是外界和自身一系列因素共同作用的结果,但当前的研究大多均通过实验室模拟逆境条件来实现的,且多在单一逆境条件下进行诱导蛋白基因研究。然而,自然状态下的鱼类通常受到多种逆境胁迫,存在时间先后性与多重作用叠加。但同一miRNA在不同逆境和不同物种中的调控研究鲜有报道,而不同miRNA可共同调控同一个靶基因,同一个miRNA也存在着多个不同靶基因,那么在复杂的自然条件下,同一miRNA在不同逆境同时作用下其表达调控与作用关系会如何?因此,在今后的研究中应当探讨多基因共同作用的关系,在调控基因表达量和表达时间等方面进行深入研究。
越来越多的证据表明,miRNA的表达受诸多因素的影响。温度、藻毒素、细菌、农药、重金属、低氧等刺激下,各类相关miRNA的转录水平表达会发生变化,通过转录后的基因调控和蛋白作用帮助鱼类适应逆境。miRNA能对多个靶基因的功能及表达产生影响,其表达水平的改变可以从本质上影响细胞的蛋白质补充。迄今为止,关于miRNA和靶基因作用机制的报道相当有限,且涉及到多个miRNA和靶基因相互作用的报道则更少。因此,在未来的研究应当更加深入地研究miRNA和重要蛋白的表达机制和功能及此过程中多个miRNA及靶基因的相互作用关系。
miRNA在不同的逆境、不同物种中表现出不同的表达模式,也提醒我们其作用机制的复杂性。同时伴随着新的研究技术手段及方法的陆续采用,相信关于鱼类及其他动物逆境适应研究会取得长足发展。
