头孢菌素C的生物合成及其调控
2020-09-22刘钢
刘 钢
(1.中国科学院微生物研究所真菌学国家重点实验室,北京100101; 2.中国科学院大学,北京100049)
二十世纪四十年代Guiseppi Brotzu教授从意大利加利利群岛海水中分离到了一株可以产生抗菌物质-青霉素N的丝状真菌,并命名为顶头孢霉(Cephalosporium acremonium,后被命名为Acremonium chrysogenum)[1].顶头孢霉属半知菌亚门、丛梗孢目、丛梗孢科、头孢霉属,至今未发现其有性阶段[2].后来发现该株菌还能产生结构不同于青霉素的 β-内酰胺类化合物.1961年,Hodgkin等[3]通过X射线确定了该化合物的结构,并命名为头孢菌素C(cephalosporin,CPC),其结构中含有β-内酰胺环与二氢噻嗪环形成的骈环结构.头孢菌素C能够通过影响细胞壁主要成分肽聚糖链的组装和合成,从而干扰细菌细胞壁形成而发挥抗菌作用.由于广谱的抗菌能力及对人、畜相对安全的特性,头孢类抗生素被广泛地应用于细菌性疾病的治疗,成为临床上最重要的抗感染药物[4].头孢菌素C与青霉素同属于β-内酰胺类抗生素,具有相似的抑菌活性.但是与青霉素一样,头孢菌素C也存在抗菌谱窄和容易被青霉素酶降解的弊端.为解决这一问题,人们通过化学催化或酶解法去除头孢菌素C的侧链基团形成中间体7-氨基头孢烷酸(7-ACA),然后利用7-ACA半合成一系列头孢类抗生素[5].
1 头孢菌素C及头孢类抗生素
头孢菌素C结构中含有β-内酰胺环与二氢噻嗪环形成的骈环结构[3].通过化学催化或酶促反应的方式去除CPC的侧链基团,即形成7-氨基头孢烷酸(7-ACA),7-ACA是合成头孢类抗生素的中间体.也可以从青霉素G出发,经过一系列反应最后生成6-氨基青霉烷酸(6-APA).在此基础上,再通过半化学合成和酶法合成一系列头孢类衍生物(图1).到目前为止,第五代头孢类抗生素已经问世[6].
第一代头孢类抗生素多为耐青霉素酶的半广谱抗生素,包括头孢唑啉(先锋霉素V)、头孢拉定、头孢氨苄、头孢羟氨苄和头孢硫脒,主要作用于好氧革兰氏阳性(G+)球菌,对大多数革兰氏阴性(G-)菌产生的β-内酰胺酶的抵抗能力较弱,仅对大肠杆菌(Escherichia coli)、奇异变形球菌(Proteus mirabilis)、流感杆菌(Himophilus influenzae)、伤寒杆菌(Salmonella typhi)和痢疾杆菌(Shigella castellani)表现出抗菌活性.其中,头孢唑啉对G+菌的作用较强,常作为外科手术预防用药.第二代头孢类抗生素包括头孢呋辛、头孢替安、头孢克洛和头孢丙烯等,抗菌谱广,抗β-内酰胺酶水解性能增强,对奈瑟菌(Neisseria)、吲哚阳性变形杆菌、柠檬酸杆菌(Citrobacter)以及肠杆菌(Enterobacteria)具有一定抗菌活性.第三代头孢类抗生素包括头孢曲松、头孢噻肟、头孢他啶、头孢哌酮、头孢克肟和头孢地尼等,具有广谱抑菌活性,其抗G-菌活性进一步增强(如抗菌谱覆盖铜绿假单胞菌等),但对G+菌作用不及第一、二代头孢类抗生素,基本无肾毒性.第四代头孢类抗生素包括头孢吡肟、头孢唑兰、头孢噻利和头孢匹罗,对β-内酰胺酶水解具有高度耐受性,抗菌谱更为广泛,对青霉素结合蛋白具有高度亲和性,抗G+菌活性与头孢曲松相似,抗G-菌活性与头孢他啶相似,但对超广谱β-内酰胺酶(ESBL)稳定性稍差,无肾毒性,对肺炎链球菌(Streptococcus pneumoniae)等具有很强的抑制活性,用于治疗多种细菌的混合感染或多重耐药菌感染引起的疾病.第五代头孢类抗生素包括头孢洛林和头孢吡普,抗菌谱、抗菌活性以及抗β-内酰胺酶水解性能方面都优于前四代产品,抗G+菌活性与头孢曲松相似,抗G-菌活性(包括铜绿假单胞菌)与头孢他啶相似,对耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素金黄色葡萄球菌等超级耐药菌具有抗菌活性,但对超广谱β-内酰胺酶(ESBL)稳定性稍差,无肾毒性.
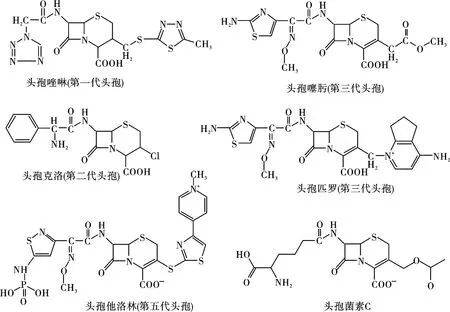
图1 头孢类抗生素的化学结构Fig.1 The structures of cephalosporin C and its derivatives
2 头孢菌素C的生物合成
几十年的研究已基本阐明头孢菌素C生物合成途径中关键基因及其编码产物参与的酶催化反应等内容[7].同大多数来源于微生物的次级代谢产物一样,头孢菌素的生物合成基因成簇存在于顶头孢霉的染色体上.在顶头孢霉C10菌株中,参与头孢菌素生物合成的基因分别存在于VII号和I号染色体上的2个簇中,被称为“早期”基因簇和“晚期”基因簇.“早期”基因簇包括 pcbAB-pcbC和cefD1-cefD2,“晚期”基因簇由cefEF和cefG组成(图2).正是在这些基因编码的产物作用下,将初级代谢产物氨基酸通过有序的缩合和后修饰,最终形成具有生物活性的头孢菌素C.
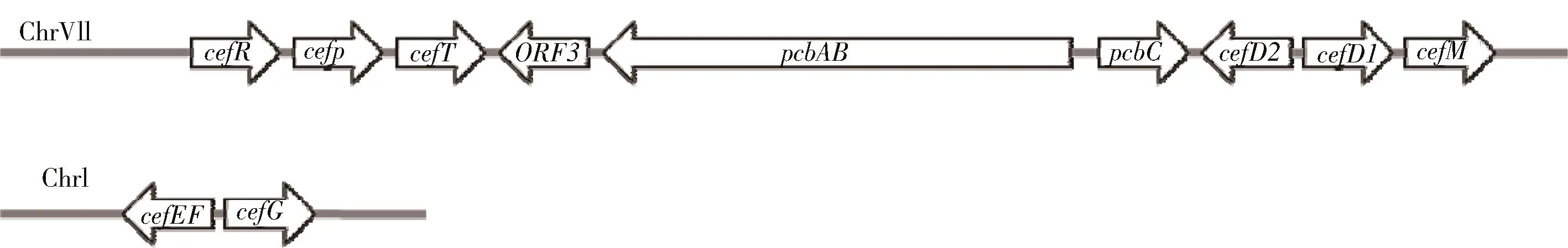
图2 头孢菌素生物合成基因及其分布Fig.2 Organization of the cephalosporin biosynthetic genes
2.1 参与头孢菌素C合成的前体物同青霉素一样,头孢菌素C属于典型的非核糖体肽类化合物,参与其合成的前体包括L-α-氨基己二酸(L-α-AAA)、L-半胱氨酸和L-缬氨酸.L-半胱氨酸和L-缬氨酸都是参与蛋白质合成的氨基酸,而L-α-AAA则是合成L-赖氨酸的中间代谢产物.
不同于细菌,真菌中的L-α-AAA是由α-酮戊二酸与乙酰辅酶A缩合,并经过高柠檬酸-同型乌头酸-高异柠檬酸-酮己二酸途径形成,是形成L-赖氨酸的中间代谢产物.研究表明,顶头孢霉细胞内L-α-AAA的浓度与头孢菌素C的产量直接相关.然而,培养基中添加高浓度的L-赖氨酸却抑制了头孢菌素C的产生,推测高浓度的L-赖氨酸反馈抑制了高柠檬酸合成酶(Homocitrate Synthase)的形成,从而抑制 L-α-AAA的合成[8].此外,L-α -AAA 在还原酶作用下,经过a-氨基己二酸半醛-酵母氨酸途径,最终形成L-赖氨酸.由lys2基因编码的L-α-AAA还原酶活性依赖于NADPH的存在.在发酵过程中,当菌体处于生长期时,L-α-AAA还原酶的活性最高,而当头孢菌素C开始产生时,L-α-AAA还原酶的活性大幅降低.另外,在头孢菌素C高产菌株中,L-α-AAA还原酶的活性较低,推测当L-α-AAA还原酶的活性降低时,会积累更多的L-α-AAA,从而使得头孢菌素C产量升高.
参与头孢菌素合成的另外一个主要前体物是L-半胱氨酸,发酵过程中L-半胱氨酸的产生也是头孢菌素合成的一个主要限速步骤.研究发现在顶头孢霉中存在4种L-半胱氨酸的合成途径,分别是无机硫酸盐的同化途径、由O-乙酰-L-丝氨酸直接合成途径,通过转硫途径形成O-乙酰同型丝氨酸进而合成L-半胱氨酸途径,以及反转硫途径中通过甲硫氨酸来形成L-半胱氨酸的合成途径[9-10].研究表明,包括顶头孢霉在内的一些丝状真菌会优先利用来自于反转硫途径中合成的L-半胱氨酸,而不是直接利用来自于无机硫酸盐的L-半胱氨酸[11].
L-缬氨酸也是头孢菌素合成中的一个重要组成部分,它与亮氨酸和异亮氨酸一起统称为支链氨基酸.L-缬氨酸由丙酮酸经4步反应催化而来.在顶头孢霉中,高浓度的L-缬氨酸会反馈抑制参与L-缬氨酸合成过程第一步反应的乙酰羟酸合酶(Acetohydroxy acid synthase)活性,从而导致细胞内L-缬氨酸的含量降低[12].
2.2 头孢菌素C的生物合成途径头孢菌素是典型的非核糖体肽类化合物,研究证明头孢菌素C的生物合成途径共存在5步酶促反应[7]:1)L-α-AAA和L-半胱氨酸在pcbAB编码的ACV合酶(ACVS)催化下,缩合为L-α-AAA-L-半胱氨酸(AC),L-缬氨酸被异构化为D-缬氨酸后与上述二肽缩合形成δ-(L-α-氨基己二酰)-(L-半胱氨酰)-D-缬氨酸(简称ACV).相对于其它结构基因,pcbAB基因的转录水平较低,因此该步反应是头孢菌素C生物合成过程中的限速步骤.2)三肽ACV在pcbC编码的异青霉素N合酶(IPNS)催化下依次形成β-内酰胺环和五元噻唑环,最终生成异青霉素N(IPN),该反应效率明显受到Fe2+和还原剂(如抗坏血酸和DTT等)的促进.虽然IPNS并不具有严格的底物特异性,但对ACV以外的底物催化效率极低.3)在cefD1和cefD2编码的乙酰辅酶A合酶和乙酰辅酶A消旋酶的作用下,IPN被催化生成青霉素N(PenN).4)cefEF编码的脱乙酰氧基头孢菌素合酶(DAOC-synthetase)和脱乙酰基头孢菌素合酶(DAC-synthetase)参与了形成六元噻嗪环的扩环反应和C3位的羟基化和氧化反应,负责将 PenN催化为脱乙酰头孢菌素C(DAC).该步反应依赖于 Fe2+、氧原子、α - 酮戊二酸以及抗坏血酸等的存在.5)最后,DAC在cefG编码的脱乙酰头孢菌素C酰基转移酶(DAC-acyltransferase)的作用下加入乙酰基生成头孢菌素C(图3).

图3 头孢菌素C的生物合成Fig.3 The biosynthesis of cephalosporin C
2.3 头孢菌素C及其中间代谢产物的转运催化头孢菌素生物合成的酶,在细胞内有各自的定位,如ACV合酶与IPN合酶定位于细胞质,而乙酰辅酶A合酶和乙酰辅酶A消旋酶(CefD1和CefD2)则定位于过氧化物酶体[13].暗示头孢菌素生物合成过程发生在不同的细胞区间,可能存在代谢物以及代谢中间产物的多次跨膜运输.近期研究发现在“早期”基因簇pcbAB基因的下游存在一个转运蛋白编码基因cefP,cefP基因编码的产物具有11个跨膜区,推测此蛋白主要参与了IPN向过氧化物酶体的转运过程.敲除cefP后完全阻断了头孢菌素C的产生,同时积累了大量的 IPN[14].在 cefD1基因下游存在另外一个转运蛋白编码基因cefM,其编码的蛋白含有12个跨膜区,可能参与了PenN从过氧化物酶体转运至胞质的过程.有研究表明,在顶头孢霉中敲除cefM后,细胞内积累了大量的PenN,同时,头孢菌素 C 的产量大幅降低[15].另外,在“早期”基因簇中pcbAB基因的下游存在另一个转运蛋白编码基因cefT,该基因编码一个定位于细胞膜上的MFS家族转运蛋白,可能负责IPN、PenN和DAC向细胞外的转运.研究发现,cefT基因的拷贝数与头孢菌素C的产量呈正相关性,增加cefT的拷贝数后,头孢菌素C的产量得到显著提高[16].
3 头孢菌素C生物合成的调控
为了提高头孢菌素C的产量,促进其工业化生产,头孢菌素C生物合成的调控及其分子基础研究受到了广泛的关注[7,12].研究表明,碳氮源、氨基酸、磷酸盐、氧及其它一些调控因子对头孢菌素C的生物合成有着显著的影响[4].此外,头孢菌素C的产生还与形态分化有着密切的联系[17].
3.1 碳源对头孢菌素生物合成的调控碳源是影响顶头孢霉中头孢菌素C合成的重要因素之一.当发酵培养基中葡萄糖的含量达到6.3%时,头孢菌素C的产量就会显著下降[18].在顶头孢霉野生型菌株(ATCC 14553)和工业生产菌株(A3/2)中添加葡萄糖等速效碳源,可以强烈抑制基因pcbC和cefEF的转录,从而导致头孢菌素C的产量降低近5倍.虽然葡萄糖对纯化的异青霉素N合成酶没有抑制作用,但其代谢过程中产生的3-磷酸甘油醛则对 ACV合成酶具有抑制效应[19].在顶头孢霉中,速效利用碳源虽然有利于丝状真菌生长,但对头孢菌素C的合成却具有明显的抑制效应,而缓速利用碳源则有利于头孢菌素C的产生.按照有利于头孢菌素C产生的碳源排序,依次是蔗糖、半乳糖、果糖、麦芽糖和葡萄糖.因此,在化学合成培养基中,往往添加27 g/L的葡萄糖以供真菌生长,添加36 g/L的蔗糖用于头孢菌素C产生.研究表明,速效利用碳源不仅对抗生素合成酶具有抑制作用,同时还会引起这些合成酶的降解,此外,速效利用碳源明显不利于参与由PenN到头孢菌素C合成过程关键基因的表达.在葡萄糖等速效利用碳源存在的情况下,pcbC和cefEF基因的转录明显受到抑制[20].进一步的研究结果显示顶头孢霉中存在一种葡萄糖依赖型的抑制蛋白CRE1,由基因cre1编码.CRE1是酵母中MIG1的同源蛋白,同时也是一个自调控的转录因子.CRE1可以有效地结合在基因pcbC和 cefEF的启动子区,从而抑制他们的转录[21].
3.2 氮源对头孢菌素生物合成的调控在顶头孢霉发酵过程中,当氨盐(NH4)2SO4大于100 mM时,头孢菌素C的产生明显受到抑制,而添加L-天冬酰胺和L-精氨酸作为氮源则有利于头孢菌素C的产生[22].最近我们课题组的研究表明至少有2个转录因子(AcAREA和AcAREB)参与了顶头孢霉中氮源对头孢菌素生物合成的调控[23-24].AcareA基因编码一个由960个氨基酸组成的含有Cys2/Cys2锌指结构域的蛋白,该基因的缺失导致顶头孢霉无法利用和尿酸,并且在含有低浓度的NH4+、谷氨酰胺和尿素的培养基上表现出生长缺陷,同时发酵过程中头孢菌素C产量明显下降.研究表明在以为唯一氮源的培养基中,AcAREA通过分别结合硝酸还原酶基因niaD和亚硝酸还原酶基因niiA的启动子区域来激活它们的转录.进一步研究揭示,AcAREA是通过直接调节pcbAB的转录并间接影响cefD2、cefEF和cefG的转录来调控头孢菌素C的生物合成.AcareB编码一个具有GATA锌指结构域的转录因子,与野生型相比,AcareB突变株中头孢菌素生物合成基因转录量显著下降,头孢菌素C产量明显降低.凝胶阻滞实验显示AcAREB能够结合到pcbAB-pcbC、cefD1-cefD2和cefEF-cefG的双向启动子区,从而调控这些基因的转录.此外,AcareA能够正调节AcareB的转录,AcAREA和AcAREB竞争性结合pcbAB-pcbC的启动子区.这些结果暗示AcAREA和AcAREB存在相互作用,他们在顶头孢霉中协同调控头孢菌素C的产生.
3.3 甲硫氨酸对头孢菌素生物合成的调控在工业生产中,甲硫氨酸一直作为头孢菌素C产生的促进剂而被广泛使用[25].除了添加 L-型甲硫氨酸外,D-型或者DL-型甲硫氨酸的添加也可以刺激头孢菌素C的生成,其中DL-型的甲硫氨酸效果最好.甲硫氨酸的添加也可以促进PenN的产生.对PenN或者头孢菌素C来说,甲硫氨酸虽然不是其前体物,但却可以为其生物合成提供有效的硫原子[26].然而,后来发现添加甲硫氨酸的非硫同系物正亮氨酸时,也可以促进头孢菌素C的合成,所以推测甲硫氨酸并不是通过提供硫原子促进头孢菌素C的合成[27].此外,只有在顶头孢霉快速生长期添加甲硫氨酸时,才会促进头孢菌素C的合成,此时顶头孢霉自身内源性的甲硫氨酸浓度也会瞬时增加2~3倍,说明内源性的甲硫氨酸或者大量的外源性的甲硫氨酸对头孢菌素C的生物合成起到了的一定的调控作用[9].进一步研究发现,甲硫氨酸可以影响包括ACVS、环化酶和扩环酶的表达,在添加甲硫氨酸时,参与头孢菌素合成相关基因pcb-AB、pcbC和cefEF的转录量明显提高[28],说明甲硫氨酸可以通过促进合成基因的表达来提高头孢菌素C的产量.
早期的研究发现,反转硫途径中胱硫醚-γ-裂解酶负责胱硫醚转化为半胱氨酸,推测顶头孢霉依赖于该途径为头孢菌素C的合成提供其前体物半胱氨酸[29].在体内,高表达胱硫醚-γ-裂解酶的编码基因mecB促使头孢菌素C产量增加10%~40%[30].在含甲硫氨酸的培养基中,mecB的敲除并没有显著影响参与头孢菌素C合成相关基因的转录,而在不含甲硫氨酸的培养基中,菌体均能正常生长且头孢菌素C产量不下降[31],说明在顶头孢霉中甲硫氨酸不是通过胱硫醚-γ-裂解酶来调控头孢菌素C的生成.最近我们课题组研究发现,顶头孢霉中甲硫氨酸是通过形成腺苷甲硫氨酸(SAM)促进头孢菌素C的合成.通过对顶头孢霉甲硫氨酸代谢途径的定向改造,包括高表达腺苷甲硫氨酸合成酶编码基因AcsamS及胱硫醚-γ-裂解酶编码基因mecB,筛选并敲除腺苷甲硫氨酸依赖的甲基转移酶编码基因Acppm1,首次构建了不依赖甲硫氨酸却能促进头孢菌素C产量的基因工程菌株[32].
3.4 细胞自噬对头孢菌素生物合成的调控自噬是真核生物中依赖于溶酶体或者液泡的一种降解途径,主要参与降解细胞内冗余或者异常的蛋白以及细胞器等,帮助细胞维持正常的生理功能[33].在自然状态及工业发酵中,当真菌持续面临营养匮乏时,很可能是通过发生自噬来促进细胞的继续生长及分化[34].近年来,我们课题组对顶头孢霉中部分自噬相关基因的功能进行了初步研究.Acatg1编码丝氨酸苏氨酸蛋白激酶,参与顶头孢霉自噬的诱导.Acatg1基因敲除突变株表现出生长减弱,但头孢菌素C的产量明显增加,进而发现在该突变株中异青霉素N合酶(IPNS)积累,推测阻断自噬导致该蛋白降解减弱,从而增强了头孢菌素C的合成[35].Acatg8编码自噬核心蛋白,Acatg8的缺失也显著促进了顶头孢霉中头孢菌素C的产生,但是该基因缺失同时也导致发酵后期菌体死亡加快.将受木糖诱导启动子调控的Acatg8导入突变株中后,获得了基因工程菌株.在木糖存在的条件下,该菌株中Acatg8基因能够正常表达,菌体死亡减缓,而头孢菌素C产量显著高于野生株[36].Acatg12的缺失使头孢菌素C的产量增加了3倍,但发酵后期菌体死亡率并没有显著增加[37].并不是所有的自噬相关基因的缺失都会促进头孢菌素C的产生.Acatg11的缺失并没有增加头孢菌素C的产量,相反还略为下降[38].可以看出,不同的自噬相关基因对头孢菌素C产生的影响存在很大差异,具体的机制仍需要深入研究.
3.5 头孢菌素生物合成过程中的转录调控转录水平的调控主要是通过转录因子与生物合成基因启动子区结合来促进或抑制该基因转录.转录因子分为全局性调控因子(如 PacC、NRE、AnCF、LaeA、VeA等)和途径特异性调控因子.PacC是一种pH依赖性的锌指蛋白,正调控头孢菌素C的合成.在碱性条件下,PacC由蛋白酶去除其N端结构域后由闭合状态变成开放状态,从而被激活,进入细胞核后PacC与pcbAB-pcbC间启动子区结合,促进pcbAB和 pcbC的转录[39].LaeA与多效调控因子VeA及VeB形成复合物,共同协调光照刺激来调控头孢菌素C的产生以及菌丝分化过程.顶头孢霉多效调控因子AcVeA能调控头孢菌素C生物合成基因(pcbAB、pcbC、cefD1、cefD2、cefEF 与cefG)的转录水平,敲除 AcveA导致头孢菌素 C产量大幅度降低[40].
CPCR1(Cephalosporin C Regulator 1)是顶头孢霉的转录激活因子,能结合在pcbC启动子区[41].Schmitt等[42]随后通过酵母双杂交策略鉴定得到一个能够与CPCR1互作的蛋白—AcFKH1.AcFKH1含有2个保守结构域,分别为负责蛋白磷酸化的N端FHA结构域(forkhead-associated domain)以及与DNA结合 的C端的FKH结构域.AcFKH1对CPCR1发挥功能是必需的,同时AcFKH1还能够与pcbAB-pcbC启动子区结合.此外,研究发现CPCR1参与调控顶头孢霉的菌丝生长和节孢子的形成[17].CPCR1与 PACC或 CRE1蛋白是否存在相互作用,目前还缺少研究.
头孢菌素生物合成基因簇中存在一个调控基因cefR,位于cefP基因的上游.cefR编码的蛋白通过作用于cefT的启动子区来调控CPC的产生,当敲除cefR基因后,cefEF的转录明显延迟,头孢菌素C的产量明显减少,而积累了大量的PenN[43].
目前对头孢菌素生物合成的分子调控机制还缺乏深入系统的了解.相信头孢菌素的生物合成受控于一个复杂的调控网络,利用现代的组学分析技术和遗传操作等手段将全面揭示这一调控网络,并对顶头孢霉的定向遗传改造和促进头孢菌素的工业化生产具有重要意义.
4 顶头孢霉的形态分化与头孢菌素产生
顶头孢霉能够产生两种形态的无性孢子,分别是分生孢子和节孢子[44].在合适的培养条件下,顶头孢霉的分生孢子或节孢子在固体培养基上开始萌发,通过极性生长形成管状的营养菌丝.营养菌丝生长到一定阶段,受到外界信号或胞内信号(如营养胁迫等)刺激,部分营养菌丝特化为足细胞,进而由足细胞长出分生孢子柄,分生孢子柄末端膨大形成分生孢子囊并产生分生孢子.当分生孢子囊破裂时,释放出其中的分生孢子,并进入到下一个生命周期(图4).在液体发酵培养基中,当营养菌丝生长到一定阶段时,菌丝膨大,形成节孢子(成串的酵母状细胞),节孢子断裂,并进入到下一个生命周期.可见顶头孢霉分生孢子的形成源于菌丝末端分化,而节孢子是在液体发酵过程中形成的一种菌丝膨大形态.顶头孢霉在形态分化的同时产生头孢菌素C.当顶头孢霉生长到稳定期或在发酵培养基中添加甲硫氨酸(头孢菌素C产生的促进剂),都会促进顶头孢霉产生大量的节孢子,随之头孢菌素C开始大量合成.暗示顶头孢霉的形态分化与头孢菌素C的合成具有紧密的联系.因此,在头孢菌素的工业化生产中,人们往往通过顶头孢霉的形态变化(产生节孢子的数量)来判断发酵的成功与否[25].然而,迄今为止鲜有顶头孢霉形态分化的报道,更缺乏从分子水平对顶头孢霉形态分化与头孢菌素C产生之间内在关系的研究.

图4 顶头孢霉的生长及形态分化Fig.4 The growth and morphological differentiation of A.chrysogenum
为阐明顶头孢霉形态分化的调控机制,尤其是形态分化与头孢菌素产生之间的内在关系,我们课题组建立和完善了农杆菌介导的顶头孢霉的遗传操作体系,并对预测的参与形态分化关键基因开展了研究.发现敲除参与顶头孢霉细胞分隔及节孢子形成的AcsepH基因,导致cefEF、cefD1和cefD2以及控制节孢子形成的cpcR1基因转录水平显著降低[45].敲除参与顶头孢霉硫氧还蛋白还原酶基因ActrxR1不仅显著增加了产孢能力,而且增强了pcbC、cefEF和cefG的转录水平,使头孢菌素C的合成提高了近一倍[46].敲除AcstuA基因不仅阻断了顶头孢霉分生孢子的产生,也使突变株丧失了产生头孢菌素C的能力[47].AcmybA基因缺失会明显促进分生孢子和节孢子的形成,同时头孢菌素的产量也会明显增加.反之,过表达AcmybA则抑制分生孢子和节孢子的形成,头孢菌素C几乎不再产生.分析发现AcmybA的过表达会抑制顶头孢霉形态分化关键基因AcbrlA的转录,在AcmybA过表达菌株中,组成型表达AcbrlA能够使分生孢子和节孢子的形成恢复,但头孢菌素C依然不能够产生[48].
5 头孢菌素生产菌株的理性改造
发酵条件及参数(如氨基酸、碳氮源、磷酸盐、溶氧及搅拌速度等)能影响青霉素和头孢菌素C的产生,通过比较诱变育种形成的高产菌株与野生型出发菌株,在揭示抗生素高产机制的同时,也为育种和改良提供了理论基础.早期头孢菌素C高产菌株主要通过物理或化学诱变(如UV、亚硝基胍、X射线或γ射线等)的方式筛选获得.从早期的诱变育种到近年来分子遗传学手段的引入,使头孢菌素C的产量得到了大幅提升.然而,传统诱变技术缺乏明确的靶点,需要大量的筛选工作,已经不能够满足工业化发酵对菌种改造的需要.随着分子生物学技术的发展,以基因工程为代表的菌种改造策略成功应用于头孢菌素生产菌株的育种.不论是结构基因倍增还是代谢途径的定向遗传改造,都成功实现了抗生素增产[49].
在青霉素高产菌株中,生物合成基因簇的倍增被认为是产量提高的一个重要原因[50].而在头孢菌素C产生菌中,迄今还没有发现存在基因簇倍增的现象,很可能是由于头孢菌素的生物合成基因分别位于不同染色体的2个基因簇上.通过比较发现,在高产菌株中参与头孢菌素生物合成基因的转录水平都显著提高了,同时参与前体氨基酸合成的关键酶对氨基酸反馈抑制敏感度降低.进而发现通过传统诱变获得的高产菌株从头孢菌素生物合成及其相关的初级代谢都发生了明显改变[51].
在产黄青霉或构巢曲霉中增加pcbAB的表达,能够显著增加青霉素的产量[52].pcbAB编码的ACV合酶(ACVS)负责头孢菌素合成的第一步反应,也是决定头孢菌素C产量的关键.然而,由于遗传操作困难,在顶头孢霉中还没有通过定向改造pcbAB来增加头孢菌素C产量的报道.由cefG编码的酰基转移酶是头孢菌素合成中的另一个限速酶.在顶头孢霉中通过引入额外的cefG基因来增加其表达水平能够显著提升头孢菌素C的产量[53].增加一个拷贝的cefEF-cefG,生产菌株在150 L发酵罐中头孢菌素C的产量提高15% ~40%.利用来自构巢曲霉的gpd基因启动子、产黄青霉gdh基因启动子或pcbC基因的启动子重建cefG的表达,都使DAC乙酰转移酶活性明显提高[54].此外,在顶头孢霉中过表达头孢菌素生物合成基因簇中的膜转运蛋白基因cefT和cefP也能显著促进头孢菌素C产量的提高[14,16].
真菌细胞内氧化-还原状态以及活性氧(ROS)水平也能影响真菌的形态分化,进而影响次级代谢产物产生.顶头孢霉glrA基因 (编码谷胱甘肽还原酶)控制了菌体内还原性/氧化型谷胱甘肽(GSH/GSSG)氧化还原平衡,该基因破坏后显著影响孢子萌发和菌丝生长,但通过外源补加甲硫氨酸能恢复表型[55];而对硫氧还蛋白还原酶基因trxR1的研究则表明该基因阻断后能有效提高头孢菌素C 产生[46].
头孢菌素C的合成是一个极其耗氧的过程,而随着菌丝的生长,发酵液逐渐变稠,不利于氧气传递.透明颤菌血红蛋白(VHb)能够促进微生物细胞在低氧状态的生长以及蛋白合成.根据这一原则,当将来源于透明颤菌的VHb编码基因vgb转入顶头孢霉后发现,转化子能有效改善发酵后期菌丝氧利用速率,对头孢菌素C产生的促进作用也相当明显,在低氧情况下头孢菌素 C的产量提高了5 倍[56].
6 结束语与展望
近年来顶头孢霉全基因组序列的完成,以及生产菌株转录组和蛋白质组工作的完成,极大地促进了人们对头孢菌素生物合成及其调控的了解[51,57-59].通过转录组分析头孢菌素高产菌株和低产菌株之间的差别,可以清楚看到参与甘油酯代谢、氨基酸代谢、半乳糖代谢、丙酮酸代谢、苹果酸代谢以及嘧啶代谢等初级代谢通路的基因发生了显著变化,在高产菌株中这些变化更有利于头孢菌素C的合成.通过提升细胞内L-α-AAA、L-半胱氨酸和L-缬氨酸的含量能够显著增加头孢菌素C的产量.头孢菌素的合成不仅与前体物有关,还与细胞内的能量和还原力(NADPH)的产生直接相关.
由于头孢菌素C活性较低,并不能直接用于临床.头孢菌素C作为原料需要通过化学转化或者酶法转化为中间体7-氨基头孢烷酸(7-ACA),再由7-ACA半合成一系列头孢类抗生素[60].通过化学的脱乙酰化处理形成7-ACA,需要苛刻的反应条件,并产生有毒物质.目前主要通过二步酶法获得7-ACA.然而,不管是二步酶法还是一步酶法,对催化工艺都有很高的要求,同时,产物还需要进一步纯化处理.因此,构建能够直接发酵产生7-ACA的基因工程菌株成为该领域的研究热点.目前获得的直接产生7-ACA菌株在产量上还达不到工业化水平,合成生物学技术的出现为重构顶头孢霉的代谢途径、提高7-ACA的产量提供了技术支撑,相信通过直接发酵,工业化生产7-ACA很快会成为现实.
虽然有了组学的一些研究,但对头孢菌素生物合成及其调控机制仍然缺乏深入和系统的了解.同时由于缺乏有性世代,顶头孢霉的遗传操作相对困难(依赖于同源重组的传统基因敲除效率不足5%),导致靶向重构代谢途径和理性改造头孢菌素生产菌株依然困难重重.近期,华东理工大学储炬教授课题组基于CRISPR/Cas9技术在顶头孢霉野生株中实现了基因的高效敲除[61].我们课题组通过串联U6启动子和tRNA对该技术进行了优化,在头孢菌素高产菌株中实现了单基因的高效编辑、双基因的一步敲除和大片段DNA的靶向敲除[62].这些技术的进步必将进一步推动对头孢菌素生物合成及其调控机制的理解和工业化菌种的理性改造,从而推动头孢菌素工业化生产的升级换代.
