蛋白质精氨酸甲基转移酶5促进人卵巢癌HO8910细胞迁移
2020-09-22赵康容孙爱琴林琼邵根宝
赵康容,孙爱琴,林琼,邵根宝
(江苏大学医学院,江苏 镇江 212013)
卵巢癌是女性生殖系统三大恶性肿瘤之一,其死亡率居妇科恶性肿瘤之首[1],尽管早期诊断可以提高生存率,但仅有约15%患者能在早期获得诊断[2],绝大部分患者就诊时就已经处于晚期阶段。蛋白质精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)能够特异性催化组蛋白及非组蛋白等底物的对称性甲基化[3],从而影响多个靶基因及多条信号通路,发挥众多生物学功能[4-5]。研究表明,PRMT5在多种恶性肿瘤如淋巴瘤[6]、胶质瘤[7]、乳腺癌[8]和白血病[9]等中呈高表达,且其高表达与肿瘤恶化及患者预后相关。我们前期研究发现,上调PRMT5表达可以促进卵巢癌细胞生长和增殖[10]。然而,PRMT5对卵巢癌细胞功能影响的具体机制仍不清楚。因此,本研究旨在探讨PRMT5表达与卵巢癌细胞上皮间质转化(epithelial-to-mesenchymal transition,EMT)之间的关系及其可能机制。
1 材料和方法
1.1 材料
1.1.1 细胞 人卵巢癌HO8910细胞株为本实验室长期保存;多西环素(doxycycline,Dox)诱导型稳定敲低PRMT5的HO8910细胞株用pLKO-Tet-puro慢病毒诱导型载体构建,构建方法参考文献[11]。
1.1.2 主要试剂和仪器 骨架载体pLKO-Tet-On、pHR-CMV-8.2ΔVPR、pHR-CMV-VSVG以及pLKO-Tet-On-SC、pLKO-Tet-On-PRMT5、pCMV-Myc、pCMV- Myc-PRMT5质粒由美国普渡大学胡长灯教授惠赠。兔抗人PRMT5多克隆抗体,兔抗人α-微管蛋白单克隆抗体和HRP标记的羊抗兔IgG抗体购自美国 Bioworld 公司;基质金属蛋白酶2(matrix metalloproteinase-2,MMP2)、波形蛋白、N-钙黏蛋白和E-钙黏蛋白抗体购自美国Cell Signaling Technology 公司;聚凝胺、Dox和嘌呤霉素(美国 Sigma-Aldrich公司);Lipofectamine 2000试剂(美国 Invitrogen公司);荧光定量PCR试剂盒,RNA提取试剂盒和逆转录试剂盒(日本 TaKaRa 公司);PVDF膜和ECL显影试剂(美国Millipore公司)。
核酸测定仪Biomate 3s(美国Thermo Scientific公司);Mx3000p Real Time PCR扩增仪(美国Stratagene公司);Alpha化学发光凝胶成像系统Fluor Chem FC3(美国Protein Simple公司);倒置显微镜BX51(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养 H08910细胞株培养于含10%新生胎牛血清、1%青霉素和1%链霉素混合液的DMEM中,37 ℃、5%CO2培养,常规传代。
1.2.2 PRMT5 shRNA干扰质粒构建 pLKO-PRMT5-shRNA质粒和对照质粒pLKO-Tet-On-SC的构建参照文献[12]。PRMT5-shRNA引物序列:上游5′-GCCCAGTTTGAGATGCCTTAT-3′,下游5′-CCCATCCTCTTCCCTATTAAG-3′。
1.2.3 HO8910细胞株中敲低PRMT5的效率验证 实验分为pLKO对照组(感染空载体慢病毒)、pLKO+Dox(100 ng/mL)组、shPRMT5组(感染PRMT5 shRNA 慢病毒)和shPRMT5+Dox(100 ng/mL)组;将处于对数生长期的HO8910细胞接种于6 cm培养皿,孵育12~24 h;换液加入3 mL DMEM和1 mL病毒液(2.0 μg pLKO-Tet-On-SC、2.0 μg pLKO-Tet-On-PRMT5),混匀后加入8 μg/mL 聚凝胺感染细胞,孵育24 h;再重复上述步骤1次;用2.0 μg/mL 嘌呤霉素筛选72 h;再用含1.0 μg/mL嘌呤霉素培养基维持培养,直至筛选出稳定感染PRMT5- shRNA的HO8910细胞株(shPRMT5);最后,用终质量浓度为100 ng/mL Dox诱导培养48 h;用实时荧光定量PCR (qRT-PCR)和免疫印迹法分别检测PRMT5 mRNA和蛋白表达水平。
1.2.4 HO8910细胞株中PRMT5过表达的效率验证 将处于对数生长期的HO8910细胞分为空白对照组(野生型HO8910细胞株)、阴性对照组(转染pCMV-Myc质粒)、实验组(转染pCMV-Myc-PRMT5质粒),接种于6 cm培养皿,孵育12 h;将2.0 μg pCMV-Myc-vector(对照)和2.0 μg pCMV-Myc-PRMT5质粒用Lipofectamine2000转染HO8910细胞48 h;免疫印迹法用Myc检测各组Myc-PRMT5表达,qRT-PCR检测各组细胞PRMT5mRNA表达水平。
1.2.5 qRT-PCR法检测PRMT5 mRNA表达 取“1.2.3”和“1.2.4”分组细胞,按照RNA提取试剂盒操作手册提取细胞总RNA,并用紫外分光光度法测定RNA纯度和浓度。采用逆转录试剂盒将RNA逆转录为cDNA,以cDNA为模板,采用荧光定量试剂盒进一步行PCR扩增。PRMT5基因(NM_001282953.1)引物序列:上游5′-GTTTGAAGAATGGGGAAGCCAAGTG-3′,下游5′-GAGCCAGAAAGGAAGTGTACTCC-3′;以GAPDH基因(NM 001256799.1)为内参照,引物序列:上游5′-GCAAATTCCATGGCACCGTC-3′,下游5′-TCGCCCCACTTGATTTTGG-3′。基因的相对表达量用2-ΔΔCt值表示。实验重复3次。
1.2.6 免疫印迹法检测PRMT5和EMT相关蛋白表达 收集稳定敲低和顺时转染过表达PRMT5的HO8910细胞,实验分为shPRMT5+Dox组(诱导感染PRMT5 shRNA 慢病毒)、shPRMT5组(未诱感染PRMT shRNA慢病毒)、PCMV-Myc组(未过表达PRMT5)和pCMV-Myc-PRMT5组(过表达PRMT5的HO8910细胞株),用预冷PBS 洗2次;加入 200 μL含蛋白酶抑制剂和磷酸酶抑制剂的裂解液,置于冰上处理 20 min;以12 000 r/min,4 ℃离心15 min;取上清液即为总蛋白。各取50 ng总蛋白用分离胶浓度为8%~12%的SDS-PAGE分离蛋白(80 V电压30 min,110 V电压100 min);转移至PVDF膜,300 mA恒流120~150 min;用含5%脱脂奶粉的TBST室温封闭1 h;加入对应一抗E-钙黏蛋白、波形蛋白、N-钙黏蛋白和MMP2,均1∶500,α-微管蛋白单克隆抗体(1 ∶5 000),4℃孵育过夜;次日,二抗(1 ∶5 000)室温孵育1 h;经ECL显影,用Image J软件定量。实验重复3次。
1.2.7 Transwell实验检测细胞迁移能力 按照参考文献[13],实验分组同“1.2.6”,将细胞制备成不含血清的细胞悬液,每个Transwell小室上室接种1.5×105个HO8910细胞,下室加入500 μL含血清的DMEM,在37 ℃、5% CO2培养箱中孵育24 h;用棉签擦拭膜上表面未迁移的细胞,迁移至下表面的细胞用4%多聚甲醛固定30 min;结晶紫染色液室温染色15 min;显微镜观察染色细胞。每个Transwell小室随机取5个视野,计数染色细胞,相对迁移率=转移细胞数/Transwell小室总细胞数。实验重复3次。
1.3 统计学分析

2 结果
2.1 诱导型稳定敲低PRMT5的HO8910细胞株的效率验证
免疫印迹结果显示,与shPRMT5对照组比较,shPRMT5+Dox组HO8910细胞中PRMT5蛋白表达显著减少(t=4.927,P<0.05);pLKO+Dox组PRMT5蛋白表达水平与pLKO对照组比较差异无统计学意义(t=1.208,P>0.05)。qRT-PCR结果同样显示,shPRMT5+Dox组PRMT5 mRNA表达较pLKO对照组、pLKO+Dox组、shPRMT5组显著减少(t=8.71,7.861,8.131,P均<0.01)。见图1。
2.2 PRMT5过表达效率验证
免疫印迹结果显示,空白对照组和阴性对照组均无标签蛋白Myc表达,而实验组检测到Myc表达。qRT-PCR结果显示,实验组PRMT5 mRNA表达水平显著高于空白对照组和阴性对照组(t=39.547,37.813,P均<0.01)。见图2。
2.3 PRMT5对卵巢癌HO8910细胞迁移的影响
Transwell结果显示,与shPRM5对照组比较,shPRMT5+Dox实验组中卵巢癌HO8910细胞迁移率显著减少(t=4.157,P<0.05);pCMV-Myc-PRMT5组中HO8910细胞迁移率显著高于pCMV-Myc组(t=3.261,P<0.05)。见图3。

图1 免疫印迹和qRT-PCR验证HO8910细胞中PRMT5基因敲低的效率

图2 免疫印迹和qRT-PCR验证HO8910细胞中PRMT5基因过表达效率
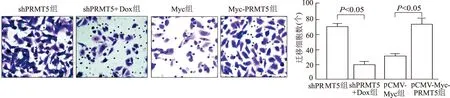
图3 Transwell实验检测PRMT5过表达或敲低后细胞的迁移能力(结晶紫染色×200)
2.4 PRMT5敲低后EMT相关蛋白的表达
免疫印迹结果显示,与shPRMT5组相比,shPRMT5+Dox组HO8910细胞中PRMT5表达和间质标志分子MMP-2、波形蛋白和N-钙黏蛋白表达显著降低(P<0.01或<0.05),而上皮标志分子E-钙黏蛋白表达显著增加(t=17.527,P<0.01)。见图4。

1:shPRMT5组,2:shPRMT5+Dox组;a:P<0.05,b:P<0.01,与shPRMT5组比较
2.5 PRMT5过表达后EMT相关蛋白的表达
免疫印迹结果显示,与pCMV-Myc组相比,pCMV-Myc-PRMT5组HO8910细胞中Myc表达、MMP-2、波形蛋白和N-钙黏蛋白表达显著升高(P<0.01或<0.05),而E-钙黏蛋白表达显著降低(t=18.306,P<0.05)。见图5。

1:pCMV-Myc组;2:pCMV-Myc-PRMT5组;a:P<0.05,b:P<0.01,与pCMV-Myc组比较
3 讨论
EMT是上皮细胞转化为间质细胞的过程,它赋予细胞转移和入侵的能力,与肿瘤的发生发展进程相关[14]。EMT表现为细胞黏附能力丧失,E-钙黏蛋白表达下降,间质标志物和纤维连接蛋白表达上升,细胞运动能力和侵袭能力增强。研究报道[15],PRMT5协同MEP50/WDR77复合物通过表观遗传调控作用诱导EMT进程,从而促进肺癌细胞侵袭和迁移。本研究采用卵巢癌HO8910细胞株,通过免疫印迹法和Transwell小室实验证实PRMT5促进卵巢癌细胞EMT进程,并增强细胞迁移能力。
细胞增殖与肿瘤发生发展密切相关,本课题组前期发现[10],PRMT5对卵巢癌细胞的增殖有重要的调控作用,下调PRMT5可抑制HO8910细胞克隆形成,减低细胞DNA复制能力,并抑制细胞增殖;过表达PRMT5则相反,提示PRMT5可能作为一个潜在的致癌基因促进卵巢癌的发生发展。本研究发现下调PRMT5表达可以抑制卵巢癌HO8910细胞迁移,而过表达PRMT5则促进细胞迁移。
E-钙黏蛋白表达缺失或降低与肿瘤转移密切相关,在小鼠模型中证实E-钙黏蛋白缺失显著增强癌细胞侵入健康组织的能力[16]。本研究发现,敲低PRMT5可以促进上皮标志分子E-钙黏蛋白表达,而PRMT5过表达则反之,由此表明PRMT5与细胞迁移密切相关。此外,外源表达PRMT5后,间质标志分子MMP-2、波形蛋白和N-钙黏蛋白表达上调,并促进HO8910细胞迁移,提示PRMT5可能通过EMT依赖的方式调控卵巢癌细胞迁移。
综上,PRMT5在卵巢癌细胞迁移中发挥重要作用,其可促进卵巢癌细胞的 EMT进程及细胞迁移。然而,PRMT5对EMT转化过程的调控作用是否与表观遗传修饰有关,以及在体内卵巢肿瘤的转移中是否有相同的作用仍需进一步研究。
