黄芩苷对小鼠巨噬细胞干扰素基因刺激因子通路活化的影响
2020-09-22高凤威江梦颖张欣怡吕云玮姜戈晨余宛君刘烁姚雪蒋雅斓陶泽华邵启祥夏圣
高凤威,江梦颖,张欣怡,吕云玮,姜戈晨,余宛君,刘烁,姚雪,蒋雅斓,陶泽华,邵启祥,夏圣
(江苏大学医学院,江苏 镇江 212013)
巨噬细胞作为主要的固有免疫细胞之一,吞噬摄取抗原后对其进行加工、提呈,通过CD80、CD86等共刺激分子协同活化T细胞,启动特异的适应性免疫应答[1-2]。活化的巨噬细胞还能够产生一氧化氮、细胞因子(如TNF-α、IFN-β)等多种其他生物活性物质调节机体免疫应答,参与机体炎症的发生发展[3]。由环鸟苷酸-腺苷酸(cGAMP)、cGAMP合酶、干扰素基因刺激因子(stimulator of interferon genes,STING)等分子介导的cGAMP合酶-STING信号通路的活化是巨噬细胞参与机体免疫应答的关键机制之一[4-5]。当细胞胞质中出现异常双链脱氧核糖核酸,cGAMP合酶-STING信号通路被激活,即可使胞内cGAMP增多,继而位于内质网的STING磷酸化,并与TANK结合激酶1和干扰素调节因子3结合,从而使干扰素调节因子3发生磷酸化,最终促进Ⅰ型干扰素的分泌(如IFN-β),调节机体免疫[6]。
黄芩苷是黄芩的主要活性组分之一,具有明显的抗菌、抑制炎症反应以及抗氧化等功能,对机体免疫反应有一定的调节作用[7]。已有文献报道,经脂多糖介导诱导RAW264.7细胞活化后导致的炎性因子的分泌能够被黄芩苷抑制[8]。而黄芩苷对小鼠骨髓源巨噬细胞(bone marrow-derived macrophages,BMDMs)中cGAMP合酶-STING信号通路的影响仍不明确。本实验将BMDMs作为研究对象,观察黄芩苷处理后BMDMs细胞形态、细胞因子分泌水平及细胞表型的变化,探究黄芩苷在巨噬细胞STING通路活化中的作用。
1 材料和方法
1.1 实验动物
C57BL/6雄性小鼠(7~10周,No.201907363),购于江苏大学实验动物中心。
1.2 主要试剂及仪器
DMEM(上海源培生物公司);胎牛血清(德国Nobimpex公司);12孔细胞培养板(德国Greiner Bio-One公司);红细胞裂解液(美国eBioscience公司);黄芩苷(成都普瑞法科技开发有限公司);cGAMP、脂多糖、胰酶(美国Sigma-Aldrich公司);巨噬细胞集落刺激因子(北京同立海源生物公司);二甲基亚砜(国药集团化学试剂有限公司);一氧化氮试剂盒(上海碧云天生物技术有限公司);小鼠IL-6、TNF-α ELISA检测试剂盒(杭州联科生物公司);小鼠IFN-β ELISA检测试剂盒(北京索莱宝科技有限公司);抗小鼠CD11b-APC、抗小鼠 CD80-PE、抗小鼠 CD86-PE(美国eBioscience公司);酶标仪(美国Rayto 公司);生物安全柜(青岛海尔生物医疗公司);细胞培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);Accuri C6流式细胞仪(美国BD公司)。
1.3 小鼠BMDMs的体外培养和细胞形态观察
参照文献[1]方法制备小鼠BMDM细胞。使用C57BL/6小鼠股骨和胫骨,常规制备C57BL/6小鼠骨髓单细胞悬液。经4℃、800 r/min离心5 min后,弃去上清液。加入800 μL红细胞裂解液,静置6~8 min后,800 r/min离心5 min,弃掉上清液后,PBS溶液洗2次,1 mL含10%胎牛血清、10 ng/mL 巨噬细胞集落刺激因子的DMEM重悬、计数。将2×106/mL的骨髓细胞接种于12孔板,于37℃、5% CO2细胞培养箱中培养诱导7 d,每2天进行半量换液。第7天时将细胞分为对照组、黄芩苷组、cGAMP组、黄芩苷+cGAMP组、脂多糖组、黄芩苷+脂多糖组,并向各处理组按需分别加入黄芩苷(150 μg/mL)、cGAMP(10 μg/mL)和脂多糖(1 μg/mL)。由于黄芩苷溶于DMSO,因此对照组中只加入等量的DMSO作为对照,黄芩苷组中只加入黄芩苷,cGAMP组中加入cGAMP和DMSO,黄芩苷+cGAMP组中加入黄芩苷和cGAMP,脂多糖组中加入脂多糖和DMSO,黄芩苷+脂多糖组中加入黄芩苷和脂多糖。继续培养20~23 h后,用显微镜的低倍镜观察细胞分布状况,高倍镜观察细胞形态和生长状态。
1.4 BMDMs表型的流式细胞术检测
用胰酶消化、收集“1.3”中诱导培养后的各组BMDMs细胞,预冷PBS洗涤。用余液重悬细胞后,加抗小鼠CD11b-APC、抗小鼠CD80-PE或抗小鼠CD86-PE,4℃ 孵育25~30 min,加入2 mL预冷PBS,4℃、800 r/min离心5 min,弃去上清液,用250 μL的PBS重悬细胞后,流式细胞仪检测各组CD11b阳性的群体中CD80、CD86表达水平。流式数据用Flowjo10.0软件分析。
1.5 Griess法检测一氧化氮
收集BMDMs培养上清液,按照试剂盒的操作流程检测一氧化氮含量。反应后的显色液于562 nm处检测光密度(D)值。
1.6 ELISA法检测细胞培养上清液IL-6、TNF-α和IFN-β含量
收集细胞培养上清液,并依据各试剂盒说明书操作,反应后的显色液于450 nm处检测D值。
1.7 统计学分析
应用GraphPad Prism 5对实验数据进行统计学分析,多组之间均数比较采用单因素方差分析,两组间的数据比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 BMDMs的细胞形态观察
流式细胞术检测结果显示,经巨噬细胞集落刺激因子诱导的CD11b+BMDMs达97.9%(图1)。图2示各组BMDMs的镜下形态呈圆形、椭圆形、梭形以及不规则形等。与对照组相比,经cGAMP或脂多糖活化的BMDMs出现较明显聚集现象,其中以脂多糖处理的两组中细胞尤为明显。而黄芩苷对BMDMs活化前和活化后的生长状态及形态均无明显影响。

图1 巨噬细胞集落刺激因子诱导后CD11b阳性BMDM细胞群体流式分析图
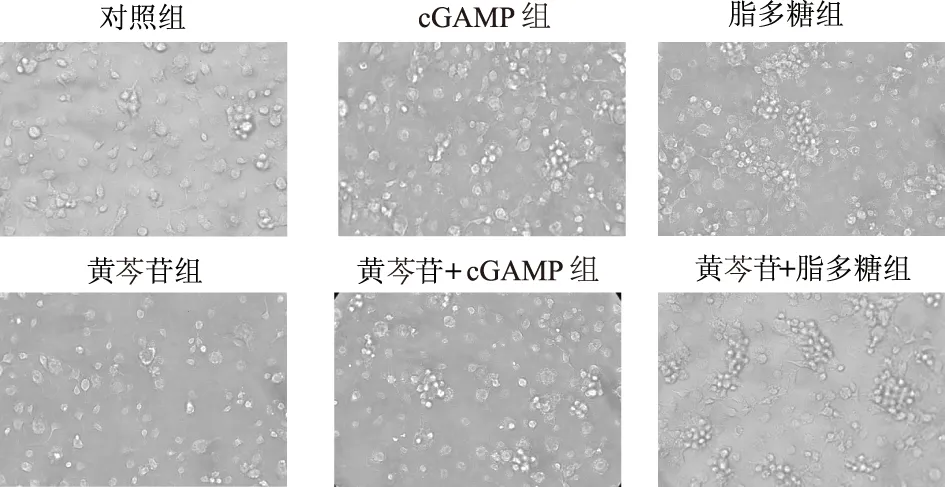
图2 显微镜下各处理组BMDMs细胞形态(×400)
2.2 黄芩苷对活化BMDMs细胞一氧化氮产生的影响
如图3所示,与对照组相比,cGAMP组和脂多糖组BMDMs培养上清液中一氧化氮含量均升高(q=13.75,P<0.01;q=51.31,P<0.01);脂多糖组一氧化氮含量显著高于cGAMP组(q=37.56,P<0.01)。与cGAMP组相比,黄芩苷+cGAMP组一氧化氮含量明显降低(q=13.75,P<0.01);与脂多糖组相比,黄芩苷+脂多糖组一氧化氮含量亦明显下降(q=27.45,P<0.01)。
2.3 黄芩苷对BMDMs 细胞CD80和CD86表达的影响
如图4所示,与对照组比较,黄芩苷组BMDMs表面CD80、CD86表达均降低(q=4.727,P<0.05;q=3.876,P<0.05),cGAMP组的CD80和CD86表达均明显升高(q=12.11,P<0.01;q=28.12,P<0.01),脂多糖组CD80和CD86的表达亦明显升高(q=46.07,P<0.01;q=21.20,P<0.01)。与cGAMP组比较,黄芩苷+cGAMP组CD80和CD86表达均降低(q=13.43,P<0.01;q=9.398,P<0.01)。相比脂多糖组,黄芩苷+脂多糖组CD80和CD86表达亦明显降低(q=32.30,P<0.01;q=17.49,P<0.01)。
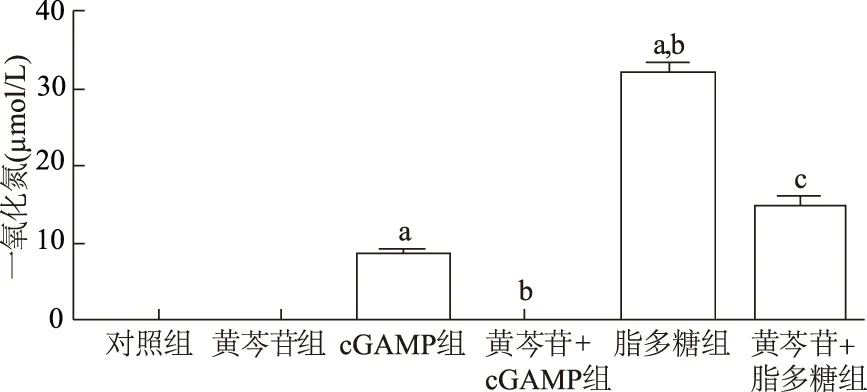
a: P<0.01,与对照组比较;b: P<0.01,与cGAMP组比较;c: P<0.01,与脂多糖组比较

a: P<0.05,b: P<0.01,与对照组比较;c: P<0.01,与cGAMP组比较;d: P<0.01,与脂多糖组比较
2.4 黄芩苷对BMDMs细胞分泌IL-6、TNF-α和IFN-β的影响
由图5可知,与对照组相比,cGAMP组TNF-α (q=7.759,P<0.01)、IL-6 (q=77.81,P<0.01)和IFN-β(q=116.9,P<0.01)的分泌水平明显增加;脂多糖组的TNF-α (q=34.71,P<0.01)、IL-6 (q=95.84,P<0.01)和IFN-β (q=10.64,P<0.01)的泌出量亦明显升高。脂多糖组中IL-6 (q=18.03,P<0.01)和TNF-α (q=26.95,P<0.01)泌出量均明显高于cGAMP组,而IFN-β的泌出量明显低于cGAMP组 (q=106.2,P<0.01)。与cGAMP组相比,黄芩苷+cGAMP组IL-6(q=19.27,P<0.01)、TNF-α(q=3.704,P<0.05)和IFN-β(q=83.64,P<0.01)的分泌水平明显降低。与脂多糖组相比,黄芩苷+脂多糖组中IL-6和TNF-α的分泌量无明显变化,IFN-β的分泌水平则明显降低(q=10.64,P<0.01)。

a: P<0.01,与对照组比较;b: P<0.01,c: P<0.05,与cGAMP组比较;d:P<0.01,与脂多糖组比较
3 讨论
相关研究报道,黄芩苷能够抑制核因子激活的B细胞的κ轻链增强子活化,抑制一氧化氮的产生和IL-6、TNF-α的分泌,改善脂多糖诱导的急性肺损伤和肝脏炎症反应[9-11]。本研究结果显示,cGAMP所介导的STING通路的活化和脂多糖的刺激均能促使巨噬细胞活化并产生一氧化氮,且黄芩苷能够明显抑制这两条信号通路被激活后巨噬细胞中一氧化氮的产生。但是STING通路活化对一氧化氮产生的刺激作用较脂多糖的活化效果弱,这与相关报道结果一致[12]。
BMDM表面标志CD80、CD86的表达与巨噬细胞的活化程度密切相关,并参与协同抗原信号活化T淋巴细胞,从而介导固有免疫和获得性免疫应答。结果表明,黄芩苷下调cGAMP和脂多糖所诱导的巨噬细胞表面CD80和CD86表达的上调效应,从而抑制巨噬细胞的活化,而且可能通过抑制这两种表面分子的表达进而抑制巨噬细胞的抗原呈递作用,从而抑制免疫应答。因此,黄芩苷对巨噬细胞STING通路活化后功能的调节作用尚需进一步研究。
炎症因子也是巨噬细胞活化后分泌的重要免疫效应物。本研究结果表明,与脂多糖刺激作用比较,BMDMs中STING通路活化后TNF-α的分泌较少,IL-6分泌较多。而黄芩苷的处理能够在一定程度抑制STING通路活化引起的TNF-α和IL-6泌出,但对于脂多糖的刺激作用所产生的这两种细胞因子并无明显影响。文献报道黄芩苷能够通过抑制巨噬细胞蛋白激酶B/核因子激活的B细胞的κ轻链增强子信号通路,从而抑制TNF-α、IL-1β、IL-6等炎症因子的分泌[10, 13]。与本研究结果的差异可能与其所用巨噬细胞类型不同有关,文献中所用的是RAW264.7细胞系体外共培养或采用体内黄芩苷直接应用,而本研究体系则是使用BMDM进行体外实验。
已有的文献报道提示[14],STING信号通路活化后主要能够产生Ⅰ型干扰素从而发挥免疫学效应。本研究发现,用cGAMP活化BMDM的STING通路后,BMDM细胞的IFN-β分泌明显增加,而脂多糖的刺激也会引起低水平IFN-β的产生。但黄芩苷可显著抑制活化BMDMs的IFN-β分泌,尤其是对cGAMP活化组的抑制更明显。综上所述,黄芩苷可明显抑制BMDM中STING通路活化,下调IFN-β等免疫效应分子的产生。本研究还只是对黄芩苷调控巨噬细胞通路的初步研究,其具体的调控机制还需要更详尽的实验探索。
