基于OPG/RANKL信号通路探讨姜黄素对去势骨质疏松模型大鼠骨代谢平衡的影响
2020-09-21张庆刚张庆红张克民姚明田月洋毛小莉冯宜蒀王卉
张庆刚 张庆红 张克民 姚明 田月洋 毛小莉 冯宜蒀 王卉


摘 要 目的:探討姜黄素对去势骨质疏松模型大鼠骨代谢平衡的影响,并探讨其可能机制。方法:将雌性Wistar大鼠随机分为空白组(A组)、模型组(B组)、雌二醇组[C组(阳性对照),戊酸雌二醇50 μg/(kg·d)]和姜黄素低、中、高剂量组[D~F组,55、110、165 μg/(kg·d)],每组15只。除A组外,其余各组均采用去卵巢法建立去势骨质疏松模型。造模后,A、B组大鼠均灌胃生理盐水,各给药组灌胃相应药物,体积均为30 mL/kg,每日1次,连续12周。采用酶联免疫吸附测定法检测各组大鼠血清骨代谢标志物[骨特异性碱性磷酸酶、核心结合因子α1、Ⅰ型胶原交联羧基末端肽、Ⅰ型前胶原氨基端前肽、骨钙素]含量,采用实验动物微型CT影像系统检测大鼠骨密度(BMD)和骨小梁结构参数[相对骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、连接密度(Conn.D)、骨小梁分离度(Tb.Sp)、结构模型指数(SMI)],采用逆转录聚合酶链式反应法和Western blotting法分别检测下丘脑和股骨组织中骨保护素(OPG)和核因子κB受体活化因子配体(RANKL)mRNA及蛋白的表达情况。结果:与A组比较,B组大鼠血清骨代谢标志物含量,BMD和BV/TV、Tb.N、Tb.Th、Conn.D以及OPG mRNA及其蛋白的表达量均显著降低,Tb.Sp、SMI以及RANKL mRNA及其蛋白的表达量均显著升高(P<0.05)。与B组比较,各给药组大鼠血清骨代谢标志物含量,BMD和BV/TV、 Tb.N、Tb.Th、Conn.D以及OPG mRNA及其蛋白的表达量均显著升高,Tb.Sp、SMI以及RANKL mRNA及其蛋白的表达量均显著降低,且姜黄素各组效果均呈剂量依赖性(P<0.05或P<0.01)。结论:姜黄素能够改善去势骨质疏松模型大鼠的骨代谢水平,增加其BMD、改善骨小梁微结构、抑制骨吸收;这种作用可能与调控OPG/RANKL信号通路有关。
关键词 骨质疏松;姜黄素;骨代谢平衡;骨保护素/核因子κB受体活化因子配体信号通路;大鼠
ABSTRACT OBJECTIVE: To investigate the effects of curcumin on bone metabolism balance in ovariectomized osteoporosis model rats, and to investigate its potential mechanism. METHODS: Totally female Wistar rats were randomly divided into blank group (group A), model group (group B), estradiol group [group C (positive control), estradiol valerate 50 μg/(kg·d)], curcumin low-dose, medium-dose and high-dose groups [group D-F, 55, 110, 165 μg/(kg·d)], with 15 rats in each group. Except for group A, other rats were ovariectomized to establish osteoporosis model. After modeling, group A and B were given normal saline intrgastrically, and administration groups were given relevant medicine intrgastrically 30 mL/kg, once a day, for consecutive 12 weeks. The contents of serum bone metabolism markers [BALP, CBF-α1, CTX-Ⅰ, PINP and OC] were determined by ELISA. The bone mineral density (BMD) and trabecular structure indexes [relative bone volume fraction (BV/TV), trabecular number (Tb.N), trabecular thickness (Tb.Th), connectivity density (Conn. D), trabecular separation (Tb.Sp) and structure model index (SMI)] were determined by micro CT imaging system. The mRNA and protein expression of OPG and RANKL in hypothalamus and femur were determined by RT-PCR and Western blotting assay. RESULTS: Compared with group A, the contents of serum bone metabolism markers, BMD, BV/TV, Tb.N, Tb.Th, Conn.D, mRNA and protein expression of OPG were decreased significantly in group B, while Tb.Sp, SMI, mRNA and protein expression of RANKL were increased significantly (P<0.05). Compared with group B, the contents of serum bone metabolism markers, BMD, BV/TV, Tb.N, Tb.Th, Conn.D, mRNA and protein expression of OPG were increased significantly in administration groups; Tb.Sp, SMI, mRNA and protein expression of RANKL were decreased significantly, in a dose-dependent manner among curcumin groups (P<0.05 or P<0.01). CONCLUSIONS: Curcumin can improve the level of bone metabolism, increase BMD, improve the trabecular microstructure and inhibit bone absorption in ovariectomized osteoporosis model rats. Its mechanism may be related to the regulation of OPG/RANKL signaling pathway.
KEYWORDS Osteoporosis; Curcumin; Bone metabolism balance; OPG/RANKL signaling pathway; Rats
骨质疏松症(Osteoporosis,OP)是临床常见疾病,该病的发生多与骨质退变、骨量减少以及骨微结构改变有关,可降低骨载荷承受力、增加骨脆性,从而引起患者慢性疼痛并且增加骨折风险[1]。因此,临床评价多从患者骨量、骨代谢标志物等指标入手。有研究发现,OP的发生是免疫系统、神经系统、内分泌系统等多系统共同作用的结果[2]。近年来有学者指出,骨保护素(OPG)/核因子κB受体活化因子配体(RANKL)信号通路对破骨细胞形成、分化和吸收具有重要的调节作用[3]。姜黄素可从姜科、天南星科等植物的根茎中分离得到的一种天然活性成分,具有改善骨微结构、促进成骨细胞生成的作用[4-5]。基于此,本研究通过切除雌性大鼠双侧卵巢的方法建立去势OP动物模型,并给予姜黄素进行干预,观察该化合物对大鼠OPG/RANKL信号通路以及骨代谢平衡的影响,旨在为姜黄素临床治疗OP提供实验依据。
1 材料
1.1 仪器
Benchmark Plus型酶标仪(美国Bio-Rad公司);Inveon型实验动物微型计算机断层扫描(CT)影像系统(德国Siemens公司);DXA型骨密度(BMD)仪(徐州品源医疗科技有限公司);Tannon-5200型成像系统(上海天能科技有限公司);ABI 7300型荧光定量聚合酶链式反应(PCR)仪(美国ABI公司);TG-16M型离心机(上海卢湘仪离心机仪器有限公司)。
1.2 药品与试剂
姜黄素对照品(国药集团化学试剂有限公司,批号:F20160703,纯度:99.8%);戊酸雌二醇片(阳性对照,德国Bayer公司,批号:JYHB1901034,规格:1 mg);山羊抗兔OPG抗体(批号:bs-0431R-1)、大鼠源RANKL抗体(批号:bs-0747R-1)、大鼠源GAPDH抗体(批号:bs- 00542R-1)均购自博奥森(北京)生物技术有限公司;小鼠抗人β-actin单克隆抗体(美国Abcam公司,批号:Ab179696);辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(上海长岛生物技术有限公司,批号:D-3004);ECL显色试剂盒(批号:R1600)、RIPA组织/细胞快速裂解液(批号:BYL40836)均购自基尔顿生物科技(上海)有限公司;骨特异性碱性磷酸酶(BALP)酶联免疫吸附试验(ELISA)检测试剂盒(批号:E201902)、核心结合因子α1(CBF-α1)ELISA检测试剂盒(批号:E201906)、Ⅰ型胶原交联羧基末端肽(CTX-Ⅰ)ELISA检测试剂盒(批号:E201906)、Ⅰ型前胶原氨基端前肽(PINP)ELISA检测试剂盒(批号:E201905)、骨钙素(OC)ELISA检测试剂盒(批号:E201901)均购自北京方程生物科技有限公司;PCR扩增引物由上海英骏生物技术有限公司设计、合成(引物序列见表1);RNA抽提试剂盒(批号:DP419)、BCA蛋白测定试剂盒(批号:PICPI23222)、SYBR Green PCR试剂盒(含SYBR Pri mix等试剂,批号:K0223)均购自美国Thermo Fisher Scientific公司;逆转录试剂盒(美国Fermentas公司,批号:K1622);上样缓冲液(中国医药集团有限公司,批号:K0223);0.9%氯化钠溶液(国药集团化学试剂有限公司,批号:20190001;作生理盐水用);其余试剂均为分析纯或实验室常用规格,水为去离子水。
1.3 动物
SPF级Wistar大鼠90只,雌性,23周龄,体质量(180±20) g,由华中科技大学实验动物中心提供,动物生产合格证号:SCXK(鄂)2016-0009。所有大鼠均适应性喂养1周后开始实验。本研究试验过程及操作均遵守国家健康与医学研究委员会(NHNRC)的动物道德准则,并经华中科技大学动物实验伦理委员会审核批准。
2 方法
2.1 分组与造模
将Wistar大鼠随机分为空白组(A组)、模型组(B组)、雌二醇组(C组)和姜黄素低、中、高剂量组(D~F组),每组15只。除A组不作任何处理外,其余各组大鼠均参照文献去卵巢法[6-7]建立OP模型:腹腔注射戊巴比妥钠(30 mg/kg)进行麻醉后,以俯卧位固定,于大鼠背部脊柱两侧切口,在无菌条件下摘除其双侧卵巢,以BMD明显降低、骨小梁微结构受损严重判定模型复制成功[8]。
2.2 给药
手术3个月后,A、B组大鼠均灌胃等體积生理盐水,C组大鼠灌胃戊酸雌二醇[50 μg/(kg·d),以水为溶剂;剂量设置参考成人等效剂量并按人鼠体型系数换算而得],D~F组大鼠均灌胃相应姜黄素混悬液[55、110、165 μg/(kg·d),以水为溶剂;剂量设置参考本课题组前期预实验结果]。灌胃体积均为30 mL/kg,每日1次,连续12周。
2.3 标本采集与指标检测
2.3.1 血清骨代谢标志物BALP、CBF-α1、CTX-Ⅰ、PINP、OC含量检测 末次给药后,处死大鼠,于心脏取血2 mL,以3 000 r/min离心10 min,分离血清,采用ELISA法以酶标仪检测各组大鼠血清中BALP、CBF- α1、CTX-Ⅰ、PINP、OC的含量,严格按照相应试剂盒说明书操作。
2.3.2 BMD及骨小梁微结构参数检测 分离各组大鼠右侧股骨标本,使用实验动物微型CT影像系统对远端干骺端进行扫描(扫描电压:65 kV,电流:384 mA,分辨率:18 μm)。扫描完成后,选择感兴趣区域(ROI)行三维重组后提取图像资料,利用专用骨骼分析软件Advanced Bone Analysis(ABA)2.0进行骨组织计量学分析,包括BMD、相对骨体积分数(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、连接密度(Conn.D)、骨小梁分离度(Tb.Sp)、结构模型指数(SMI)。上述所有操作均由同一组研究人员完成。
2.3.3 下丘脑和股骨组织中OPG、RANKL mRNA表达情况检测 采用逆转录聚合酶链式反应法(RT-PCR)检测。各组大鼠采血后,取其下丘脑和股骨组织适量,用RNA抽提试剂盒提取组织中总RNA,对RNA纯度、含量进行检测后使用逆转录试剂盒获取cDNA。以上述cDNA为模板,进行扩增。反应体系(共20 μL):SYBR Pri mix 10 μL,上、下游引物各1 μL,模板cDNA 2 μL,ddH2O 6 μL;反应条件:95 ℃预变性20 s;95 ℃变性10 s,62 ℃退火30 s,70 ℃延伸30 s,共45个循环。以GAPDH为内参,使用荧光定量PCR仪检测,并以2-ΔΔCt法计算各目标mRNA的表达量(Ct表示每个反应管内荧光信号强度达到设定阈值时所经历的循环数)。
2.3.4 下丘脑和股骨组织中OPG、RANK蛋白表达情况检测 采用Western blotting法检测。取“2.3.3”项下各组大鼠下丘脑和股骨组织适量,加入RIPA裂解液于冰上裂解30 min,采用BCA蛋白测定试剂盒检测蛋白浓度。蛋白经变性后,取适量用上样缓冲液稀释,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转移至聚偏二氟乙烯膜上,于4 ℃下加入相应一抗(稀释度均为1 ∶ 500),4 ℃孵育过夜;以三羟甲基氨基甲烷盐酸盐(TBST)溶液洗涤5 min×3次,加入相应二抗(稀释度均为1 ∶ 500),室温孵育2 h;以TBST溶液洗涤5 min×3次,以ECL试剂显色后,于成像系统上成像并使用QuantityOne v4.52软件进行分析。以目标蛋白与内参蛋白(β-actin)条带灰度值的比值表示该目标蛋白的表达量。
2.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用F检验,组间两两比较采用t检验。P<0.05为差异有统计学意义。
3 结果
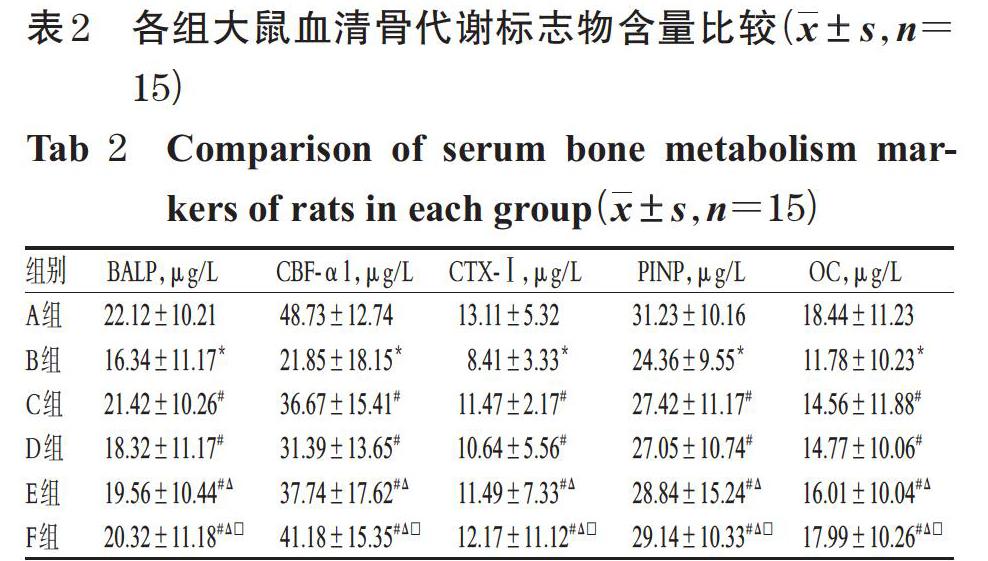
3.1 各组大鼠血清骨代谢标志物含量比较
与A组比较,B组大鼠血清BALP、CBF-α1、CTX-Ⅰ、PINP、OC含量均显著降低(P<0.05)。与B组比较,C~F组大鼠血清上述指标均显著升高(P<0.05);且E组、F组显著高于D组,F组显著高于E组(P<0.05),详见表2。
3.2 各组大鼠BMD及骨小梁微结构参数比较
与A组比较,B组大鼠BMD、BV/TV、Tb.N、Tb.Th、Conn.D均显著降低,Tb.Sp、SMI均显著升高(P<0.05)。与B组比较,C~F组大鼠BMD、BV/TV、Tb.N、Tb.Th、Conn.D均显著升高,且E组、F组上述指标均显著高于D组,F组显著高于E组;Tb.Sp、SMI均显著降低,且E组、F组上述指标均显著低于D组,F组显著低于E组(P<0.05),详见表3。
3.3 各组大鼠下丘脑和股骨组织中OPG、RANKL mRNA表达量比较
与A组比较,B组大鼠下丘脑和股骨组织中OPG mRNA的表达量显著降低,RANKL mRNA的表达量显著升高(P<0.05)。与B组比较,C~F组大鼠下丘脑及股骨组织中OPG mRNA的表达量均显著上升,且E组、F组上述指标显著高于D组,F组显著高于E组;RANKL mRNA的表达量均显著降低,且E组、F组上述指标均显著低于D组,F组显著低于E组(P<0.05),详见表4。
3.4 各组大鼠下丘脑和股骨组织中OPG、RANKL蛋白表达量比较
与A组比较,B组大鼠下丘脑和股骨组织中OPG蛋白的表达量显著降低,RANKL蛋白的表达量显著上升(P<0.05)。与B组比较,C~F组大鼠下丘脑及股骨组织中OPG蛋白的表达量均显著升高,且E组、F组显著高于D组,F组显著高于E组;RANKL蛋白的表达量均显著降低,且E组、F组显著低于D组,F组显著低于E组(P<0.05),详见图1、表5。
4 讨论
OP发病原因复杂多变,目前多认为其与微循环障碍、代谢异常、基因多态性等多种因素有关[9-10]。随着人口老龄化加剧,全球OP患者的数量正在逐年增加,由其导致的骨折风险也越来越高[11]。中医学将OP归属于“骨痿”“骨枯”等范畴,辨证论治时多从肾肝脾等脏腑入手。西医治疗OP的主要药物包括雌激素调节药物、骨形成促进药物、骨矿化促进药物等,但长期使用会引发一系列毒副反应,如骨脆性增加、骨折易发等全身骨骼疾病[12]。姜黄素是从姜科、天南星科等植物的根茎中提取的一种多酚类化学成分,具有抗肿瘤、抗氧化、提高免疫力等多种药理作用[13]。近期有研究表明,姜黄素对于修复细胞、调节骨再造、改善骨质量等的效果明显[14]。基于此,本研究以戊酸雌二醇为阳性对照,初步考察了姜黄素对去势OP模型大鼠骨代谢平衡的影响及可能机制。
CBF-α1由成骨细胞特异性表达,是决定成骨细胞分化的重要因子,在维持骨骼正常生长发育中起着重要作用。已有研究证实,CBF-α1不仅能够调节成骨細胞分化,还能调控已分化成骨细胞的发育和生长因子的表达,从而控制骨骼形成和发育的生理过程[15]。CTX-Ⅰ是骨吸收过程中Ⅰ型胶原释放入血的产物;PINP为Ⅰ型前胶原细胞胞外分泌产物,是骨形成的敏感指标;血液中上述两种指标的含量可反映Ⅰ型胶原合成速率、成骨细胞活动以及骨吸收情况,是诊断OP的特异性指标[16-17]。OC是成骨细胞分泌的一种非胶原蛋白,其含量变化是成骨细胞活动以及骨代谢变化的重要标志[18]。由此可见,CBF-α1、CTX-Ⅰ、PINP以及OC含量均能特异性地反映OP骨代谢平衡情况。
OPG/RANKL信号通路是成骨细胞与破骨细胞相互作用机制中较重要的通路之一,其可有效调控破骨细胞生成并控制骨代谢,与OP发病机制密切相关[19]。下丘脑能通过分泌多种因子调控破骨细胞来释放骨吸收标志物,BALP就是其中之一。有研究发现,BALP可诱导成骨细胞分泌RANKL,调控骨吸收[20]。OPG是由成骨细胞分泌的RANKL诱饵受体,在BALP干预下可与RANK竞争性结合RANKL,从而诱导破骨细胞凋亡、抑制骨吸收。有研究证实,补充外源性OPG可提高OP患者BMD、增强骨强度、促进骨吸收[21]。此外,BMD及骨小梁微结构改变可有助于预测OP的发生与发展,可为该病的诊断提供重要参考[22]。基于此,本研究以BMD,骨小梁微结构参数,血清BALP、CBF-α1、CTX-Ⅰ、PINP、OC含量以及小丘脑/股骨组织中OPG、RANKL蛋白及其mRNA的表达量为考察指标,初步评价了姜黄素对去势OP模型大鼠骨代谢平衡的影响。
本研究结果显示,在摘除卵巢后,大鼠血清中骨代谢标志物BALP、CBF-α1、CTX-Ⅰ、PINP、OC含量以及BMD、BV/TV、Tb.N、Tb.Th、Conn.D均显著降低,Tb.Sp和SMI均显著升高,提示大鼠骨量丢失、骨吸收增加、骨小梁显微结构受损,与OP病理表现相符,表明模型复制成功。此外,OP模型大鼠下丘脑和股骨远端组织中OPG/RANKL蛋白及其mRNA的表达量也发生了明显的变化,其中OPG表达下调、RANKL表达上调,提示OP模型大鼠的骨量丢失、骨吸收增加可能与下丘脑和股骨组织中OPG/RANKL通路有关。经姜黄素处理后,各给药组大鼠血清骨代谢标志物含量,BMD、BV/TV、Tb.N、Tb.Th、Conn.D以及OPG蛋白及其mRNA的表达量均显著升高,Tb.Sp、SMI以及RANKL蛋白及其mRNA的表达量均显著降低,且呈剂量依赖性,提示姜黄素能剂量依赖性地改善大鼠的骨代谢平衡,增加其BMD、抑制骨吸收、改善骨小梁微结构,这与许东亮等[23]、蒋琪等[24]研究结果一致;同时,上述作用可能与姜黄素调控OPG/RANKL信号通路的表达有关。
综上所述,姜黄素能够改善去势OP模型大鼠骨代谢水平,可增加BMD、抑制骨吸收、改善骨小梁微结构,其机制可能与调控OPG/RANKL信号通路有关。本课题组后续将进一步增加药物干预剂量、扩大实验动物样本量、延长药物干预时间,以进一步挖掘姜黄素对去势OP模型大鼠骨代谢平衡改善作用的量效关系。
参考文献
[ 1 ] 宋蒙胜,余霄,庞清江.失代偿肝硬化致骨质疏松症的发病机制及治疗研究进展[J].中华骨与关节外科杂志,2019,12(11):924-928.
[ 2 ] 董万涛,吕泽斌,宋敏,等.从脾肾论治骨质疏松症的神经-内分泌-免疫网络平衡机制[J].中国骨质疏松杂志,2015,21(11):1416-1419.
[ 3 ] 钟丽丽,郭文俊,汪洪.丁丙诺啡透皮贴在髋关节置换术患者中的镇痛效果及对OPG/RANKL、炎症因子水平的影响分析[J].中南医学科学杂志,2020,48(2):164-167.
[ 4 ] 邹志余,周劲松,肖昆林,等.姜黄素对单碘乙酸诱导的膝骨关节炎大鼠的治疗作用[J].西安交通大学学报(医学版),2020,41(2):299-303.
[ 5 ] 颜泉.姜黄素对体内外骨肉瘤细胞增殖和侵袭的影响及其机制研究[J].中国药房,2018,29(7):918-922.
[ 6 ] 郭鱼波,马如风,王丽丽,等.骨质疏松动物模型及其评价方法的研究进展[J].中国骨质疏松杂志,2015,21(9):1149-1154.
[ 7 ] JOHNSTON BD,WARD WE. The ovariectomized rat as a model for studying alveolar bone loss in postmenopausal women[J]. Biomed Res Int,2015. DOI:10.1155/2015/635023.
[ 8 ] 骆瑶,陈兰英,官紫祎,等.杜仲提取物对去卵巢骨质疏松大鼠骨代谢、骨密度及骨微结构的影响[J].中药材,2016,39(11):2624-2628.
[ 9 ] YIN X,ZHOU C,LI J,et al. Autophagy in bone homeostasis and the onset of osteoporosis[J]. Bone Res,2019. DOI:10.1038/s41413-019-0058-7.
[10] 林适,吴潇烁,陈柏行,等.基于网络药理学探讨骨碎补治疗骨质疏松症的作用机制[J].中国药房,2019,30(10):1333-1338.
[11] 赵凡,李超,杨鹤,等. WHO骨折风险评价工具(FRAX(R))的应用进展[J].中华医学杂志,2013,93(3):234- 236.
[12] 张良花,沈渠深,张秋子.他汀类药物对骨质疏松症促进骨形成的研究进展[J].华南国防医学杂志,2016,30(7):479-481.
[13] 陈洁,刘一然.姜黄素对2型糖尿病大鼠脂肪细胞葡萄糖转运及PI3K/Akt信号通路的影响[J].中国比较医学杂志,2019,29(5):90-97.
[14] 吴峻.姜黄素对骨肉瘤细胞增殖、凋亡影响及作用机制研究[J].辽宁中医药大学学报,2019,21(5):37-41.
[15] 潘小燕,王鸿度,岳荣超,等.电针足少阳经穴对去卵巢大鼠骨质疏松症骨组织OPG、RANKL及CBFα1 mRNA表达的影响[J].中华中医药杂志,2017,32(11):5132-5134.
[16] KUMM J,TAMM A,LINTROP M,et al. Diagnostic and prognostic value of bone biomarkers in progressive knee osteoarthritis:a 6-year follow-up study in middle-aged subjects[J]. Osteoarthritis Cartilage,2013,21(6):815- 822.
[17] ??GOSZ P,PULIK ?,ST?PI?SKI P,et al. The use of typeⅠ collagen cross-linked C-telopeptide(CTX-Ⅰ) as a biomarker associated with the formation of periprosthetic ossifications following total hip joint arthroplasty[J]. Ann Clin Lab Sci,2018,48(2):183-190.
[18] ZHANG XL,WANG YN,MA LY,et al. Uncarboxylated osteocalcin ameliorates hepatic glucose and lipid metabolism in KKAy mice via activating insulin signaling pathway[J]. Acta Pharmacol Sin,2020,41(3):383-393.
[19] 劉飞祥,林子璇,徐道明,等.左归丸调节β2AR介导的RANKL/OPG信号通路改善去卵巢大鼠骨量和显微结构水平[J].中国实验方剂学杂志,2019,25(18):1-8.
[20] 林海鸣,黄云梅,吴银生,等.卵巢切除大鼠在不同时期RANKL、OPG蛋白表达的变化及与BTMs的相关性[J].中国骨质疏松杂志,2017,23(8):981-985.
[21] MICHA? S,EWA S,KR?L I,et al. Assessment of OPG,RANKL,bone turnover markers serum levels and BMD after treatment with strontium ranelate and ibandronate in patients with postmenopausal osteoporosis[J]. Endokrynol Pol,2016,67(2):174-184.
[22] 侯艳丽,廖二元,伍贤平.骨密度拟合参考曲线在骨质疏松诊断中的作用[J].中国骨质疏松杂志,2007,13(2):125-129.
[23] 许东亮,彭朝晖,熊美才.姜黄素对骨质疏松大鼠种植体骨结合的促进作用[J].吉林大学学报(医学版),2019,45(4):877-881、后插3.
[24] 蒋琪,朱冰玉,德维,等.姜黄素对去势骨质疏松大鼠下颌骨和股骨EZH2基因表达的影响[J].上海口腔医学,2019,28(3):241-245.
(收稿日期:2020-03-15 修回日期:2020-07-20)
(编辑:张元媛)
