江苏省不同规模药品生产企业药物警戒工作现状对比研究
2020-09-21王佳域柳鹏程陈巧云李明黄倩倩陈锦敏孙骏
王佳域 柳鹏程 陈巧云 李明 黄倩倩 陈锦敏 孙骏

摘 要 目的:研究江蘇省大、中、小型药品生产企业的药物警戒工作现状,为不同规模企业的药物警戒工作开展提供参考。方法:通过问卷调查及检索相关网站,对江苏省内108家企业的药物警戒工作现状进行考察,调查不同规模企业的药物警戒情况(组织机构、人员及培训、药物警戒文件、计算机系统)、药品安全性监测情况(个例报道、定期安全性更新报告、上市后安全性研究)和药品风险管理情况(信号管理、风险管理计划、风险控制措施、药品安全性沟通),并分别提出建议。结果与结论:不同规模企业在组织机构设置(独立设置专门机构)方面无显著差异(P=0.60),大部分企业在独立设置药物警戒专门机构上的比例均不足五成,在人员及培训(负责人专职情况、专职人员数、其中医学及临床药学类人员数)、文件(制定培训管理制度、委托管理与重点监测相关规程)和计算机系统3个方面存在显著差异(P<0.05);不同规模企业在个例报告的主要收集途径上无显著差异,但大型企业2019年自主报告数量(P<0.01)、针对定期安全性更新报告设有质量控制流程的比例(P=0.01)、近5年开展过上市后安全性研究的比例(P<0.01)均显著高于中、小型企业;大型企业(70.00%)和中型企业(84.38%)认为“缺乏技术指导原则”是影响信号管理的重要因素的比例高于小型企业(53.57%)(P=0.01);大型企业(60.00%)和中型企业(50.00%)在近5年内开展过风险管理计划的比例高于小型企业(30.36%)(P=0.04);大型企业(50.00%)在近5年内采取过说明书修订措施的比例高于中型企业(37.50%)和小型企业(25.00%)(P=0.05);大型企业(70.00%)和中型企业(59.38%)针对药店药师实施沟通活动的比例高于小型企业(32.14%)(P<0.01)。整体而言,大型企业在药物警戒体系、药品安全性监测、药品风险管理等方面优于中、小型企业。大型企业在主动开展风险管理计划方面、中型企业在专职负责人方面、小型企业在药物警戒体系等方面均有一定程度欠缺。因此,笔者建议大型企业以有效管控品种风险为目标,主动加强风险管理;中型企业继续提升主体责任意识,加强药物警戒工作的资源投入力度;小型企业应切实提高重视程度,重点改善药物警戒体系及具体工作的合规性。
关键词 药物警戒;药品上市许可持有人;药品生产企业;企业规模;现状
ABSTRACT OBJECTIVE: To study the current situation of pharmacovigilance work in large, medium and small-scale pharmaceutical manufacturers in Jiangsu Province, and to provide reference for the pharmacovigilance development of drug manufacturers with different scales. METHODS: The situation of pharmacovigilance work in 108 manufacturers in Jiangsu province was investigated through a questionnaire survey and related websites. The pharmacovigilance work (organization, personnel and training, document, computer system), drug safety monitoring (case report, regular safety update report, post-marketing safety research) and drug risk management (signal management, risk management plan, risk control measures, drug safety communication) of different manufacturers were investigated to put forward the suggestions. RESULTS & CONCLUSIONS: There was no significant difference in the organizational structure (independently established specialized agencies) among manufacturers of different scales (P=0.60). Most of the manufacturers had less than 50% of the proportion in the independent establishment of specialized institutions for pharmacovigilance. There was significant difference in personnel and training (situation and number of full-time staff in charge, medical and clinical pharmacy personnel number), document (formulating training management system, entrusted management and key monitoring procedures), computer system (P<0.05). There was no difference in the main collection ways of case reports among manufacturers of different scales; however, the number of independent reports in 2019 (P<0.01), the proportion of quality control process for regular safety update reports (P=0.01), and the proportion of carrying out post-marketing safety research in recent five years (P<0.01) in large-scale manufacturers were all significantly higher than small- and medium-scale manufacturers. The proportions of large-scale manufacturers (70.00%) and medium-scale manufacturers (84.38%), which considered “lack of technical guidelines” as an important factor affecting signal management, were higher than that of small-scale manufacturers (53.57%) (P=0.01); the proportions of large-scale manufacturers (60.00%) and medium-scale manufacturers (50.00%), which had carried out risk management plans in the past five years, were higher than that of small-scale manufacturers (30.36%) (P=0.04); the proportion of large-scale manufacturers (50.00%), which adopted the measures in recent 5 year, was higher than medium-scale manufacturers (37.50%) and small-scale manufacturers (25.00%); the proportions of large-scale manufacturers (70.00%) and medium-scale manufacturers (59.38%), which carried out communication for pharmacists, were higher than small-scale manufacturers (32.14%) (P<0.01). Large-scale manufacturers outperformed small- and medium-scale manufacturers in terms of pharmacovigilance system, drug safety monitoring and drug risk management. Large-scale manufacturers had a certain degree of lack of initiative on performing risk management plans, medium-scale manufacturers on full-time staffs in charge, and small-scale manufacturers on pharmacovigilance system. So, it is recommended that large-scale manufacturers take effective control of variety risk as the goal and actively risk management; medium-scale manufacturers should continuously enhance the awareness of responsibility and improve the investment of resources on pharmacovigilance work; small-scale manufacturers should pay more attention to improving the pharmacovigilance system and the compliance of specific work.
KEYWORDS Pharmacovigilance; Holder of drug marketing authorization; Drug manufacturers; Manufacturer scale;Current situations
近年来,以落实药品生产企业主体责任为目的的政策与举措不断出台[1-2],企业在药品不良反应监测方面的意识和能力已有大幅提升,但其当前工作仍以“被动监测”药品不良反应/事件为主,主动监测及风险管理较为薄弱,同时大多数企业尚未建立贯穿药品全生命周期、以风险管理为核心的监测体系——药物警戒体系[3]。新修订《药品管理法》于2019年12月1日施行后,药品上市许可持有人(以下简称“持有人”)制度正式实施,药物警戒制度也将逐步建立,在此背景下,探讨当前持有人开展药物警戒工作的实际情况,为监管部门制定和实施药物警戒制度提供参考显得尤为必要,也利于持有人进一步完善药物警戒工作、切实承担主体责任。
目前,国内相关研究多根据国内外法律法规分析我国药品生产企业应如何履行药品不良反应监测或药物警戒责任[4-6],也有部分研究通过问卷调查分析企业工作现状[7-8],但比较不同规模企业工作情况的研究较少见。因此,在药品不良反应监测向药物警戒过渡转变的背景下[9],本文拟通过研究药品生产企业药物警戒的工作现状,对江苏省大、中、小型药品生产企业代表在药品上市后阶段的药物警戒工作现状进行调查,以期为企业药物警戒工作发展提供借鉴,更可为监管部门完善监管路线提供参考。
1 调查概况与研究方法
1.1 调查概况
根据国内外药物警戒相关法律法规[10?12],结合我国当前对持有人药物警戒工作的基本要求设计问卷,于2018年12月委托江苏省各市药品不良反应监测中心筛选药品生产企业代表进行发放。各市问卷发放数量占该市药品制剂生产企业总数的30%以上,发放对象覆盖外资、合资以及大型、中型、小型企业等不同类型,并纳入具有創新药、高风险品种较多的企业。问卷主要由药物警戒情况(组织机构、人员及培训、药物警戒文件、计算机系统)、药品安全性监测情况(个例报道、定期安全性更新报告、上市后安全性研究)和药品风险管理情况(信号管理、风险管理计划、风险控制措施、药品安全性沟通)3个部分组成。同时,手工检索国家药品不良反应监测中心获得2019年不同规模企业个例药品不良反应/事件报告(以下简称“个例报告”)的上报数量。
1.2 企业规模判定标准
被调查企业划分为大型、中型、小型3种规模类型。根据国家统计局《关于印发〈统计上大中小微型企业划分办法(2017)〉的通知》[13]的分类方法对被调查企业进行分类,将从业人员1 000人以上或营业收入4 000万元以上的企业划分为大型企业,将从业人员300~1 000人或营业收入2 000万~4 000万元的企业划分为中型企业,将从业人数300人以下或营业收入2 000万元以下的企业划分为小型企业。以上标准须同时满足所列指标下限,否则下划一档。
1.3 统计学方法
使用SPSS 22.0统计软件对所有分类变量进行数据处理,采用χ2检验法比较不同规模企业问卷结果的差异,并在交叉表单元格期望小于5时,采用Fisher精确检验方法进行校正。计算结果以α分别为0.05、0.01作为显著、极显著的检验水准。
2 结果与分析
调查共发放108份问卷,回收108份有效问卷,问卷有效回收率为100%。
被调查企业按规模统计,以小型企业为主,共有56家(51.85%),另有中型企业32家(29.63%)、大型企业20家(18.52%)。以下分别从药物警戒体系情况、药品安全性监测情况、药品风险管理情况3个方面分析不同规模企业间的主要差异。
2.1 药物警戒体系情况
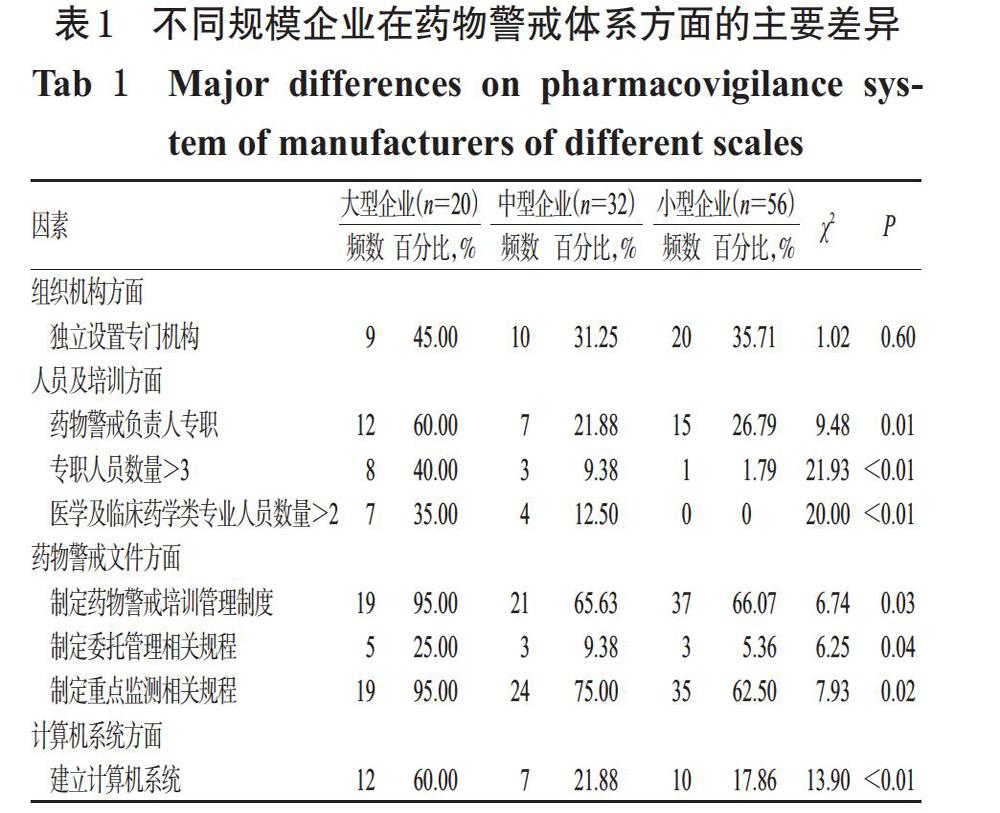
调查分别从组织机构、人员及培训、药物警戒文件、计算机系统等方面对企业的药物警戒体系情况进行了考察。结果显示,不同规模企业在组织机构设置方面无显著差异,大部分企业在药物警戒专门机构独立设置上的比例均不足五成,但是在人员及培训、文件和计算机系统3个方面均存在显著性差异,结果见表1。
2.1.1 人员及培训 人员及培训方面,不同规模企业在药物警戒负责人是否专职上的差异极显著(P=0.01),60.00%大型企业的药物警戒负责人为专职,中型和小型企业的相应比例为21.88%和26.79%。在业务人员配备方面,大型企业专职人员数更多,超过3人的比例显著高于中、小型企业(P<0.01);大型企业在医学及临床药学类专业背景的人员配备上也显著多于中、小型企业(P<0.01)。
2.1.2 药物警戒文件 药物警戒文件方面,被调查企业均或多或少地建立了药物警戒相关的工作制度及操作规程,在具体文件方面,大型企业(95.00%)制定培训管理制度的比例高于中型(65.63%)和小型企业(66.07%)(P=0.03);制定委托管理及重点监测等规程也以大型企业的比例更高。
2.1.3 计算机系统 计算机系统方面,不同规模企业在是否建有药物警戒相关的计算机系统上存在极显著的差异,大型、中型和小型企业建立相关系统的比例分别为60.00%、21.88%和17.86%(P<0.01)。
2.2 药品安全性监测情况
调查分别从个例报告、定期安全性更新报告、上市后安全性研究(含重点监测)3个方面考察了被调查企业的药品安全性监测情况,不同规模企业在上述方面的差异分述如下。
2.2.1 个例报告 个例报告方面,不同规模企业在个例报告的主要收集途径上未体现差异,均以电话/热线、医疗机构、科学文献和经营企业为主要渠道,但在2019年自主报告数量上的差异极显著(P<0.01),结果见表2。
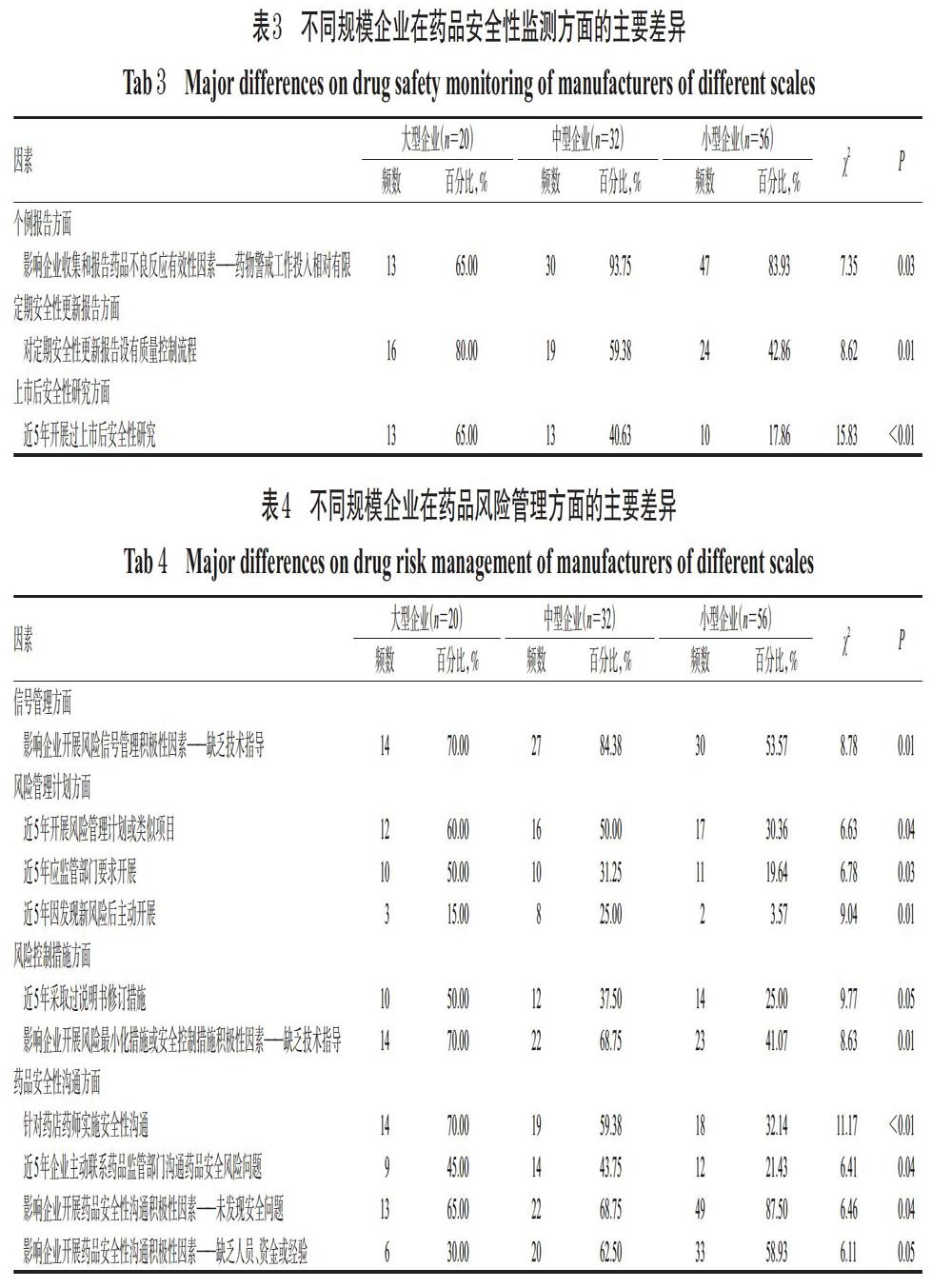
2019年自主上报报告数量在100份以上的企业有10家,其中大型企业8家、中型企业2家;中型(65.61%)和小型(92.83%)企业上报数量在20份以下的占大多数,其中43.75%的中型企业和53.57%的小型企业全年未上报个例报告。此外,在对于影响企业收集和报告有效性因素的认识上,93.75%的中型企业、83.93%的小型企业将“企业对药物警戒工作的投入相对有限”选为主要因素,大型企业对该因素的选择比例为65.00%(P=0.03),结果见表3。
2.2.2 定期安全性更新报告 定期安全性更新报告方面,被调查企业均已建立相关流程,但对包括撰写、提交、审核和质量控制在内的具体步骤进行对比时,发现80.00%的大型企业对定期安全性更新报告设有质量控制流程,而中型企业(59.38%)和小型企业(42.86%)的这一比例相对较低(P=0.01)。
2.2.3 上市后安全性研究 在上市后安全性研究(含重点监测)方面,大型企业近5年内开展过相关研究的比例最高,为65.00%,中型和小型企业的相应比例分别为40.63%和17.86%(P<0.01)。
2.3 药品风险管理情况
调查分别从信号管理、风险管理计划、风险控制措施、药品安全性沟通等方面考察了被调查企业的药品风险管理情况,结果见表4。
2.3.1 信号管理 信号管理方面,绝大多数企业能定期对所收集的药品安全性数据进行汇总分析,近一半的企业在近5年内开展过信号管理相关工作。在影响企业开展信号管理积极性的因素上,大型企业(70.00%)和中型企业(84.38%)认为“缺乏技术指导原则”因素起到重要作用的比例高于小型企业(53.57%)(P=0.01)。
2.3.2 风险管理计划 风险管理计划方面,大型企业(60.00%)和中型企业(50.00%)在近5年内开展过风险管理计划的比例高于小型企业(30.36%)(P=0.04)。从风险管理计划的启动原因看,应监管部门要求开展的比例同样以大型企业最高(50.00%),中型企业次之(31.25%),小型企業最低(19.64%)(P=0.03);因发现新风险后主动开展风险管理的比例则以中型企业最高(25.00%),大型企业次之(15.00%),小型企业仍最低(3.57%)(P=0.01)。
2.3.3 风险控制措施 风险控制措施方面,约一半的被调查企业在近5年内采取过风险控制措施,其中大多数为应监管部门要求。采取措施以“提出说明书修订措施”为主,其中大型企业(50.00%)在近5年内采取过该措施的比例高于中型企业(37.50%)和小型企业(25.00%)(P=0.05)。此外,在对于影响企业开展风险控制措施积极性因素的认识上,大型企业(70.00%)和中型企业(68.75%)认为“缺乏技术指导”因素有重要影响的比例高于小型企业(41.07%)(P=0.01)。
2.3.4 药品安全性沟通 药品安全性沟通方面,被调查企业均已实施面向不同对象的沟通活动,沟通对象按比例大小排序依次为医护人员、药店药师和患者公众,其中大型企业(70.00%)和中型企业(59.38%)针对药店药师实施安全性沟通活动的比例高于小型企业(32.14%)(P<0.01)。在对于影响企业开展药品安全性沟通积极性因素的认识上,中型企业(62.50%)和小型企业(58.93%)选择“缺乏人员、资金或经验”因素的比例高于大型企业(30.00%)(P=0.05);另有87.50%的小型企业还选择了“未发现安全问题”因素,比例高于大型企业(65.00%)和中型企业(68.75%)(P=0.04)。
3 讨论
问卷调查结果显示,不同规模企业的药物警戒工作现状不同,反映出的问题与不足也有差异。
整体来看,与中小型企业相比,大型企业的药物警戒体系较为完善,负责人专职比例高、拥有的医学及临床药学等专业人员更多、建立计算机系统的比例较高是其主要优势,相对健全的硬件、软件基础将是其药物警戒工作向纵深发展的有力保障。调查结果也显示大型企业在具体工作开展方面表现更优,个例报告上报数量更多,对于上市后安全性研究、风险管理计划、风险控制措施等关注品种风险的活动也有更高的开展比例,说明大型企业的药物警戒工作已经基本完善。但是,大型企业在“近5年因发现新风险后主动开展风险管理计划”的比例偏低(15.00%),整体在药品主动风险管理方面仍然存在欠缺。而且其在信号管理、风险控制措施等工作上选择“缺乏技术指导”作为影响工作开展因素的比例较高(均为70.00%),说明大型企业制度建设虽然完善,但是工作实施层面,尤其是需要技术支撑的某些关键药物警戒工作环节,依旧力不从心。
中型和小型企业在部分调查结果上差异不大,与大型企业存在一定差距,这可能与企业缺乏对于药物警戒的正确认识[14]、企业领导层重视不足以及工作开展的时间与经验有限[15]等因素有关。药物警戒体系方面,中型企业独立设置专门机构的比例最低(31.25%)、药物警戒负责人专职比例也最低(21.88%),小型企业稍高但差别不大。专职人员数量及专业背景等较大型企业存在一定的劣势,可能难以保障药物警戒工作的有效开展;同时,其计算机系统应用不足的情况也可能影响安全性数据处理的效率与效果。药品安全性监测方面,年报告数在100份以上的多为大型企业,中、小型企业的报告情况均不理想,年报告数低于20份的占大多数;在对于影响企业收集和报告有效性因素的认识上,中型和小型企业认为“企业对药物警戒工作投入相对有限”的比例偏高,人力物力的缺乏可能导致其信息收集途径受限[16],或人员积极性、能力不足,从而影响报告收集的广度与深度。然而,中型企业与小型企业相比,其具体工作又更有优势,显示出较大的发展潜力,如上市后安全性研究方面,中型企业的开展比例较小型企业更高,并趋近于大型企业,这说明中型企业善于借助上市后研究等途径,获取更多有效的安全性数据[17];此外,在风险管理计划、风险控制措施、药品安全性沟通等方面,中型企业的开展比例也大多与大型企业接近。
相较于大型和中型企业,小型企业的药物警戒工作现状更加堪忧。以药物警戒的基础性工作个例报告为例,参与调查的绝大多数小型企业在2019年的个例报告上报数量不足20份,其中全年零报告的比例高达53.57%,该结果可能与企业品种数量、销售情况及风险特征有关,但也能体现出小型企业报告意识及能力的欠缺。在我国药品不良反应监测工作已开展30余年后,小型企业的被动监测工作尚且不足,其对于主动监测、风险管理等工作缺乏意识及能力的情况可见一斑。除了设置了相应的部门,小型企业药物警戒相关制度建设不足,药物警戒体系较为薄弱,药物警戒具体工作情况也不容乐观,这可能使小型企业在药物警戒制度正式实施后受到更大的冲击。
4 建议
4.1 建议大型企业以有效管控品种风险为目标,主动加强药品风险管理
调查结果显示,大型企业药物警戒体系相对较为完善,整体工作也可基本满足现行法律法规的要求;然而,大型企业通常存在品种数量多、涉及适应证广、新药及高风险品种相对较多等特点,在发现风险信号时,如何更积极主动地实施风险管理计划、有效地管控品种风险应是其下一阶段工作的重点。建议大型企业围绕品种合理设计、有效实施药物警戒活动,使药品安全性监测、信号管理、风险管理计划、风险控制措施、风险沟通等活动环环相扣并取得实效,实现药品风险管理的闭环,并在工作过程中不断调整和完善药物警戒体系,确保其能持续满足工作需要。
4.2 建议中型企业继续提升主体责任意识,加强药物警戒工作的资源投入力度
调查结果显示,中型企业普遍对于药物警戒工作的重视度尚有欠缺,致使资源投入有限,这也是制约企业相关工作进一步开展的重要因素。建议中型企业继续提升主体责任意识,在此基础上,一方面应提升药物警戒体系的有效性与适用性,如优化组织结构、加强专业人员配备、提升制度可操作性、加强信息化建设等,使药物警戒体系足以支持日常工作并能满足未来需求;另一方面应加强监测能力建设,拓展报告收集途径、完善监测与报告流程、努力提升企业收集药品安全性信息的广度与深度,结合品种特点推进主动监测,为后续开展药品风险管理奠定良好基础。
4.3 建议小型企业切实提高重视程度,重点改善药物警戒体系及具体工作的合规性
当前小型企业的药物警戒体系、药品安全性监测与法律法规要求尚有差距,作为药物警戒后半程工作的风险管理更是薄弱,这可能使其在药物警戒制度正式实施后受到较大冲击;同时小型企业中不乏以创新药或高风险品种为主打产品者,这些企业作为监管部门重点关注的对象,其药物警戒工作必须加快取得实效。因此,建议小型企業从理解药物警戒理念入手,切实提高重视程度,加大资源投入,并在当前阶段重点关注药物警戒体系完善及具体工作的合规性建设,使药物警戒工作能跟上政策法规的要求和趋势,同时建议具有创新药或高风险品种的小型企业根据自身情况合理计划药物警戒发展进度。
5 结语
本研究抽样调查了江苏省不同规模药品生产企业的药物警戒工作,并对其进行对比研究,探讨不同规模企业在药物警戒工作中的现状与存在的主要问题。结果显示,与中小型企业相比,大型企业的药物警戒体系较为完善,在药品安全性监测、药品风险管理等方面也普遍优于中小型企业。中型企业对药物警戒工作主体责任意识不足,机构设置、人员配备等方面可能存在一定的欠缺。小型企业在药物警戒体系等具体工作方面仍然有较大欠缺,药物警戒工作合规性方面仍然存在较大的改进空间。
由于本次调研由各市监测中心采取方便抽样的原则抽样,可能会存在一定的调研误差。此外,由于我国药物警戒概念刚刚兴起,因此本次问卷仅对药物警戒的主要关键问题进行了调研,并未涉及药物警戒全部工作。这都有待后续研究进一步完善。
参考文献
[ 1 ] 中共中央办公厅.国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[EB/OL].(2017-10-08)[2020-04-05].http://www.gov.cn/zhengce/2017-10/08/content_5230105.htm.
[ 2 ] 国家药品监督管理局.国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告(2018年第66号)[EB/OL].(2018-09-30)[2020-04-05].http://www.cdr-adr.org.cn/xwdt/201810/t20181010_22596.html.
[ 3 ] 王丹,董铎.药品上市许可持有人直接报告不良反应制度探讨[J].中国药物警戒,2018,15(11):648-651.
[ 4 ] 任经天,郑文科,张俊华,等.生产企业在药品上市后风险管理中的重要作用[J].中国药物警戒,2014,11(2):88-93.
[ 5 ] 彭丽丽,范燕,李馨龄.浅议生产企业如何履行药品上市后安全第一责任人的职责[J].中国药物警戒,2016,13(3):159-161.
[ 6 ] 张琪,颜建周,马旭锋,等.美国药品上市后再评价法律制度实施的研究及其对我国的启示[J].中国药房,2019,30(15):2017-2022.
[ 7 ] 田克仁,高菁,缪健,等.我省药品生产企业药品不良反应监测和工作体系分析[J].中国药物警戒,2014,11(5):285-287、290.
[ 8 ] 张雪梅,郭佳栋,冯变玲,等.药品生产企业药品不良反应工作的调查研究[J].医药导报,2016,35(8):902-905.
[ 9 ] 陈新,温宝书.《药品管理法》中药物警戒制度实施的思考[J].中国药事,2019,33(11):1217-1221.
[10] 奚晓云,李国芬.美国、欧盟和日本药物警戒法规体系简介[J].药物流行病学杂志,2010,19(10):587-591.
[11] 王涛,王丹,董铎,等.美国药物警戒体系浅析及对我国的启示[J].医药导报,2017,36(4):361-365.
[12] 田峰,谢雁鸣.欧盟人用医药产品药物警戒体系译介[J].中成药,2010,32(12):2154-2157.
[13] 国家统计局.关于印发《统计上大中小微型企业划分办法(2017)》的通知[EB/OL].(2017-12-28)[2020-04-12].http://www.stats.gov.cn/tjgz/tzgb/201801/t20180103_156- 9254.html.
[14] 彭丽丽,范燕,李馨龄.浅议生产企业如何履行药品上市后安全第一责任人的职责[J].中国药物警戒,2016,13(3):159-161.
[15] 彭丽丽,范燕,刘巍,等.探讨药品生产企业如何建立药物警戒体系[J].中国药物警戒,2017,14(11):666-670.
[16] 杨悦.药品上市许可持有人直接报告不良反应制度实施问题研究[J].中国药物警戒,2019,16(11):649-653、665.
[17] 赵霞,冷美玲,王朋,等.我国药品生产企业从医疗机构收集药品不良反应信息的现状调查及对策研究[J].中国药物警戒,2018,15(11):652-657.
(收稿日期:2020-05-11 修回日期:2020-07-05)
(编辑:刘明伟)
