不同浓度左乙拉西坦对高热惊厥患儿病情复发及血清相关指标的影响*
2020-09-21张润春王玉珍李树华张静
张润春,王玉珍,李树华,张静
(唐山市妇幼保健院 河北 唐山 063000)
高热惊厥好发于<6 岁的患儿,其病情具有反复发作的特征。有文献指出,该病具有较高的复发率,高达34.8%。患儿若经历持续性或者反复性惊厥发作,将引起小儿脑组织受损,进而导致心智发育障碍,甚至出现记忆力障碍或者行为异常等神经系统疾患[1]。脑电图异常及发热是热性惊厥的前兆,患儿出现上述躯体征兆时,要及时开展针对性防治举措,可有效降低高热惊厥的发作频次,进而防治小儿脑组织受损等不良事件的发生,以此来提高生存质量[2]。左乙拉西坦是有效的抗癫痫类药品,患儿在口服药物方面具有良好的依从性,该药物的生物利用率相对较高,药物进入体内的动力学良好[3]。该药能有效治疗新生儿难治性高热惊厥,但关于该药物治疗惊厥的最佳给药剂量与浓度,临床报道相对较少。本研究旨在对左乙拉西坦的不同给药浓度进行比较研究,以进一步剖析该药物应用于小儿高热惊厥所产生的临床效果,以及借助脑电图作为工具,进一步探究该药物对脑电图相关指标的影响,以期为患儿高热惊厥的最优化给药方案提供循证依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年3月—2019年2月唐山市妇幼保健院收治的84 例高热惊厥患儿,所有患儿来院就诊期间均遵照医嘱接受相应影像学及生物化学指标检查,明确为高热惊厥。参照人民卫生出版社出版的第9 版《儿科学》教材高热惊厥的诊断标准[4]。根据左乙拉西坦的给药浓度不同[5],将纳入对象分为A、B 组[5],每组42 例。A 组男性27 例,女性15 例;年龄(3.9±0.4)岁;惊厥次数(8.4±1.2)次;单纯性高热惊厥18 例,复杂性高热惊厥24 例。B 组男性26 例,女性16 例;年龄(4.0±0.5)岁;惊厥次数(8.6±1.3)次;单纯性高热惊厥20 例,复杂性高热惊厥22 例。纳入标准: ①年龄<6 周岁;②发作时体温>39℃;③患儿家属知晓本研究并签署同意书。排除标准: ①存在颅脑损伤史;②伴有脑出血病史;③存在颅脑占位性肿块;④伴有水、电解质紊乱;⑤伴有水中毒;⑥存在先天性代谢性异常;⑦伴有神经皮肤综合征。两组患儿一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
两组患儿均接受左乙拉西坦(比利时UCB Pharma S.A.公司生产,批号H20110409)治疗,在服药期间均密切监测患儿体温。患儿出院后,随访1.5年,每3 个月随访1 次。每半年对患儿进行1 次24 h 脑电图动态监测。
1.2.1 A组患儿自接诊入院首日口服左乙拉西坦15 mg/kg,2 次/d。7 d 后逐渐减少给药剂量,第8 ~12 天将剂量减少至10 mg/kg;第13 ~15 天将剂量减少至5 mg/kg,16 d 时停止用药。
1.2.2 B组患儿自接诊入院首日口服左乙拉西坦30 mg/kg,2 次/d。7 d 后逐渐减少给药剂量,第8 ~12 天将剂量减少至10 mg/kg,第13 ~15 天将剂量减少至5 mg/kg,16 d 时停止用药。
1.3 评价指标
①两组患儿在追踪随访期间,由专人负责记录其发热频次、高热惊厥复发例数及复发频次。②利用视频脑电图等技术监测两组患儿在治疗前及治疗后6 个月的24 h 动态脑电图。③对两组患儿在治疗前及治疗后6 个月末的血清神经元特异性烯醇化酶(neuron-specific enolase, NSE)与酸性钙结合蛋白(acid calcium binding protein, S-100β)浓度进行检测。④比较两组患儿用药期间不良事件发生情况。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿发热频次、高热惊厥复发情况比较
A 组与B 组发热频次、高热惊厥复发频次比较,经t检验,差异无统计学意义(P>0.05)。A 组与B 组高热惊厥复发比例比较,经χ2检验,差异无统计学意义(P>0.05)。见表1。
2.2 两组患儿不同时间点脑电图异常发生率比较
A 组与B 组治疗前脑电图异常发生率分别为66.7%(28/42)和64.3%(27/42),经χ2检验,差异无统计学意义(χ2=0.891,P=0.157)。A 组与B 组治疗后脑电图异常发生率均为28.6%(12/42),经χ2检验,差异无统计学意义(χ2=1.073,P=0.251)。

表1 两组患儿发热频次、高热惊厥复发情况比较(n =42)
2.3 两组治疗前后NSE、S-100β 比较
两组治疗前后NSE、S-100β 的差值比较,经t检验,差异有统计学意义(t=6.520 和4.347,均P=0.000),A 组低于B 组。见表2。
2.4 两组患儿不良事件发生情况比较
A 组与B 组不良事件总发生率比较,经χ2检验,差异无统计学意义(χ2=1.278,P=0.413)。见表3。
表2 两组治疗前后NSE、S-100β 的差值比较(n=42,±s)

表2 两组治疗前后NSE、S-100β 的差值比较(n=42,±s)
组别 NSE/(μg/L) S-100β/(ng/L)A 组治疗前 10.91±2.12 0.92±0.17治疗后 9.42±2.13 0.54±0.16差值 1.49±0.13 0.38±0.04 B 组治疗前 11.12±2.23 0.94±0.18治疗后 9.39±2.09 0.50±0.17差值 1.73±0.20 0.44±0.08
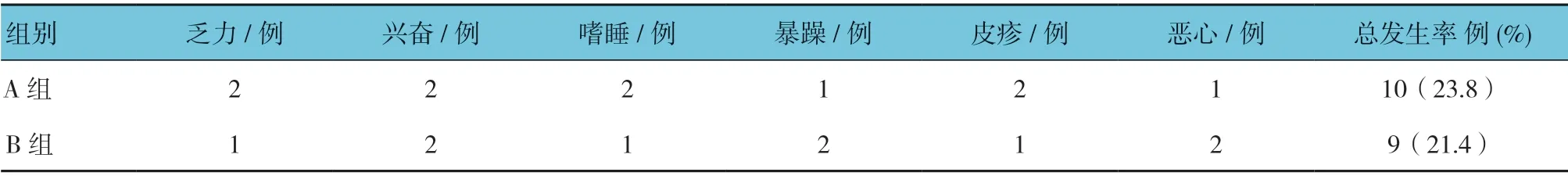
表3 两组患儿不良事件发生情况比较 (n =42)
3 讨论
患儿出现单纯性或者短阶段性质的高热惊厥不会对脑组织造成损害,如果惊厥持续性发作,将极易引起脑组织受损,进而诱发癫痫事件或者其他神经系统后遗症的出现。当前其反复发作的高热惊厥机制尚未明确,可能的发病机制为反复出现的高热惊厥诱发机体出现AMPA 通道,对脑组织中的神经元细胞钙离子信号传导渠道有所影响,使离子通道基因出现异常性表达[6];持续发作的高热惊厥将大大增加突触前大麻素受体Ⅰ的数量,从而反馈性影响γ-氨基丁酸的释放,使神经元细胞出现高度兴奋状态[7]。就患儿来说,其神经元长期处于生长发育阶段,如果出现癫痫,将影响个体的日常学习、情感状况、行为方式,不利于个体的健康成长[8]。
如果高热惊厥小儿出现病情反复发作,实施基于症状层面的对症干预,能减少癫痫的发生率[9]。苯巴比妥、地西泮与丙戊酸钠等药物在防治高热惊厥方面具有良好效果,但是上述药物所致的毒副反应亦相对明显,对小儿肾功能、肝功能与神经功能均会产生不良影响。所以,为这类患儿选择安全性更高、毒副作用更低的干预药品成为当今研究的重点课题[10]。
左乙拉西坦属于吡拉西坦衍生物,早期应用该药能有效控制癫痫发作。伴随着该药物治疗安全系数的提升,通过口服的方式能有效控制部分患儿癫痫的发作。该药极易溶于水剂,不易与血浆蛋白相结合,进入人体后不需经过肝脏代谢,主要通过乙酰胺水解酶的代谢方式,其产物不具备药理活性,由肾脏直接排除体外,所以该药物对人体的肝脏与肾脏无明显毒副作用[11]。有文献指出,左乙拉西坦能透过人体的血脑屏障,直接进入大脑的脑皮质与海马区,从而有效抑制癫痫的放电效应[12]。关于左乙拉西坦给药浓度的研究,有学者在动物身上开展过大量实验,高浓度给药组与低浓度给药组在改善高热惊厥复发率方面无差异[13]。本研究数据表明,两组患儿治疗有效率、发热频次、惊厥复发率、复发次数及脑电图异常发生率比较无差异,表明不同给药浓度的左乙拉西坦防治高热惊厥的效果大致相当。分析可能的原因在于左乙拉西坦口服给药后,能被人体快速吸收,能有效抑制癫痫的放电状态,其生物利用度高达100%。该药物进入人体后的血药浓度达到一定浓度时,其临床疗效已趋向于最佳水平,再增加给药剂量也不会明显提高疗效[14-15]。
血清相关指标NSE、S-100β 属于大脑损伤敏感性标志物,若大脑神经中枢受损,将使上述2 项指标出现异常升高[16]。本研究数据表明,两组患儿的上述指标相较于治疗前有一定下降,但是两组比较无差异。表明左乙拉西坦在防治大脑神经元受损方面具有一定效果,而2 种不同给药浓度的干预效果接近,但是其具体的发病机制是否与上述2 项指标有关仍不清楚,还需后续临床及动物实验研究予以明确。本研究数据还表明,两组患儿不良事件的总发生率比较无差异,这表明不同给药浓度的左乙拉西坦在治疗高热惊厥患儿方面的效果基本一致。
综上所述,左乙拉西坦能有效防治高热惊厥,且能降低异常脑电图的发生率,但是给药浓度的高低对临床疗效无明显影响。本研究在设计上仍存有一定缺陷,不同剂量的分组数较少,纳入的病例数相对有限,且尚未对左乙拉西坦的治疗安全性与其他药物展开多元化比较,所以还需在后续研究中进一步增大病例数,使结论更具科学性。
