MnFe2O4@硅藻土复合材料的制备与染料去除性能研究
2020-09-18宋俊颖黄占斌
宋俊颖,黄占斌
中国矿业大学(北京)化学与环境工程学院,北京 100083
水污染给人类带来了巨大威胁,已成为疾病、死亡和自然灾害的主要原因之一[1-3]。染料、纸浆、纺织及其他类似行业可排放大量有色污水,这些污染物的排放带来严重的环境问题和视觉问题,且水中染料可阻止阳光透入水面,影响水生植物的光合作用[4-5]。孔雀石绿(MG)是一种阳离子染料,广泛应用于上述行业。研究表明,过量的MG可导致人体肾脏、骨骼、肝脏和白细胞功能受损[6-7]。因此,对此类有机染料污染的去除已迫在眉睫。吸附法是去除水中污染物的有效方法,易于操作,然而吸附效率通常受吸附材料性质的限制[8-9]。因此,探索低成本且能高效去除染料污染的材料具有重要意义。
在众多吸附材料中,铁锰氧化物是一种磁性纳米材料,因其制备简单、环境友好、易于回收[10]、有较高的化学活性而常被用作吸附剂,对多种有机物均具有很强的吸附能力[11-12]。但纳米铁锰氧化物容易团聚,不具备良好的孔结构,极大地限制了其在污染处理领域的进一步应用。因此,为铁锰氧化物寻找可以降低其团聚现象且成本低的载体成为研究热点[10,13-14]。硅藻土是一种典型的矿物材料,储量丰富,来源广泛且成本低[15-16],其主要成分是硅藻,具有丰富的微孔和中孔结构,并且硅藻土表面一般呈负电性,有利于对阳离子污染物的吸附,是理想的载体材料[17-19]。本研究所用硅藻土取自江苏宜兴,其主要成分为SiO2,含有少量的Al2O3、Fe2O3、CaO、MgO及有机质,价格低廉,有丰富的孔结构,具有广泛的应用前景。
综上,硅藻土可以作为优良的载体与铁锰氧化物复合形成新型复合材料,不仅可解决单一材料在实际应用中存在问题,而且复合材料兼具硅藻土的低成本、多孔结构及铁锰氧化物的高化学活性、磁性、易于回收等优点,在环境污染物去除过程中有较好的功能互补和协同效应。虽然对于铁锰氧化物及硅藻土已有相关研究,但本文提出的复合材料吸附剂的简易制备方法,以及该复合材料对有机染料孔雀石绿(MG)吸附性能的系统研究尚无报道。
在本研究中,MnFe2O4纳米粒子通过化学方法成功固定并分散在硅藻土表面上,采用扫描电子显微镜(SEM)、X射线衍射(XRD)、傅里叶变换红外光谱(FT-IR)、能量色散X射线光谱(EDS)、Zeta电位及氮吸附-解吸等温线对制备的复合材料进行表征,并系统地研究了该复合材料对有机染料孔雀石绿(MG)的吸附性能,分析初始pH值、吸附剂投加量、反应时间、MG初始浓度、温度等对该复合材料吸附MG过程的影响,探讨可能的吸附机理,并通过再生试验研究了复合材料的稳定性。试验结果表明,MnFe2O4@DE复合材料有效提高了对MG的吸附性能。本研究的MnFe2O4@DE复合材料制备方法简单,对矿物材料基复合材料吸附剂的制备及其在废水处理领域的应用和发展具有较高的参考价值。
1 材料与方法
1.1 材 料
本文所用试剂均为分析纯,孔雀石绿(MG)、FeCl3·6H2O、MnCl2·4H2O、HCl、氨水等化学试剂均购自北京易秀博谷生物科技有限公司。硅藻土取自江苏宜兴,主要成分为SiO2,含有少量的Al2O3、Fe2O3、CaO、MgO及有机质。用一定量的孔雀石绿配制MG(200 mg/L)储备液。在随后的吸附试验中,将储备溶液用去离子水稀释不同倍数以获得不同的初始浓度(10~200 mg/L)。
1.2 MnFe2O4@DE的制备
将1.41 g的FeCl3·6H2O加入50 mL去离子水中搅拌至溶解,随后加入1.50 g硅藻土磁力搅拌0.5 h;再向混合液中逐滴加入20 mL含有0.525 g MnCl2·4H2O的水溶液,继续搅拌0.5 h;随后用氨水调节pH值为10.00,在80 ℃条件下持续磁力搅拌3 h,将混合液过滤,用去离子水洗涤至溶液呈中性;在烘箱中105 ℃烘干后,得到MnFe2O4@DE复合材料。
通过上述方法不添加硅藻土制备MnFe2O4,并通过如下方法合成物理混合样品(MnFe2O4+DE)作为对比样品:将0.60 g MnFe2O4和1.50 g硅藻土加入到80 mL水中,在室温下连续搅拌5 h,过滤并干燥后得到物理混合物,并将其标记为MnFe2O4+DE。
1.3 分析测试
通过D8 XRD(Bruker,Germany)粉末衍射仪和Thermofisher Nicolet 6700 FTIR(USA)光谱仪分析测试复合材料结晶相和化学组成。在4 000~400 cm-1的范围内,使用扫描电子显微镜(SEM,S-4800 Hitachi,Japan)和能量色散X射线光谱仪(EDS,Japan)观察所制备的吸附剂的形态和主要元素分布。使用Brunauer-Emmett-Teller(BET)方法评估在恒定体积吸附装置(JW-BK,JWGB Sci.& Tech.,China)上通过N2吸附获得的比表面积。使用Malvern ZEN 3600 Zetasizer(UK)测量不同pH值下MnFe2O4@DE的Zeta电位。
1.4 吸附试验
先研究了pH值对MnFe2O4@DE吸附行为的影响,用0.2 mol/L的HCl和NaOH调节pH值,随后在最佳pH值下进行了其他因素(吸附剂投加量、反应时间、MG初始浓度及温度等)影响试验。动力学试验中将25 mL MG溶液置于50 mL离心管中,加入0.05 g MnFe2O4@DE并在恒温振荡器中振荡,根据预定的时间间隔取出样品并用离心机(8 000 r/m)分离上清液,随后用UV-可见分光光度计(UV-9000S,China)测上清液中MG浓度。吸附剂的吸附容量通过下式计算:
(1)
式中,qe为平衡时的吸附容量,mg/g;C0、Ce分别为污染物的初始浓度和平衡浓度,mg/L;V为含MG溶液的体积,L;M为吸附剂的投加量,g。
取0.05 g吸附剂加入不同初始浓度的25 mL MG溶液中(2 g/L),并在288 K、298 K、308 K和318 K 4个温度下探究等温吸附及吸附热力学特征。所有实验均做3个平行样,最后对复合材料进行再生试验。
2 结果与讨论
2.1 复合材料的特征分析
2.1.1 XRD 及 FTIR 分析
硅藻土、MnFe2O4及MnFe2O4@DE的XRD图谱如图1(a)所示,MnFe2O4的衍射峰与标准立方尖晶石MnFe2O4(JCPDS 74-2403)很好地吻合,2θ为29.64°、35.62°、42.44°、52.63°、57.32°和63.43°处的衍射峰属于MnFe2O4的晶面特征峰[20],显示MnFe2O4颗粒的高度结晶结构。在硅藻土图谱中可以发现,2θ=15° 到2θ=30°的宽衍射峰,是无定形蛋白石的典型特征峰,26.67°处的窄尖峰是石英的特征峰。在MnFe2O4@DE图谱中,位于35.62°、57.32°和63.43°处较弱的衍射峰与MnFe2O4相应特征峰吻合,这说明了MnFe2O4以低晶体结构存在[21],并且MnFe2O4@DE图谱中2θ=15° 到 2θ=30°处出现的宽峰表明硅藻土的存在。
图1(b)所示为DE、MnFe2O4和MnFe2O4@DE的红外光谱图。所有样品在3 431 cm-1和1 630 cm-1处显示的宽吸附峰,是由材料表面羟基和吸附水分子中的特征羟基(—OH)伸展振动和H—O—H的弯曲振动所引起的[22-23]。MnFe2O4在573 cm-1处的吸收带是Mn—O和Fe—O伸缩振动引起的[20,24]。在MnFe2O4@DE光谱中,在565 cm-1处出现的吸收带是由MnFe2O4的特征振动引起的[25-26]。在DE和MnFe2O4@DE光谱中,1 098 cm-1和470 cm-1附近出现的峰是属于Si—O—Si和O—Si—O键的不对称拉伸振动,这是DE的特征。此外,Si—O—Si对称拉伸振动出现在DE图谱802 cm-1附近[27-28]。以上结果均证实MnFe2O4成功沉积在硅藻土表面,与XRD分析结果一致。

图1 样品的XRD 及 FTIR 图Fig.1 XRD pattern and FTIR spectra of samples
2.1.2 SEM 分析
如图2(a)所示,硅藻土呈现圆盘状,直径为25~35 μm,表面光滑且具有较多的孔洞,此结构有益于纳米MnFe2O4颗粒的分散。图2(b)显示,MnFe2O4的结构为粒状纳米颗粒,这些颗粒之间存在磁偶极相互作用及范德华力等强烈的相互作用,导致MnFe2O4出现团聚现象,使其比表面积减小且不利于吸附。从图2(c)MnFe2O4@DE的SEM的图像可以看出,粒状的MnFe2O4纳米颗粒均匀分散在硅藻土载体表面,因此硅藻土的引入可有效地解决MnFe2O4的团聚问题。而且MnFe2O4纳米颗粒在DE表面和孔隙中的分布可以构成大量的微孔结构,从而使复合材料的比表面积增加,进一步提高复合材料的吸附性能[29]。另外,将MnFe2O4与硅藻土结合可以有效降低单独以MnFe2O4作为吸附剂时的成本,有助于此类吸附剂的推广应用。图2(d)为MnFe2O4@DE的能量色散X射线光谱(EDS)图。EDS分析显示,在MnFe2O4@DE复合材料中,O、Si、Fe和Mn的质量分数分别为41.78%、24.75%、14.64%和9.83 %,这与MnFe2O4的理论元素比一致。EDS分析进一步证实了MnFe2O4@DE的成功合成。

图2 不同材料的SEM图及EDS分析Fig.2 SEM images and EDS spectrum of different materials
从图3可以清楚地看出,基于元素的信号强度,Si、 O、 Mn和Fe均匀分布在复合材料中,这进一步证明了MnFe2O4@DE复合材料中MnFe2O4纳米颗粒在硅藻土表面均匀分布。

图3 MnFe2O4@DE复合材料中的Si、O、Mn、Fe的面扫元素分布图及对应的原始图像Fig.3 Element mapping of Si,O,Mn and Fe for MnFe2O4@DE composite and the corresponding images
2.1.3 BET 分析
采用BET分析研究了MnFe2O4@DE、MnFe2O4和DE的比表面积和孔隙特征。N2吸附-解吸等温线及不同样品的BJH孔径分布如图4所示。从图4(a)可以看出,MnFe2O4@DE、MnFe2O4和DE的吸附-解吸等温线为Ⅳ型且具有H1磁滞回线的等温线,这是介孔材料的特征[30]。从图4(b)可以看出,MnFe2O4@DE复合材料主要孔径范围为2~20 nm,属于介孔孔径分布特征,此类孔结构特征有利于对污染物分子的吸附。

图4 不同材料的N2吸附解吸等温线及BJH 孔径分布Fig.4 N2 adsorption-desorption isotherms and BJH pore size distribution of different materials
表1总结了提纯DE、MnFe2O4和MnFe2O4@DE的比表面积和孔特性。从表中可以看出,MnFe2O4@DE具有更大的比表面积(112.1 m2/g)和孔体积(0.24 cm3/g)以及比DE和MnFe2O4更小的平均孔径(4.1nm)。这主要是因为MnFe2O4纳米粒子能够很好地分散在硅藻土表面,抑制了自身的团聚现象,还可以在硅藻土上形成微孔结构从而增加了比表面积和孔体积,可为吸附污染物分子提供更多的表面活性位点,有利于复合材料对污染物吸附性能的提升。

表1 样品表面及结构表征Tab.1 Surface and structural characterizations of samples
2.2 吸附试验
2.2.1 pH值对吸附的影响
溶液的pH值是吸附过程中非常重要的参数,因为它可以改变吸附剂的表面电性。由图5可以看出,随着pH值的增加吸附剂对MG的去除率先逐渐增加随后达到相对稳定,其中在pH=6时复合材料对MG的去除率最高(80%±2.7%)。很明显,初始pH值对吸附过程有很大影响,故本研究对MG的所有吸附实验均在pH=6时进行。

图5 pH值对MnFe2O4@DE去除MG效率的影响Fig.5 Effect of pH on MG removal by MnFe2O4@DE
为进一步探讨吸附机理,在不同pH值下测定MnFe2O4@DE的Zeta电位。从图6可以看出,随着pH值的升高,Zeta电位逐渐降低,且MnFe2O4@DE在pH值约为3.3时达到等电点,pH<3.3时复合材料表面带正电,pH>3.3时材料表面带负电。图5表明,随着pH值增加,MnFe2O4@DE对阳离子染料(MG)的去除率增加,直至达到平衡。这是因为pH>3.3时由于静电吸引,阳离子染料可容易地吸附在复合材料带负电的表面上,直到吸附剂的活性位点被完全占据。

图6 MnFe2O4@DE的Zeta电位与pH值的关系Fig.6 Relationship between zeta potential and pH values of MnFe2O4@DE
2.2.2 吸附剂投加量对吸附的影响
在最佳pH值(pH=6)条件下,探究了吸附剂投加量对MG去除率的影响。从图7中可以看出,随着MnFe2O4@DE投加量的增加,MG的去除率也逐渐增加;当投加量为0.4~2 g/L时,MG的去除率从66.46%±1.0%迅速增加到91.79%±1.3%;当MnFe2O4@DE投加量为2~4 g/L时,MG去除率的增速变缓,从91.79%±1.3%增加到97.39%±0.8%。考虑到吸附剂的成本及吸附效果等因素,所有接下来的吸附试验均使用2 g/L的吸附剂投加量。
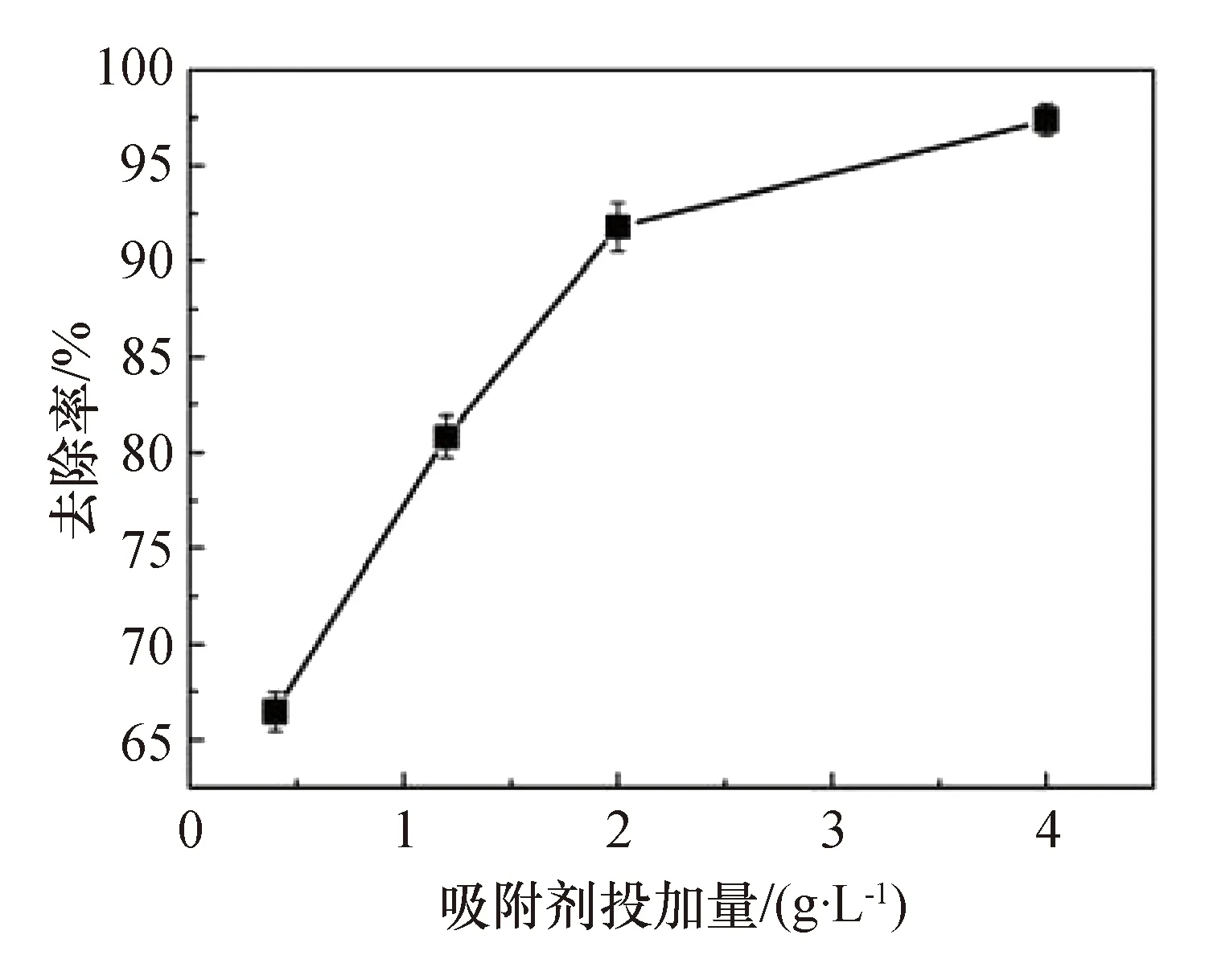
图7 吸附剂投加量对MG去除率的影响Fig.7 Effect of MnFe2O4@DE dose on MG removal
2.2.3 吸附动力学
MnFe2O4@DE、MnFe2O4+DE、DE和MnFe2O4对MG的吸附时间(t)与吸附容量(Qt)之间的关
系,如图8(a)所示。从图8(a)可以看出,在前5 min内吸附MG很快,随后达到平衡。初始阶段的快速吸附过程,可能是由于MnFe2O4@DE表面存在大量的可用活性位点。随着反应的进行,吸附速率逐渐降低,原因有两个:一是污染物分子可以通过多孔MnFe2O4@DE复合材料内部孔隙的活性位点进一步吸附,这个过程比被表面活性位点直接吸附需要更久的时间;二是材料上已经吸附的阳离子染料分子会对其他分子产生排斥力。与MnFe2O4、DE和MnFe2O4+DE样品相比,MnFe2O4@DE具有最高的平衡吸附量,说明MnFe2O4在DE上的化学沉积对吸附能力的提高起着至关重要的作用。此外,MnFe2O4@DE对MG的平衡吸附容量分别是DE、MnFe2O4和MnFe2O4+DE样品的1.89倍、1.13倍和1.35倍,其主要原因是本合成方法使硅藻土与MnFe2O4纳米颗粒结合而获得比DE、MnFe2O4和MnFe2O4+DE更大的比表面积和孔体积,有利于提高吸附能力,这与BET分析的结果一致。
为进一步探究MG在MnFe2O4@DE上的吸附机理,本文采用了伪一级动力学和伪二级动力学模型。
伪一级动力学模型的形式通常表示为
ln(Qe-Qt)=lnQe-k1t
(2)
伪二级动力学模型的线性形式为
(3)
式中,Qe表示平衡时吸附剂吸附的污染物量,mg/g;Qt表示在时间t吸附剂吸附的污染物量,mg/g;t是反应时间,min;k1和k2表示伪一级和伪二级动力学的速率常数(见表2)。
通过ln(Qe-Qt)对t来确定k1值,通过(t/Qt)对t的关系曲线[图8(b)]来确定k2值。
表2列出伪一级和伪二级模型的动力学参数,通过比较两个模型的R2可知MG在MnFe2O4@DE上的吸附动力学数据与伪二级模型吻合,表明化学吸附是吸附过程的主要限速步骤[31]。此外,从伪二级模型得到的Qe,cal值与实验数据Qe,exp吻合良好,进一步证实了伪二级模型的适用性。

表2 吸附MG的伪一级及伪二级动力学参数
2.2.4 等温吸附特征
本文采用Langmuir和Freundlich两个常见的等温吸附模型,系统分析了MnFe2O4@DE对MG的吸附平衡特征。
Langmuir等温吸附模型用于研究吸附剂表面上完整单层覆盖的最大吸附容量。因此,吸附与范德华力及吸附剂的表面积等密切相关。Langmuir方程通常表示为
(4)
式中,Qe为单位质量吸附剂吸附污染物的量,mg/g;Ce为吸附过程达到平衡时剩余污染物的浓度,mg/L;Qm为样品的最大吸附容量,mg/g;KL为Langmuir常数,L/mg。
Qm和KL的值可以通过Ce/Qe与Ce的线性图的斜率和截距来计算,如图9(b)所示。
考虑到异质表面和无限表面覆盖,采用Freundlich经验模型进一步分析平衡数据,Freundlich方程的线性形式可以写成:
(5)
式中,KF是吸附容量参数,mg1-1/nL1/ng-1;1/n为吸附强度,无量纲。
如果n>1,则可以在吸附剂表面产生新的吸附且吸附过程可以顺利进行。KF和n可以通过lnQe对lnCe的线性图的截距和斜率来计算[图9(c)]。
等温吸附线可以评价吸附剂的最大吸附容量,并描述吸附剂与污染物之间的相互作用。图9(a)列出4种不同温度下MnFe2O4@DE的等温吸附线,发现随着Ce(mg/L)的增加,MnFe2O4@DE对MG的吸附容量上升,直至达到最大吸附容量。随着温度的升高吸附容量增加,表明吸附过程是吸热的。

图9 MnFe2O4@DE在不同温度下吸附MG的等温线Fig.9 Isotherms for MG adsorbed by MnFe2O4@DE at four different temperatures
不同温度下的Langmuir和Freundlich等温线参数列于表3中。Langmuir模型的相关系数(R2)值高于Freundlich模型,表明MnFe2O4@DE对MG的吸附过程更符合Langmuir模型,即复合材料对MG的吸附属于均相和单层吸附。由表3可以看出,随着温度的升高,吸附容量变大,再次证明吸附过程是吸热的。Freundlich常数n值在4个温度下均大于1,表明MG在MnFe2O4@DE上的优先吸附过程。此外,MnFe2O4@DE对MG的最大吸附容量为25.70 mg/g。
表4进一步展示了现有研究中去除MG的不同吸附剂的最大吸附容量。由于实验条件和吸附剂材料的不同,很难直接比较不同吸附剂之间的吸附能力,本研究中合成的MnFe2O4@DE复合材料吸附剂仍具有较强竞争力,是一种很有潜力的阳离子染料吸附剂。
2.2.5 吸附热力学特征
与吸附过程相关的热力学参数标准焓(ΔH)、标准熵(ΔS)及标准吉布斯自由能(ΔG)的变化计算如下:
(6)
ΔG=ΔH-TΔS
(7)
(8)
式中,R为通用气体常数,8.314 J/kmol;T为溶液的绝对温度,K;Kd为分配系数。
lnKd与1/T线性拟合的斜率和截距分别用于确定标准焓(ΔH)和标准熵(ΔS)的值(表5)。
从表5中可以看出,ΔH均为正值,表明在封闭系统及恒压条件下吸附过程是吸热的;ΔS为正值,说明在孤立系统条件下固液界面的无序性增加,也表明了MnFe2O4@DE吸附剂对MG的亲和力;ΔG为负值,表明在封闭系统、恒温恒压条件下吸附是自发和可行的。另外,ΔG值随温度升高绝对值越来越大,表明在封闭系统、恒温恒压条件下,吸附驱动力随温度升高而增加,因此较高的温度有利于吸附过程,并且MG的初始浓度越高其ΔG值越大。
2.2.6 再生试验
对MnFe2O4@DE进行再生试验,每次控制相同条件对其吸附MG的性能进行考察,实验结果如图10所示。图10(a)表明,复合材料再生使用4次后,MG的去除率仅有小幅下降,仍对MG溶液具有87.56%的去除率,说明MnFe2O4@DE复合材料具有较好的再生使用性能。另外,再生试验前后MnFe2O4@DE的XRD图谱基本没有变化,说明本研究所制备的复合材料吸附剂的结构具有很好的稳定性,如图10(b)所示。

图10 MnFe2O4@DE吸附MG的再生性能Fig.10 Reusability of MnFe2O4@DE
3 结 论
通过本研究方法合成的MnFe2O4@DE是一种有潜力去除废水中的阳离子染料吸附剂。MnFe2O4@DE有效地降低了纳米MnFe2O4的团聚,提高了复合材料的吸附性能。
MnFe2O4@DE对MG的吸附等温线符合Langmuir等温模型,最大吸附容量为25.70 mg/g,分别是硅藻土(DE)和MnFe2O4的1.89倍和1.13倍,且吸附过程与伪二级动力学模型吻合良好,吸附过程是吸热和自发的。
当pH=6且吸附剂投加量为2 g/L时,复合材料对MG的去除率可达91.79%±1.3%。相较其他对照材料,MnFe2O4@DE复合材料具有最大的吸附能力,这是因为在本研究合成方法下,复合材料获得比单体材料更大的比表面积和孔体积,能为MG的吸附提供更多的活性位点,从而表现出较高的吸附性能并且MnFe2O4@DE复合材料与MG之间存在较强的静电吸附作用,也增强了复合材料对MG的吸附作用。
再生试验表明MnFe2O4@DE重复使用4次仍对MG溶液具有 87.56%的去除率。
因此,MnFe2O4@DE复合材料的制备方法简易,对其他矿物材料基复合材料的制备具有较好的参考价值,在染料污染治理领域具有较好的应用潜力。
