儿童肾母细胞瘤国际及国内诊治方案解读
2020-09-18王金湖蔡嘉斌李民驹
王金湖 蔡嘉斌 李民驹 舒 强
肾母细胞瘤(Wilms tumor,WT)也称肾胚瘤(nephroblastoma),是儿童最常见的肾脏恶性肿瘤,发病率在儿童原发性腹腔恶性肿瘤中居第二位,仅次于神经母细胞瘤。1899年Max Wilms首次详细描述了该病的病因、组织学结构和分类,因此国际上将此肿瘤称为Wilms瘤。约75%的肾母细胞瘤发生在5岁以前,2~3岁是发病高峰年龄。男女发病率相当,但女童发病年龄偏大[1]。过去,肾母细胞瘤患者的远期生存率低于30%,现已超过90%。COG(Children’s Oncology Group,儿童肿瘤协作组)和SIOP(International Society of Paediatric Oncology,国际儿童肿瘤学会)两大儿童肿瘤研究的国际协作组织分别有各自的诊疗方案。本文将重点介绍COG方案和SIOP方案的异同,进一步解读中国儿童肾母细胞瘤诊疗共识,分析中国的诊疗现状,供广大临床医师参考和借鉴。
一、肾母细胞瘤的临床表现及诊断
(一)临床表现及诊断
大多数肾母细胞瘤患儿表现为无症状的腹部肿块。约40%表现为腹痛,约18%出现肉眼血尿,约24%出现镜下血尿。20%~25%的患儿会出现高血压,这是由于肾素-血管紧张素系统激活所致。约10%出现厌食和体重下降,约15%出现肺转移。少数病例可有尿道下裂、无虹膜症、发育迟缓、隐睾、假两性畸形等相关综合征症状。
肾母细胞瘤和其他儿童肾肿瘤的诊断与检查内容包括体检结果及病史、血常规、尿常规、肝肾功能、腹部超声、腹部增强CT或磁共振、胸部X线片或CT扫描。胸部CT扫描是诊断转移性肺结节最灵敏的方法。必要时可行全身正电子发射计算机断层显像(positron emission tomography-computed tomography,PET-CT)检查,可显示肿瘤和转移灶18F-FDG高摄取。
(二)肾母细胞瘤的基因组学及相关综合征
大多数肾母细胞瘤为散发性。约5%的肾母细胞瘤患者存在位于染色体11p13的WT1基因突变或染色体11p15的WT2基因表观遗传缺陷[2]。
1.WT1相关综合征
(1) WAGR综合征。WAGR综合征以肾母细胞瘤、无虹膜症、泌尿生殖系统异常和智力低下为特征,在单侧肾母细胞瘤患儿中发生率约为0.4%,双侧肾母细胞瘤中发生率约为15%。
(2) Denys-Drash综合征和Frasier综合征。Denys-Drash综合征包括假两性畸形和(或)肾病(肾小球肾炎或肾病综合症)以及肾母细胞瘤倾向。Frasier综合征包括男性假两性畸形、原发性闭经、慢性肾功能衰竭及其他异常。这两个综合征均与WT1基因突变有关。
2.WT2相关综合征
Beckwith-Wiedemann综合征,包括巨舌症、巨体症(出生体重和长度大于第90百分位)、中线腹壁缺损(脐膨出、脐疝、腹直肌分离)、耳痕以及新生儿低血糖。可伴发双侧肾母细胞瘤,横纹肌肉瘤或肝母细胞瘤。该综合征是由于WT2基因的印记缺失或杂合性缺失所致[3]。
3. 其他基因和染色体的改变
与肾母细胞瘤发病和生物学相关的其他基因和染色体改变包括:
(1)1q。染色体1q的扩增与预后不良有关,是最有力的预后预测因子。约30%的肿瘤存在1q染色体的扩增。有1q扩增的患者生存率明显低于无1q扩增的患者[4]。
(2)1p和16q。染色体1p和16q的杂合性缺失在肾母细胞瘤病例中分别占17%和11%。这些基因位点特异性缺失的患者无事件生存率和总生存率明显较低。在当前COG研究中,对16q和1p联合缺失的FH型Wilms瘤患者进行了更积极的治疗[5]。
(3)TP53。TP53抑癌基因突变是一种不良的预后标志。间变型肾母细胞瘤患者大多存在TP53突变[6]。
二、肾母细胞瘤的组织学分类、临床分期和危险度分组
典型的肾母细胞瘤表现为上皮细胞、间叶组织和胚芽组织成分的三相性。每个肿瘤的上皮细胞、间叶组织和胚芽成分的相对比例可能相差很大,其中一种成分可能占主导地位。
肾源性残留(nephrogenic rests)是残留的肾胚胎细胞簇,被认为是Wilms瘤的前体。肾源性残留见于35%~40%的单侧Wilms瘤和90%的双侧Wilms瘤患者。肾源性残留常与多种综合征或先天异常有关,如生长过度综合征(偏侧肥大和Beckwith-Wiedemann综合征)、Denys-Drash综合征和WAG综合征。肾源性残留的两种主要类型是叶周型和叶内型。多灶性或弥漫性肾源性残留被称为肾母细胞瘤病(nephroblastomatosis)。肾源性残留完全替代肾叶或肾皮质称为全叶性肾母细胞瘤病,是肾母细胞瘤发生的高危因素[7]。
(一)COG的肾母细胞瘤组织学分类、临床分期和危险度分组
COG按照有无间变将肾母细胞瘤的组织学类型分为两大类,即预后良好型组织学(favorable histology,FH);预后不良型组织学(unfavorable histology,UH),也称间变型(anaplastic histology,AH)[8]。间变是指细胞明显异常,三极或多极有丝分裂,核嗜铬和核扩大,细胞核直径至少是相邻非间变细胞核的3倍。间变型在肾母细胞瘤病例中约占10%。年龄较大患者间变型发生率较高。间变型又可分为局灶间变型与弥漫间变型。局灶间变型是指原发肿瘤内有一个或几个界限清楚的局灶性间变区域,但大部分肿瘤无明显的核异型性。弥漫间变型则是指多个区域的间变。间变型对化疗的应答较差,具有重要的临床意义。局灶性间变型的预后介于良好组织学和弥漫性间变型之间。
COG根据初期手术时(化疗前)的临床、手术和病理信息以及影像学上有无远处转移,将肾母细胞瘤分为Ⅰ~Ⅴ期(表1)[8,9]。肿瘤组织学指标是最重要的预后评估指标,高危肾肿瘤包括间变型肾母细胞瘤。临床分期则是第二重要的因素,风险分组的其他因素包括患者年龄、肿瘤重量、1p和16q杂合性缺失。基于这些因素,COG将包括肾母细胞瘤的儿童肾恶性肿瘤分为5个风险组:极低危组、低危组、中危组、较高危组织学良好组和高危组(表2)[10]。
(二)SIOP的肾母细胞瘤组织学分类、临床分期和危险度分组
SIOP分期是根据经术前化疗后的手术标本病理信息、术前化疗(新辅助化疗)前影像学检查有无转移而决定的,其优点是可评估对术前化疗的组织学应答(包括识别胚芽型肾母细胞瘤的高危组)[11]。SIOP也将肾母细胞瘤分为Ⅰ~Ⅴ期,表1系统对比了当前COG与SIOP肾母细胞瘤分期系统的异同。在COG分类系统,如果进行术前活检,则无论是细针抽吸活检、芯针活检或开放活检者均判定为Ⅲ期。而SIOP系统中,细针抽吸活检或芯针活检并不作为肿瘤升期的标准,只有手术活检(楔形切除活检)者才升为Ⅲ期。
SIOP根据初期化疗后手术所取的肿瘤标本进行组织学分类,可反映术前化疗引起的变化,包括退行性变与细胞分化。将肾母细胞瘤的组织学分类分为三个风险组: ①低危组(完全坏死的肾母细胞瘤或囊性部分分化的肾母细胞瘤); ②中危组(退化型、上皮型、间叶型、混合型或局灶间变型肾母细胞瘤); ③高危组(胚芽型或弥漫间变型肾母细胞瘤)[11]。详见表3。
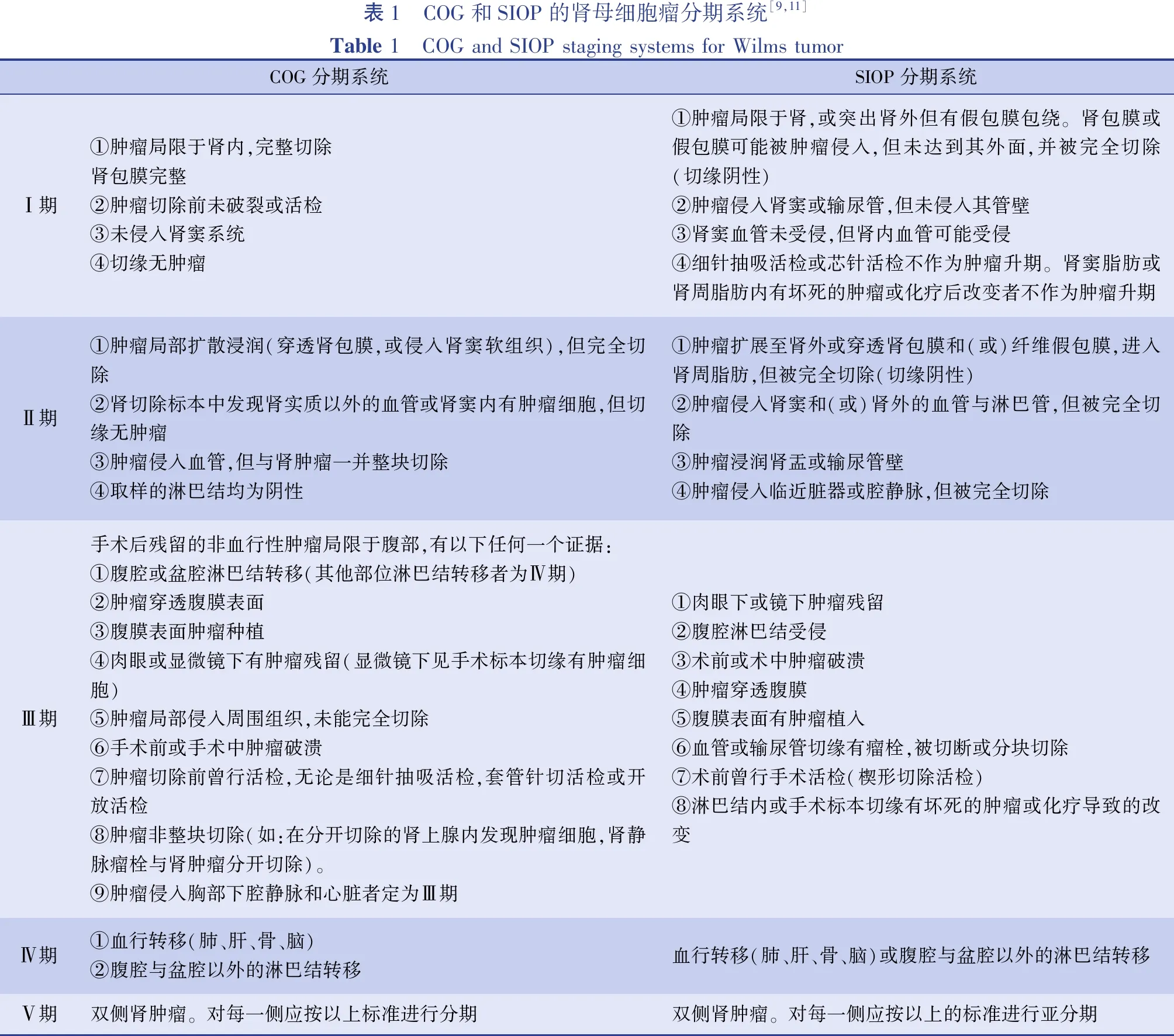
表1 COG和SIOP的肾母细胞瘤分期系统[9,11]Table 1 COG and SIOP staging systems for Wilms tumorCOG分期系统SIOP分期系统Ⅰ期①肿瘤局限于肾内,完整切除肾包膜完整②肿瘤切除前未破裂或活检③未侵入肾窦系统④切缘无肿瘤①肿瘤局限于肾,或突出肾外但有假包膜包绕。肾包膜或假包膜可能被肿瘤侵入,但未达到其外面,并被完全切除(切缘阴性)②肿瘤侵入肾窦或输尿管,但未侵入其管壁③肾窦血管未受侵,但肾内血管可能受侵④细针抽吸活检或芯针活检不作为肿瘤升期。肾窦脂肪或肾周脂肪内有坏死的肿瘤或化疗后改变者不作为肿瘤升期Ⅱ期①肿瘤局部扩散浸润(穿透肾包膜,或侵入肾窦软组织),但完全切除②肾切除标本中发现肾实质以外的血管或肾窦内有肿瘤细胞,但切缘无肿瘤③肿瘤侵入血管,但与肾肿瘤一并整块切除④取样的淋巴结均为阴性①肿瘤扩展至肾外或穿透肾包膜和(或)纤维假包膜,进入肾周脂肪,但被完全切除(切缘阴性)②肿瘤侵入肾窦和(或)肾外的血管与淋巴管,但被完全切除③肿瘤浸润肾盂或输尿管壁④肿瘤侵入临近脏器或腔静脉,但被完全切除Ⅲ期手术后残留的非血行性肿瘤局限于腹部,有以下任何一个证据:①腹腔或盆腔淋巴结转移(其他部位淋巴结转移者为Ⅳ期)②肿瘤穿透腹膜表面③腹膜表面肿瘤种植④肉眼或显微镜下有肿瘤残留(显微镜下见手术标本切缘有肿瘤细胞)⑤肿瘤局部侵入周围组织,未能完全切除⑥手术前或手术中肿瘤破溃⑦肿瘤切除前曾行活检,无论是细针抽吸活检,套管针切活检或开放活检⑧肿瘤非整块切除(如:在分开切除的肾上腺内发现肿瘤细胞,肾静脉瘤栓与肾肿瘤分开切除)。⑨肿瘤侵入胸部下腔静脉和心脏者定为Ⅲ期①肉眼下或镜下肿瘤残留②腹腔淋巴结受侵③术前或术中肿瘤破溃④肿瘤穿透腹膜⑤腹膜表面有肿瘤植入⑥血管或输尿管切缘有瘤栓,被切断或分块切除⑦术前曾行手术活检(楔形切除活检)⑧淋巴结内或手术标本切缘有坏死的肿瘤或化疗导致的改变Ⅳ期①血行转移(肺、肝、骨、脑)②腹腔与盆腔以外的淋巴结转移血行转移(肺、肝、骨、脑)或腹腔与盆腔以外的淋巴结转移Ⅴ期双侧肾肿瘤。对每一侧应按以上标准进行分期双侧肾肿瘤。对每一侧应按以上的标准进行亚分期

表2 当前COG的儿童肾肿瘤风险分组[10]Table 2 Current COG risk stratification for pediatric renal tumors年龄肿瘤重量分期,组织学类型1p、16q的杂合性缺失肺转移对化疗的快速应答风险组< 2岁<550 gⅠ期,FH型无论有无-极低危组< 2岁≥550 gⅠ期,FH型无-低危组≥2岁不限Ⅰ期,FH型无-低危组不限不限Ⅱ期,FH型无-低危组≥2岁不限Ⅰ期,FH型有-中危组不限≥550gⅠ期,FH型有-中危组不限不限Ⅱ期,FH型有-中危组不限不限Ⅲ期,FH型无-中危组不限不限Ⅲ期,FH型有-组织学良好高危组不限不限Ⅳ期,FH型无有应答中危组不限不限Ⅳ期,FH型无论有无无论有无应答组织学良好高危组不限不限Ⅴ期,FH型或AH型无论有无无论有无应答双侧评估不限不限Ⅰ~Ⅳ期AH型,CCSK,RCC,MRTK无论有无无论有无应答高危组 注 FH:组织学良好型肾母细胞瘤;AH:间变型肾母细胞瘤;CCSK:肾透明细胞肉瘤;RCC:肾细胞癌;MRTK:肾恶性横纹肌样瘤
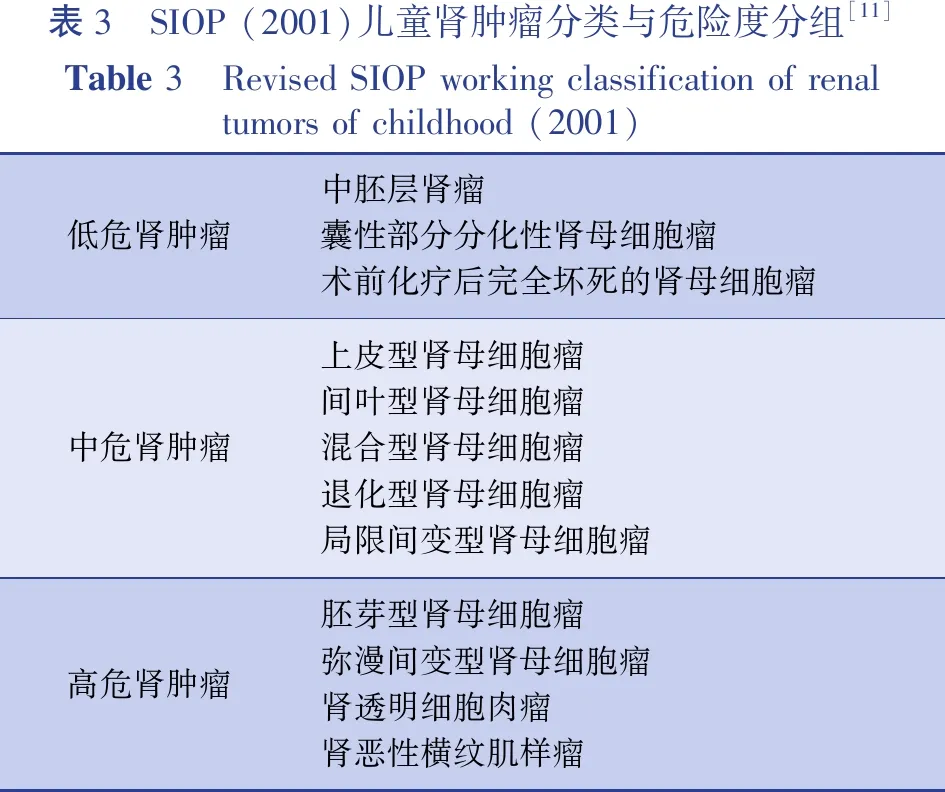
表3 SIOP (2001)儿童肾肿瘤分类与危险度分组[11]Table 3 Revised SIOP working classification of renal tumors of childhood (2001)低危肾肿瘤中胚层肾瘤囊性部分分化性肾母细胞瘤术前化疗后完全坏死的肾母细胞瘤中危肾肿瘤上皮型肾母细胞瘤间叶型肾母细胞瘤混合型肾母细胞瘤退化型肾母细胞瘤局限间变型肾母细胞瘤高危肾肿瘤胚芽型肾母细胞瘤弥漫间变型肾母细胞瘤肾透明细胞肉瘤肾恶性横纹肌样瘤
三、肾母细胞瘤的治疗
手术、化疗和放疗构成了肾母细胞瘤的基本治疗方式,但是其初始治疗有两种不同的方法。COG方案强调手术先行,然后加化疗或放疗。SIOP方案对大多数患儿行术前化疗后再手术,术后再化疗或加放疗。尽管治疗方式有显著的不同,但COG和SIOP治疗肾母细胞瘤总生存率均达到90%以上[12]。
(一)COG当前肾母细胞瘤治疗方案要点
1. 手术原则及要点
(1)经腹根治性肾切除和淋巴结取样。术中取肾门、主动脉周围淋巴结和腹部可疑淋巴结。切缘有残留肿瘤和可疑淋巴结部位置钛夹标记[9]。
(2)对于肿瘤可切除的患者,不进行术前活检或术中活检,因为COG分期系统中这两种方法都会使肿瘤的分期增高[9]。
(3)如果影像学检查未显示双侧肾脏肿瘤,则术中不需要常规探查对侧肾脏[13]。
(4)约2%肾母细胞瘤患者伴输尿管扩张。存在肉眼血尿、肾功能不全或肾积水者提示肿瘤可能延伸至输尿管,因此术前膀胱镜检查是必要的。如有肿瘤延伸至输尿管,建议将输尿管连同患肾整块切除[14]。
(5)肿瘤巨大者存在术中肿瘤破溃的风险,尤其是右肾肿瘤[15]。
(6)以下情况可考虑行保留肾单位的手术(nephron-sparing surgery,NSS)[16-18]:孤立肾的肾母细胞瘤;双侧肾母细胞瘤;马蹄肾的肾母细胞瘤;患有Denys-Drash或Frasier综合征的婴儿肾母细胞瘤(因为可能需要肾透析)。
2.Ⅰ~Ⅳ期肾母细胞瘤的术后化疗与放射治疗
除极低风险组(年龄小于2岁的Ⅰ期FH型肾母细胞瘤,瘤重小于550克,淋巴结阴性)外,其他患者均需要行术后化疗或放射治疗。表4为肾母细胞瘤的标准化疗方案[9]。对Ⅰ期至Ⅳ期病人的具体化疗和放射治疗方案见表5[9,19]。新生儿和12个月以下婴儿应减少50%的化疗剂量,剂量按每公斤体重计算,而不是按体表面积计算,这样能有效减轻这一年龄段患儿的毒副作用,同时保持良好疗效。
3. Ⅴ期肾母细胞瘤治疗方案
双侧肾母细胞瘤患儿的治疗非常具有挑战性。治疗的目标是根治性清除所有的肿瘤,并尽可能多地保留正常的肾组织,以降低慢性肾功能衰竭的风险。如果影像学检查结果为双侧肾母细胞瘤,则不需要先活检,因为双侧肾肿瘤患者非肾母细胞瘤发生率非常低[20]。年龄大于10岁或影像学特征不典型、考虑为肾母细胞瘤以外的疾病者可行活检[21]。
Ⅴ期(双侧)肾母细胞瘤的治疗方案如下:
(1)术前化疗与术后化疗。术前化疗使用长春新碱、放线菌素D和阿霉素三种药物,4~8周后评估,12周内完成手术,根据组织学反应行术后化疗。
(2)手术。可行双侧保留肾单位手术,同时发生的双侧肾母细胞瘤有良好的预后。保留肾实质可能有助于保护存在严重慢性肾功能不全风险患儿的肾功能。终末期肾病可由潜在的遗传异常以及治疗相关的肾组织丧失引起。双侧病变治疗后需要长期监测肾功能。
(3)肾移植。Ⅴ期肾母细胞瘤患儿肾移植通常延迟到1~2年后无恶性肿瘤证据时才进行,因为大多数复发发生在诊断后2年内[22]。
4. COG的术前化疗指证
术前化疗仅适用于以下情况[9]: ①孤立肾的肾母细胞瘤; ②双侧肾母细胞瘤; ③下腔静脉瘤栓扩展至肝静脉水平以上; ④肿瘤侵犯相邻脏器,切除肾脏肿瘤时必须切除其他脏器(如脾脏、胰腺或结肠,但肾上腺除外); ⑤无法手术的肾母细胞瘤; ⑥广泛肺转移,肺功能受损。
强调化疗前先行活检。术前化疗过程中对非间变型肾母细胞瘤使用长春新碱、放线菌素D和阿霉素。间变型可用Ⅰ方案化疗[19](表4)。术前化疗通常可使肿瘤减小,血供减少,使手术切除更容易,还可降低手术并发症的发生率。对术前肿瘤破裂的患者使用术前化疗尚有争议[23,24]。

表4 COG的肾母细胞瘤标准化疗方案[9]Table 4 COG standard chemotherapy regimens for Wilms tumor方案用药EE-4A方案长春新碱+放线菌素,共18周DD-4A方案长春新碱+放线菌素+阿霉素,共24周I方案长春新碱+阿霉素+环磷酰胺+依托泊苷,共24周M方案[24]长春新碱+放线菌素+阿霉素+环磷酰胺+依托泊苷(DD-4A加4个疗程的环磷酰胺/依托泊苷),共31周
(二)Umbrella SIOP-RTSG 2016方案
Umbrella SIOP-RTSG 2016(Umbrella 2016)方案是目前SIOP应用于儿童肾肿瘤诊断、治疗及随访监测的现行方案[25]。
1. 术前治疗
原发性肾肿瘤的诊断以超声成像为基础,大多数患者也行CT或MRI检查,化疗前的组织学诊断不是必须的,仅对诊断结果有疑问的病例行穿刺或开放活检,但不增加分期。术前化疗后行根治性瘤肾切除术是SIOP治疗儿童肾母细胞瘤的标准。术前化疗通常采用以下三种方案之一: ①单侧局限性病变者术前用长春新碱(每周1次)、放线菌素D(每2周1次)治疗4周。②转移性病变患者术前用长春新碱、放线菌素D、阿霉素(第1周和第5周用)治疗6周。③双侧肾母细胞瘤患者术前用长春新碱、放线菌素D治疗9~12周,部分患者给予阿霉素强化治疗。

表5 COG的Ⅰ~Ⅳ期肾母细胞瘤治疗方案[9]Table 5 COG standard treatment options for Stage Ⅰ~Ⅳ Wilms tumor 分期组织学治疗Ⅰ期FH型,年龄<24个月或瘤重<550 g手术,包括淋巴结采集。不化疗与放疗FH型,年龄>24个月或瘤重>550 g肾切除+淋巴结采集,术后EE-4A方案化疗局灶间变型肾切除+淋巴结采集,术后EE-4A化疗,放疗弥漫间变型肾切除+淋巴结采集,术后EE-4A化疗,放疗Ⅱ期FH型肾切除+淋巴结采集,术后EE-4A化疗局灶间变型肾切除+淋巴结采集,术后DD-4A化疗,放疗弥漫间变型肾切除+淋巴结采集,术后Ⅰ方案化疗,放疗Ⅲ期FH型(所有病人)肾切除+淋巴结采集,术后DD-4A化疗,腹部放疗FH型(无1p/16q LOH)肾切除+淋巴结采集,术后DD-4A化疗,腹部放疗局灶间变型肾切除+淋巴结采集,术后DD-4A化疗,腹部放疗局灶间变型(术前化疗)术前DD-4A化疗,然后肾切除+淋巴结采集,腹部放疗弥漫间变型肾切除+淋巴结采集,术后Ⅰ方案化疗,腹部放疗弥漫间变型(术前化疗)术前Ⅰ方案化疗,然后肾切除术+淋巴结采样,腹部放疗Ⅳ期FH型肾切除+淋巴结采集,术后腹部放疗,转移部位放疗,两肺放疗,DD-4A方案化疗FH(孤立肺结节)肾切除+淋巴结采集,术后腹部放疗+/-两肺放疗,DD-4A或M方案化疗局灶间变型肾切除+淋巴结采集,术后腹部放疗,转移部位放疗,两肺放疗,DD-4A方案化疗弥漫间变型肾切除+淋巴结采集,术后腹部放疗,转移部位放疗,全肺放疗,Ⅰ方案化疗弥漫间变型(术前化疗)术前Ⅰ方案化疗,然后肾切除+淋巴结采集,腹部放疗,转移部位放疗,全肺放疗 注 FH:良好型组织学; 放疗:放射治疗,于术后10 d内开始。年龄小于6个月不宜放疗,6~12月龄者减小放疗剂量。
2. 手术治疗
Umbrella 2016方案强调应取样7个局部淋巴结,以达到精确分期。保留肾单位手术(nephron-sparing surgery,NSS)用于特定条件下的非综合征性单侧肾母细胞瘤,包括肿瘤体积小(<300 cm3)、无淋巴结转移、预期有充分残余肾功能的患者[25]。
3. 术后治疗
Ⅰ~Ⅲ期肾母细胞瘤的术后治疗:表6为Umbrella 2016方案的Ⅰ~Ⅲ期肾母细胞瘤标准术后化疗方案[25]。
Ⅳ期肾母细胞瘤的治疗:术后治疗取决于原发肿瘤和转移肿瘤的治疗应答及可切除性。表7为Umbrella 2016方案的Ⅳ期肾母细胞瘤标准化疗方案[25]。

表6 SIOP的Ⅰ~Ⅲ期肾母细胞瘤术后治疗方案Umbrella(SIOP-RTSG 2016方案)[25]Table 6 Postoperative treatment for stage Ⅰ~Ⅲ Wilms tumor in Umbrella SIOP-RTSG 2016病变术前化疗后的肿瘤体积治疗Ⅰ期Ⅱ期Ⅲ期低危组任何体积无术后治疗AV (27周)AV (27周)中危组,各种组织类型< 500 m2AV(4周)AV(27周)AV(27周)+腹部放疗中危组,间叶型或上皮型≥500 m2AV(4周)AV(27周)AV(27周)+腹部放疗中危组,非间叶型,非上皮型≥500 m2AV(4周)AV(27周)AVD(27周)+腹部瘤床放疗高危组胚芽型任何体积AVD(27 周)HR-1方案(34 周)HR-1方案(34周)+腹部瘤床放疗高危组弥漫间变型任何体积AVD(27 周)HR-1方案(34 周)+腰腹部放疗HR-1方案(34周)+腰腹部放疗 注 A:放线菌素(dactinomycin); D:阿霉素(doxorubicin); V:长春新碱(vincristine) HR-1方案:依托泊苷(etoposide),卡铂(carboplatin),环磷酰胺(cyclophosphamide),阿霉素(doxorubicin),共34周

表7 SIOP根据术前化疗后的应答和肿瘤组织学制定的Ⅳ期肾母细胞瘤治疗方案Umbrella(SIOP-RTSG 2016方案)Table 7 Treatment for stage Ⅳ Wilms tumor based on response to treatment and histology in Umbrella SIOP-RTSG 2016转移灶的手术肾母细胞瘤的组织学治疗转移灶完全缓解或非常好的部分缓解必要时完全切除转移灶低危组或中危组,肺结节直径3~5 mmAVD150方案化疗。肺转移灶病理检查为活的肿瘤者肺放疗,否则不行肺放疗低危组或中危组,肺结节直径>5 mm或其他部位转移AVD250方案化疗。肺转移灶为活的肿瘤者肺放疗,否则不行肺放疗低危组或中危组,病理检查无转移的依据按局部病变治疗部分应答或稳定代表性的结节可切除低危组,病理检查证实为活的转移灶AVD250方案化疗,肺或其他部位转移灶放疗。第10周时CT检查,如仍有结节则手术切除以达到完全应答低危组,转移灶完全坏死AVD150方案化疗。第10周时CT检查,如仍有结节则手术切除以达到完全应答低危组或中危组,病理检查无活的肿瘤按肾局部病变治疗。或AVD250方案化疗,第10周时CT检查,如果仍有结节则手术切除以达到完全应答。转移部位不放疗中危组,病理检查证实有活的转移灶4药方案化疗,转移部位放疗。第10周时CT检查,如仍有结节则手术切除以达到完全应答中危组,转移灶完全坏死AVD250方案化疗。第10周时CT检查,如仍有结节则手术切除以达到完全应答

续上表
4. Ⅴ期肾母细胞瘤的治疗
同时性双侧肾母细胞瘤(Ⅴ期)占所有Wilms瘤的5%~8%,长期总生存率目前为80%。终末期肾病(end-stage renal disease,ESRD)是双侧肾母细胞瘤患者最严重的并发症,可能由潜在的种系遗传异常以及治疗相关的肾功能组织丧失引起。Aronson等[26]观察到,双侧NSS后肾功能预后明显好于其他类型的手术。Umbrella 2016方案建议尽量避免双侧肾母细胞瘤全肾切除。在SIOP-2001系统中,双侧病变患者术前接受长春新碱、更生霉素等化疗,每4周进行1次反应评估,直至可行保留肾单位的肾切除术。然而有研究表明,延长术前化疗时间通常无效(尤其许多双侧肾母细胞瘤属于对化疗不敏感的间质型),甚至可能导致贫血、疾病进展和转移的风险增加。因此,Umbrella方案将术前化疗限制在不超过12周,评估的间隔时间为6周。在肿瘤无反应或不可手术的情况下建议改用依托泊苷和卡铂治疗,以避免使用蒽环类药物,并可考虑采用活检来确定其组织学特征[25]。
5. 婴儿肾母细胞瘤的治疗
对小于6月龄婴儿患者,除多学科团队共识判断肿瘤不适合立即切除外,Umbrella 2016方案建议一期手术。一期肾切除术的原因是婴儿肾肿瘤中胚层肾瘤或肾恶性横纹肌样瘤比例更高,这些肿瘤要么只需要手术(中胚层肾瘤),要么一开始就需要另一种化疗方案(横纹肌样瘤)[25]。对Ⅳ期或初期手术有困难的患者建议行经皮穿刺活检。婴儿肾母细胞瘤的术后化疗方案与接受一期肾切除术的年龄较大儿童相似,但需根据年龄和体重调整药物剂量[26]。
6. 放射治疗(放疗)
Umbrella 2016方案的放射治疗指南根据SIOP-2001的经验进行了改进。其中全腹放疗适用于术前或术中有严重肿瘤破裂或肉眼可见腹腔积液的中、高风险组织学肿瘤。肺放疗用于术后10周时无完全应答的肺转移瘤[25]。化疗后肾肿瘤手术或未手术者如果肺转移灶完全消退则不需要行肺部放疗。肾手术时仍存在有活性的肺转移灶则需接受肺部放疗[25]。
(三)COG和SIOP对复发性肾母细胞瘤的治疗
约15%组织学预后良好型肾母细胞瘤患者和50%预后不良型患者可能复发[9]。最常见的复发部位是肺,其次是腹部/腰部和肝脏,颅内复发少见(约0.5%)。既往复发性肾母细胞瘤的治愈率为25%~40%。现代综合治疗已改善了预后,复发后治愈率达60%[27]。
1. COG的复发性肾母细胞瘤治疗方案
复发性肾母细胞瘤可分为以下三个风险类别[27]: ①标准风险复发组:仅使用长春新碱和(或)放线菌素D治疗后复发的组织学预后良好型肾母细胞瘤患者。这些患者的无事件生存率(event-free survival rate,EFS)预计为70%~80%。②高风险复发组:组织学预后良好型肾母细胞瘤经3种或3种以上药物治疗后复发,生存率为40%~50%。③极高风险复发组:间变型或胚芽型肾母细胞瘤复发,生存率预计在10%左右。
标准风险复发组的治疗方案:可行手术者行手术切除、放疗和化疗(交替使用长春新碱/阿霉素/环磷酰胺和依托泊苷/环磷酰胺)。高危和极高危复发组的治疗方案: ①化疗(环磷酰胺/依托泊苷与卡铂/依托泊苷交替疗程)、手术、放疗[28]; ②自体造血干细胞移植(hematopoietic stem cell transplantation,HSCT)。大剂量化疗后自体造血干细胞移植已用于复发高危患者[29]。
2. SIOP的复发性肾母细胞瘤治疗方案
Umbrella 2016方案将复发患者分为AA组、BB组和CC组[25]。AA组为Ⅰ~Ⅱ期低危或中危肿瘤患者,在一线治疗中仅接受过长春新碱和(或)更生霉素化疗(未放疗),复发后的治疗包括四药化疗,即阿霉素和(或)环磷酰胺联合卡铂和(或)依托泊苷。BB组为初期无弥漫间变或胚芽型组织学、初期治疗曾用阿霉素者。复发后用加强的再诱导化疗方案(包括依托泊苷和卡铂与异环磷酰胺或环磷酰胺的联合),然后采用大剂量美法仑和自体干细胞解救或两个疗程的再诱导化疗。为降低异环磷酰胺相关肾毒性的风险,环磷酰胺与异环磷酰胺应交替使用。CC组包括初始为弥漫间变型或胚芽型肿瘤患者。对于这类病人和其他复发且对挽救治疗无应答者,Umbrella方案建议试用喜树碱(伊立替康或拓扑替康)或新型的小分子靶向药物,因为这些病人在一线治疗期间已经接受了大多数传统的活性药物,并可能已发生化疗耐药性。
四、中国肾母细胞瘤诊疗共识
我国对儿童实体肿瘤系统性的诊疗和研究工作起步较欧美国家明显要晚,小儿外科的临床实践中对肾母细胞瘤诊疗的随意性较大。为引导临床诊疗工作统一、有序地开展,中国抗癌协会小儿肿瘤专业委员会于2017年发表了“儿童肾母细胞瘤诊断治疗建议(CCCG-WT-2016)”,此后中华医学会小儿外科学分会泌尿外科学组于2020年发表了“儿童肾母细胞瘤诊疗专家共识”[30,31]。2020版共识是在参考COG方案、Umbrella 2016方案以及CCCG-WT-2016方案基础上,结合我国小儿外科临床实际情况制定。共识不强调必须执行COG方案或者Umbrella 2016方案,主张在经过系统评估认为手术切除安全的前提下,参照COG的诊断评估和治疗体系,先行手术治疗,而后进行放化疗辅助治疗;评估认为手术困难或者术中破溃风险较大的病例,参照Umbrella 2016方案先化疗后手术,手术后根据Umbrella 2016方案的危险度分组体系选择相应的放化疗方案。共识尚存在不少值得进一步探讨的问题,目前尚没有形成中国人群自己的高级别循证医学证据。目前国内多个团队在微创手术、保留肾单位手术等方向做了积极的探索[32]。
五、肾母细胞瘤治疗后的远期并发症
肾母细胞瘤患儿治疗后患下列疾病的风险增加: ①继发性恶性肿瘤。消化道肿瘤和乳腺癌是最常见的继发性恶性肿瘤,其中放疗是一个危险因素。转移性肾母细胞瘤接受肺放疗的幸存者到40岁时乳腺癌的发病率约为15%[33]。②充血性心力衰竭。充血性心力衰竭的风险与所接受的阿霉素剂量以及性别有关[34]。③终末期肾病。双侧肾母细胞瘤患者终末期慢性肾功能衰竭的累积发生率为3.1%,单侧肾母细胞瘤患者终末期慢性肾功能衰竭的累积发生率则不到1%[35]。
六、小结
大多数肾母细胞瘤患者总体治疗结果良好。进一步研究方向应聚焦在如何更精确地风险分层下使用化疗和放疗,提高高危险度组患儿的生存率,减少中低危组治愈患者的远期并发症。外科医生必须更加注重对肾母细胞瘤患儿的全面评估,合理选择术前与术后化疗策略,以实现肾母细胞瘤患者的最佳治疗效果。
临床和生物预后标志物的识别,如化疗后胚芽细胞的残留和染色体1p和16q的杂合性缺失,使更精确的治疗成为可能。随着新基因、生物标志物和治疗靶点的发现,国际合作的成果正在逐步实现。COG和SIOP也越来越多地将彼此研究中的经验教训应用到治疗方案中。中国儿童肾母细胞瘤的诊治及研究工作应努力融入国际合作,为全球范围内儿童肾肿瘤治疗和预后的进一步改善贡献力量。
