枯草芽孢杆菌JN005 胞外抗菌物质及对水稻叶瘟防治效果
2020-09-17朱华珺周瑚任佐华刘二明
朱华珺 周瑚 任佐华 刘二明,
(1 湖南农业大学 植物保护学院,长沙 410128;2 植物病虫害生物学与防控湖南省重点实验室,长沙 410128;3 南方粮油作物协同创新中心,长沙410128;*通信联系人,E-mail:ermingliu@163.com)
稻瘟病是最具破坏性的水稻真菌性病害之一,每年能够造成全球水稻减产10%~30%[1]。尽管化学农药能够快速有效地防治植物病害,但过度使用会导致植物病原物的抗药性上升和并影响食物安全[2-4]。由于来自微生物代谢产物研发的生物农药负面影响小、环境相容性和有害生物防治效果好,微生物代谢产物的研发成为全球农药产业发展的重要途径[5-6]。
生防细菌目前主要包括芽孢杆菌、假单胞菌及链霉菌,其中芽孢杆菌是一类内生芽孢的革兰氏阳性杆菌,其具有产生多种生物活性化合物的能力,因此是商业开发的首选[7]。芽孢杆菌的生防机制包括竞争作用、拮抗作用、诱导植物抗病性三方面[8-9],拮抗作用是指生防菌在其生长代谢过程中产生的各种活性物质抑制病原菌的生长,在植物病害的防治中发挥着重要作用。近年已报道了芽孢杆菌的各种抗菌物质,如酶类、脂肽类、蛋白类物质[10-12],其活性范围广、毒性低、对环境友好,被认为是拮抗植物病原物的潜在药剂。迄今为止,我国新登记的防治稻瘟病的芽孢杆菌制剂有19 种,其中枯草芽孢杆菌、蜡质芽孢杆菌和解淀粉芽孢杆菌的分别为15 种、3 种和1 种[13]。
本实验室于2014 年从湖南桃江山区单季稻感稻瘟病品种湘早籼24 号的感病稻丛的健康稻株中分离出817 株菌株,采用平板对峙法,筛选出1 株对稻瘟病菌具有高效抑制作用的枯草芽孢杆菌JN005,并已获得中国国家发明专利[14]。本研究初步分析枯草芽孢杆菌JN005 菌株的抑菌物质,从中提取出对稻瘟病菌有拮抗效果的胞外抗菌物质,并对其抗菌活性和稳定性进行了测定,同时,进一步研究了胞外抗菌物质对稻瘟病菌生长和致病性的影响,研究结果可为枯草芽孢杆菌JN005 菌株的开发应用提供依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
供试拮抗菌枯草芽孢杆菌JN005 是本课题组从湖南桃江山区单季稻感病品种湘早籼24 号的感稻瘟病稻丛的健康稻株中分离获得[15],供试病原菌稻瘟病菌TJ40-2-1[16],均由湖南农业大学植物病原微生物及水稻病害实验室保存。
1.1.2 供试水稻品种
感稻瘟病品种湘晚籼12 号来自湖南金色农丰种业有限公司。
1.1.3 供试农药
40%稻瘟灵(EC)和75%三环唑(WP)分别来自江苏龙灯化学有限公司和上海沪联生物药业(夏邑)股份有限公司。
1.2 JN005 菌株抑菌物质的初步测定
1.2.1 产酶活性、产嗜铁素特性检测
将5 μL 的JN005 菌株发酵液分别接在脱脂牛奶琼脂培养基、纤维素酶选择性培养基、0.2%可溶性淀粉培养基、β-1, 3-葡聚糖酶培养基、胶体几丁质酶培养基和CAS 培养基平板上,干燥后置于28℃恒温培养箱中培养,于24 h、48 h 和72 h 观察菌落的生长情况和水解圈,每处理重复3 次。
1.2.2 挥发性气体拮抗活性检测
在NA 培养基平板上划线接种JN005 菌株,同时在PDA 培养基平板上接种6 mm 稻瘟病菌菌饼,置于28℃恒温培养箱中培养24 h 后,移去两个培养皿的皿盖,将皿底相对而扣,上皿为接种稻瘟病菌菌饼平板,下皿为接种JN005 菌株平板,并用封口膜将培养皿外侧固定封口,置于28℃恒温培养箱中继续培养3~5 d 后进行观察,每处理重复3 次,设不接JN005 菌株的空白对照。
1.2.3 胞外抗菌物质拮抗活性检测
将JN005 菌株接在NB 培养液中,置于30℃、200 r/min 摇床中发酵培养5 d 后,4℃、10 000 r/min条件下离心15 min,取上清液,用0.22 µm 细菌过滤器过滤得代谢产物液。采用硫酸铵分级沉淀法提取胞外抗菌物质:在常温条件下,将固体硫酸铵研磨成粉末状,边缓慢加入代谢产物液中边轻轻搅动液体直至充分溶解,使其饱和度达到80%,置于4℃下静置24 h 后析出深褐色沉淀,4℃、10 000 r/min条件下离心15 min,取沉淀溶解于PBS 缓冲液中,再将溶解好的液体装于透析袋(8 000~14 000 D)中并置于相同PBS 缓冲液中24 h 透析除盐,透析液用0.22 µm 细菌过滤器过滤后,将液体体积调整为代谢产物液体积的1/20,获得胞外抗菌物质粗提液,用考马斯亮蓝法测定样品浓度并检测其抑制稻瘟病菌活性。按平板对峙法将6 mm 稻瘟病菌菌饼接在PDA 培养基平板中央位置,在距离菌饼中心左右25 mm 处用6 mm 打孔器各打一孔,向内各注入60 μL 的胞外抗菌物质粗提液(浓度为1.54 mg/mL),置于28℃恒温培养箱中培养5 d 后测量菌落直径,计算抑菌直径[抑菌直径(mm)=对照组菌落直径(mm)-处理组菌落直径(mm)],每处理重复3 次,设PBS 缓冲液的空白对照。
1.3 JN005 菌株胞外抗菌物质的稳定性
1.3.1 温度对活性的影响
将胞外抗菌物质粗提液分别置于0℃、10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃和100℃下恒温处理30 min 后,冷却至室温,采用平板对峙法检测对稻瘟病菌的抑制活性。
1.3.2 pH 对活性的影响
将胞外抗菌物质粗提液分别用1 mol/L 盐酸和1 mol/L 氢氧化钠溶液将其pH 调至2~12,置于4℃下静置24 h 后pH 调回中性,采用平板对峙法检测对稻瘟病菌的抑制活性。
1.3.3 蛋白酶对活性的影响
在胞外抗菌物质粗提液中分别加入等体积的1 mg/mL 木瓜蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶、蛋白酶K、链蛋白酶,充分混匀后常温下静置1 h,采用平板对峙法检测对稻瘟病菌的抑制活性。
1.3.4 紫外照射对活性的影响
将胞外抗菌物质粗提液置于距离28 W 紫外灯光的10 cm 处,分别照射15 min、30 min、45 min、1 h、2 h、4 h、6 h 和12 h,采用平板对峙法检测对稻瘟病菌的抑制活性。
1.3.5 储存时间对活性影响
将胞外抗菌物质粗提液置于4℃下保存,每隔10 d 进行检测,持续检测120 d,采用平板对峙法检测对稻瘟病菌的抑制活性。
1.4 JN005 菌株胞外抗菌物质对稻瘟病菌菌丝生长和孢子萌发的影响
1.4.1 对稻瘟病菌菌丝生长影响
将胞外抗菌物质粗提液(浓度为1.54 mg/mL)用无菌水分别稀释20 倍、50 倍和100 倍,采用平板对峙法检测对稻瘟病菌的抑制活性,置于28 ℃恒温培养箱中培养,在第3 天将盖玻片插入稻瘟病菌菌饼和加样孔之间的培养基中,相同条件继续培养,待菌丝长至盖玻片上时取出,制成玻片置于光学显微镜下观察,设胞外抗菌物质粗提液原液、PBS缓冲液和无菌水的处理作对照。
1.4.2 对稻瘟病菌孢子萌发影响
将胞外抗菌物质粗提液(浓度为1.54 mg/mL)用无菌水分别稀释20 倍、50 倍和100 倍,吸取3 个浓度的液体各500 μL 与稻瘟病菌分生孢子悬浮液(1×105个/mL)等量混合均匀,再吸取各混合液分别滴100 μL 于载玻片上,将载玻片架放于带有浅层无菌水的培养皿中于28℃恒温培养箱中加盖保湿培养,每处理3 个重复,设胞外抗菌物质粗提液原液、PBS 缓冲液和无菌水的处理作对照,当无菌水处理的对照孢子萌发率达到90%以上时,观察各处理孢子萌发情况。
1.5 JN005 菌株胞外抗菌物质对叶瘟的防治
1.5.1 离体接种
将胞外抗菌物质粗提液(浓度为1.54 mg/mL)用无菌水稀释100 倍,40%稻瘟灵(EC)用无菌水稀释500 倍,75%三环唑(WP)用无菌水稀释1500 倍。湘晚籼12 号盆栽种植,于5 叶1 心时,取添加适量吐温的稻瘟病菌分生孢子液(1×105个/mL),参照《水稻稻瘟病抗性室内离体叶片鉴定技术规程》[17]进行离体叶片接种,即用昆虫针对离体叶片正面制造3个微创伤点,在微创伤点上接种稻瘟病菌孢子悬浮液。接种后的培养皿置于28℃、相对湿度100%环境下,黑暗处理24 h 后,再按光照和黑暗正常周期交替培养,直至水稻叶片发稻瘟病。具体分为A、B 两个处理,根据清水对照处理的发病情况,计算发病率。
试验组A:离体叶片分别用胞外抗菌物质稀释液、40%稻瘟灵(EC)稀释液、75%三环唑(WP)稀释液、PBS 缓冲液和清水浸湿5 min 并晾干,24 h 后接种稻瘟病菌分生孢子悬浮液。试验组B:离体叶片接种稻瘟病菌分生孢子悬浮液,24 h 后分别用胞外抗菌物质稀释液、40%稻瘟灵(EC)稀释液、75%三环唑(WP)稀释液、PBS 缓冲液和清水浸湿5 min 并晾干。
若病斑仅局限于叶片划伤处,呈褐色点状,病斑中无分生孢子形成,记为未发病;若病斑呈梭形,中央灰色的崩溃部生有菌丝和分生孢子,崩溃部的外围可能有褐色坏死,最外层是淡黄色的中毒部,形状不规则,边缘呈现出暗绿色记为发病。
发病率(%)=(发病病斑数/调查总病斑数)×100。
1.5.2 活体接种
将胞外抗菌物质粗提液(浓度为1.54 mg/mL)用无菌水稀释100 倍,40%稻瘟灵(EC)用无菌水稀释500 倍,75%三环唑(WP)用无菌水稀释1500 倍。把长至3 叶1 心的湘晚籼12 号秧苗盆栽移至温室内,取添加适量吐温的稻瘟病菌分生孢子液(1×105个/mL)均匀喷雾在叶片上,置于28℃、相对湿度100%环境下,黑暗处理24 h 后,再按光照和黑暗正常周期交替培养,直至叶片发稻瘟病。具体分为C、D两个处理,根据清水对照处理的发病情况,调查发病率和病级,计算病情指数和防治效果。
试验组C:先分别喷施胞外抗菌物质稀释液、40%稻瘟灵(EC)稀释液、75%三环唑(WP)稀释液、PBS 缓冲液和清水,24 h 后喷施稻瘟病菌分生孢子悬浮液。试验组D:先喷施稻瘟病菌分生孢子悬浮液,24 h 后分别喷施胞外抗菌物质稀释液、40%稻瘟灵(EC)稀释液、75%三环唑(WP)稀释液、PBS 缓冲液和清水。
依据国际稻瘟病圃IRBN,叶瘟分级标准如下:0 级为无病;1 级为针头状大小褐点,无产孢中心;2 级为稍大的褐点(直径1~2 mm),多数褐点位于植株下部叶片;3 级为圆形稍长的灰色小病斑,多数病斑位于植株上部叶片;4 级为典型纺锤形病斑,直径3 mm 以上,病斑面积4%;5 级为典型病斑,病斑面积4%~10%;6 级为典型病斑,病斑面积11%~25%;7 级为典型病斑,病斑面积16%~50%;8 级为典型病斑,病斑面积51%~75%;9 级病斑面积75%以上。
发病率(%)=(发病株数/调查总株数)×100;
病情指数 = [∑ (各病级植株数×各级代表数值)/调查总植株数×最高级别值] ×100;
防治效果(%) =(对照病指−处理病指/对照病指)×100。
1.6 数据统计与分析
数据利用Microsoft Excel 2007 软件进行图表制作,采用IBM SPSS Statistics 19 软件进行差异显著性分析,不同字母表示在0.05 水平上差异显著。
2 结果与分析
2.1 JN005 菌株抑菌物质产酶和产气测定
经检测发现,JN005 菌株在胶体几丁质酶培养基和CAS 培养基平板上没有形成水解圈,但在脱脂牛奶琼脂培养基、纤维素酶选择性培养基、0.2%可溶性淀粉培养基和β-1, 3-葡聚糖酶培养基平板上形成水解圈,因而推测JN005 菌株不能分泌几丁质酶和嗜铁素,但能产生蛋白酶、纤维素酶、淀粉酶和β-1, 3-葡聚糖酶(图1)。JN005 菌株的挥发性气体对稻瘟病菌生长基本无影响,但JN005 菌株的胞外抗菌物质粗提液能够有效拮抗稻瘟病菌生长(图2)。
2.2 JN005 菌株胞外抗菌物质的稳定性
实验结果表明,在0℃~100℃范围内随着温度的升高,JN005 菌株胞外抗菌物质粗提液对稻瘟病菌的抑菌直径会减小,但0℃和100℃处理对比,抑菌直径只下降了2.11 mm(图3-A);JN005 菌株胞外抗菌物质粗提液在pH 2~12 范围内拮抗稻瘟病菌活性较为稳定,抑菌直径未有大幅度变化,但pH=12处理最影响其活性;当胞外抗菌物质粗提液与蛋白酶K 混合孵育后,抑菌直径保持稳定,未有活性损失,而木瓜蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和链蛋白酶则不同程度地降低了抑菌直径(图3-C);胞外抗菌物质粗提液在紫外下照射时间越长抑菌直径随之下降,但照射12 h 后依旧保持活性(图3-D);胞外抗菌物质粗提液在4℃下保存3 个月以上仍然对稻瘟病菌生长具有拮抗作用,但随着时间的推移抑菌直径逐渐减小(图3-E)。
2.3 光学显微镜下观察JN005 菌株胞外抗菌物质影响稻瘟病菌菌丝形态和孢子萌发
在光学显微镜下观察稻瘟病菌菌丝,发现无菌水(图4-A)和PBS 缓冲液(图4-B)的对照组稻瘟病菌菌丝生长正常,菌丝呈条状且笔直。加入胞外抗菌物质粗提液的处理组稻瘟病菌菌丝生长异常:稀释100 倍胞外抗菌物质粗提液处理的菌丝出现肿胀、变形和扭曲(图4-C),稀释50 倍胞外抗菌物质粗提液处理的菌丝断裂、分节(图4-D),稀释20 倍胞外抗菌物质粗提液处理的菌丝顶端逐渐呈球状膨大(图4-E),胞外抗菌物质粗提液原液处理的菌丝顶端破裂,原生质发生渗漏(图4-F)。
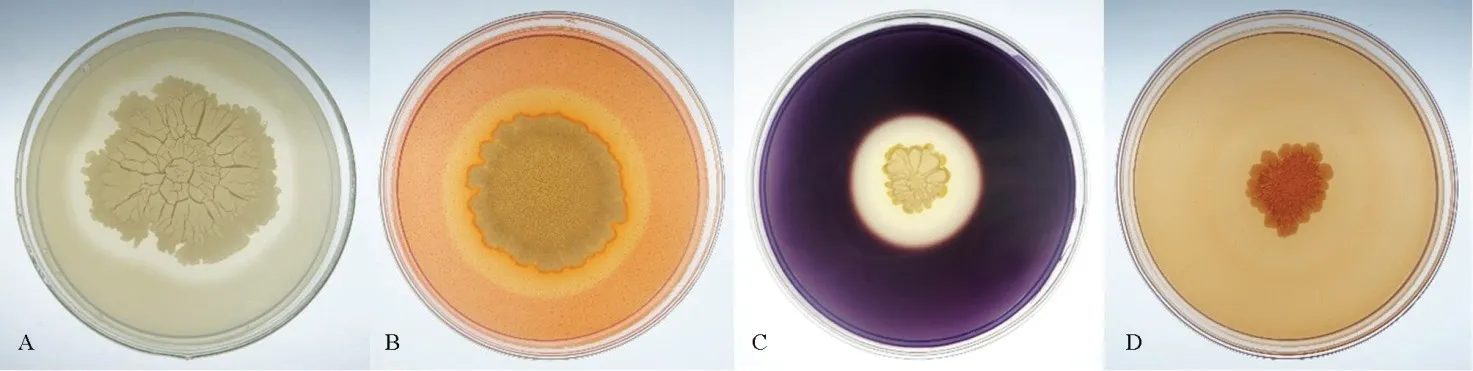
图1 JN005 菌株产蛋白酶(A)、纤维素酶(B)、淀粉酶(C)和β-1, 3-葡聚糖酶(D)的检测Fig.1.Test of protease(A), cellulase(B), amylase(C) and β-1, 3-glucanase(D) produced by JN005 strain.
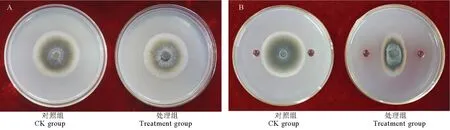
图2 JN005 菌株挥发性气体(A)和胞外抗菌物质(B)对稻瘟病菌的影响Fig.2.Effects of volatile compounds(A) and extracellular antimicrobial substances(B) of JN005 strain onM.oryzae.
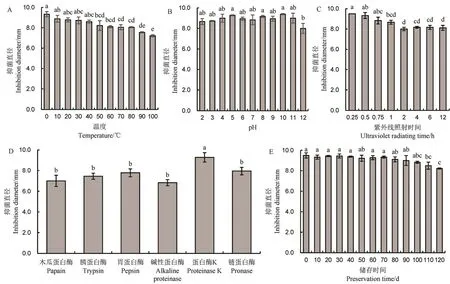
图3 不同处理对JN005 菌株胞外抗菌物质抑制稻瘟病菌菌丝生长稳定性的影响Fig.3.Effect of different treatments on activity of extracellular antimicrobial substances of JN005 strain againstM.oryzae.
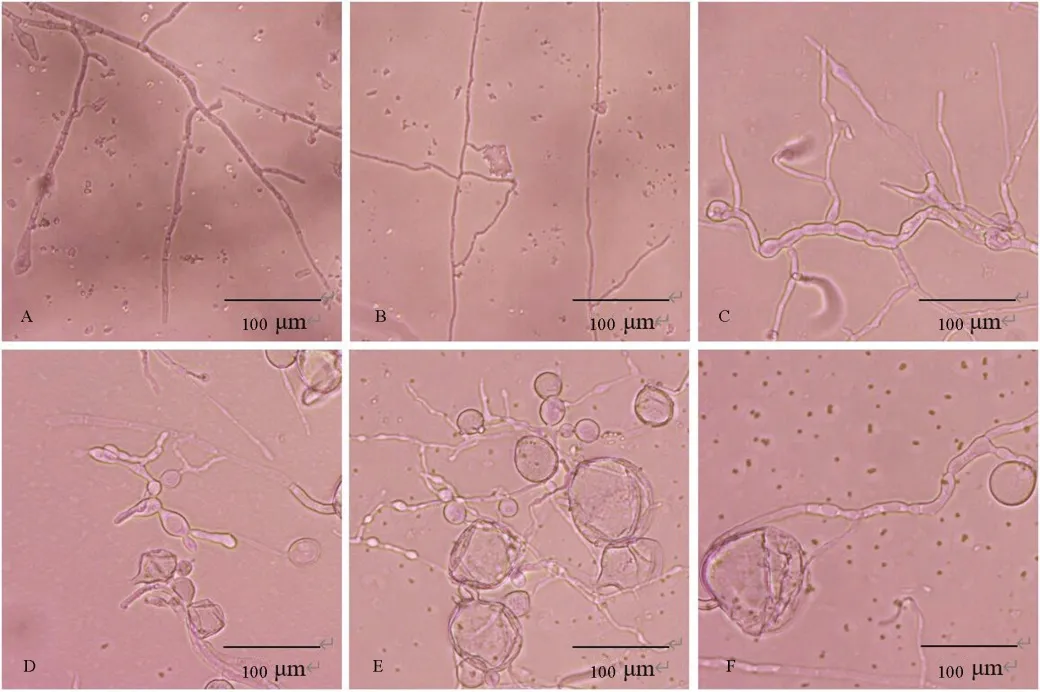
图4 JN005 菌株胞外抗菌物质对稻瘟病菌菌丝生长的影响Fig.4.Effect of extracellular antimicrobial substances of JN005 strain on mycelia ofM.oryzae.

图5 JN005 菌株胞外抗菌物质对稻瘟病菌孢子的影响Fig.5.Effect of extracellular antimicrobial substances of JN005 strain on conidia ofM.oryzae.
在光学显微镜下观察稻瘟病菌孢子,当对照组无菌水(图5-A)和PBS 缓冲液(图5-B)处理的稻瘟病菌孢子正常萌发时,胞外抗菌物质粗提液处理的稻瘟病菌孢子发生异常:稀释100 倍胞外抗菌物质粗提液处理的孢子能够萌发,芽管伸长,但其附着孢膨大(图5-C);稀释50 倍胞外抗菌物质粗提液处理的孢子萌发受阻,芽管短,其附着孢变大(图5-D),稀释20 倍胞外抗菌物质粗提液处理的孢子一端呈球型胀大(图5-E),胞外抗菌物质粗提液原液处理的孢子变形,孢子两端呈球型变大(图5-F)。
2.4 JN005 菌株胞外抗菌物质对叶瘟的防治效果
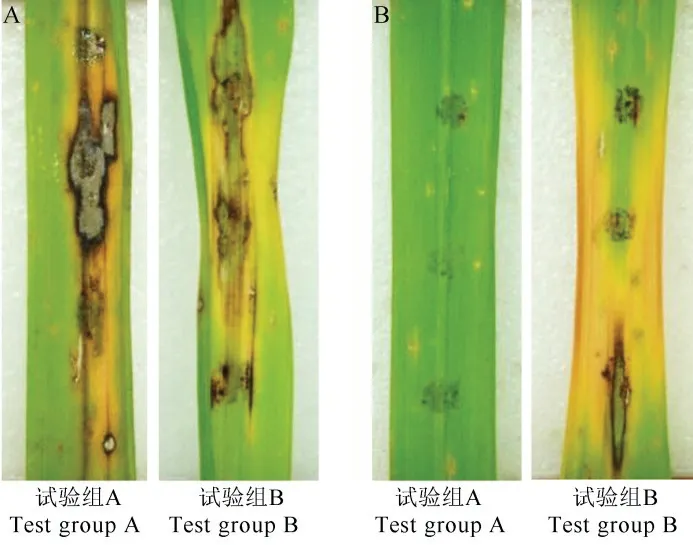
图6 JN005 菌株胞外抗菌物质对叶瘟的防治效果(离体接种)Fig.6.Control efficacy of extracellular antimicrobial substances on rice leaf blast(indoor detached-leaf inoculation).
室内湘晚籼12 号稻瘟病离体叶片接种表明,试验组A 中,对稻瘟病效果最为显著的是1500 倍75%三环唑(WP)稀释液,发病率为20.0%;而100倍胞外抗菌物质稀释液的叶瘟发病率为34.1%,较接近发病率为30.4%的500 倍40%稻瘟灵(EC)稀释液。试验组B 中,稀释1500 倍的75%三环唑(WP)发病率为23.0%,稀释500 倍的40%稻瘟灵(EC)发病率为29.6%,稀释100 倍的胞外抗菌物质发病率为38.5%,三者差异显著。根据图6,发现先进行胞外抗菌物质粗提液处理后接种的叶片防稻瘟病效果整体高于先接种后进行胞外抗菌物质粗提液处理的效果,说明提前施用JN005 菌株胞外抗菌物质粗提液有利于水稻叶片对叶瘟的防治。
活体喷雾接种试验表明,虽然100 倍胞外抗菌物质稀释液在试验组C 中防效为75.3%,试验组D中防效为71.5%,但都比不上1500 倍75%三环唑(WP)稀释液和500 倍40%稻瘟灵(EC)稀释液。各结果相比(图7),先喷施胞外抗菌物质粗提液后接种的水稻防治叶瘟效果比先接种后喷施胞外抗菌物质粗提液效果好,由此得出JN005 菌株胞外抗菌物质粗提液对水稻叶片具有保护作用。
3 讨论
芽孢杆菌生物防治剂一直在植物病害综合管理中扮演着非常重要的角色[18]。许多学者描述了枯草芽孢杆菌产生几丁质酶、蛋白、脂肽等代谢物质,这些物质具有拮抗立枯丝核菌、灰霉病菌、黑条叶斑病菌等植物病原物生长的潜力[19-22]。本研究发现,枯草芽孢杆菌JN005 能够产生蛋白酶、纤维素酶、淀粉酶和β-1, 3-葡聚糖酶,并且JN005 菌株的胞外抗菌物质在平板上对稻瘟病菌有较好的拮抗活性。
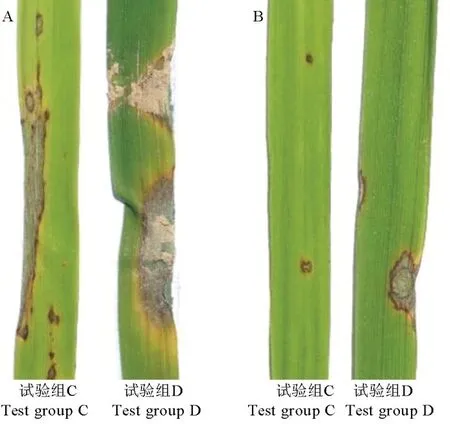
图7 胞外抗菌物质对叶瘟的防效(活体接种)Fig.7.Control efficacy of extracellular antimicrobial substances on leaf blast(indoor live inoculation).
在提取JN005 菌株胞外抗菌物质的过程中,探究了其物理和化学特性。Wang 等[23]报道枯草芽孢杆菌E1R-J 的抗菌蛋白EP-2 在40℃~100℃下孵育30 min 后均可检测到抗苹果树腐烂病菌活性,且拮抗效果仅下降14.9%;同样,本研究的枯草芽孢杆菌JN005 胞外抗菌物质在0℃~100℃范围内抗稻瘟病菌的抑菌直径未有大幅度变化,具有热稳定性。郑小亮等[24]测试枯草芽孢杆菌Zl-2 抗菌蛋白酸碱稳定性,结果显示过酸、过碱都会影响抗小麦赤霉病菌效果;而枯草芽孢杆菌JN005 胞外抗菌物质在pH 2~11 范围内均表现出对稻瘟病菌有抑菌活性,但对pH 为12 处理最敏感。黄华毅等[25]发现枯草芽孢杆菌STO-12 脂肽类物质分别与多种蛋白酶混合和紫外线照射其抑菌活性没有明显减弱;反观枯草芽孢杆菌JN005 胞外抗菌物质只有经蛋白酶K 处理后才保持其原有的抗菌效果,且紫外照射时间越长抑菌活性有所降低。张晓云等[26]的枯草芽孢杆菌CAB-1 蛋白粗提物在4℃条件下储存120 d 后抑制番茄灰霉菌活性变化不大,枯草芽孢杆菌JN005 胞外抗菌物质对稻瘟病菌也有相同的性质。
在枯草芽孢杆菌抗菌物质影响植物病原菌孢子萌发和菌丝形态方面,刘燕等[27]报道枯草芽孢杆菌SL13 抗菌几丁质酶使得立枯丝核菌菌丝细胞壁解体、原生质外泄、菌丝体破裂;吴艳清等[28]用显微镜观察到枯草芽孢杆菌WL2 脂肽粗提物能够抑制致病疫霉孢子萌发;本研究的枯草芽孢杆菌JN005 胞外抗菌物质令稻瘟病菌菌丝和孢子都生长异常,且还能阻碍孢子萌发和附着孢形成,这可能会降低稻瘟病在水稻叶片上发生的几率。
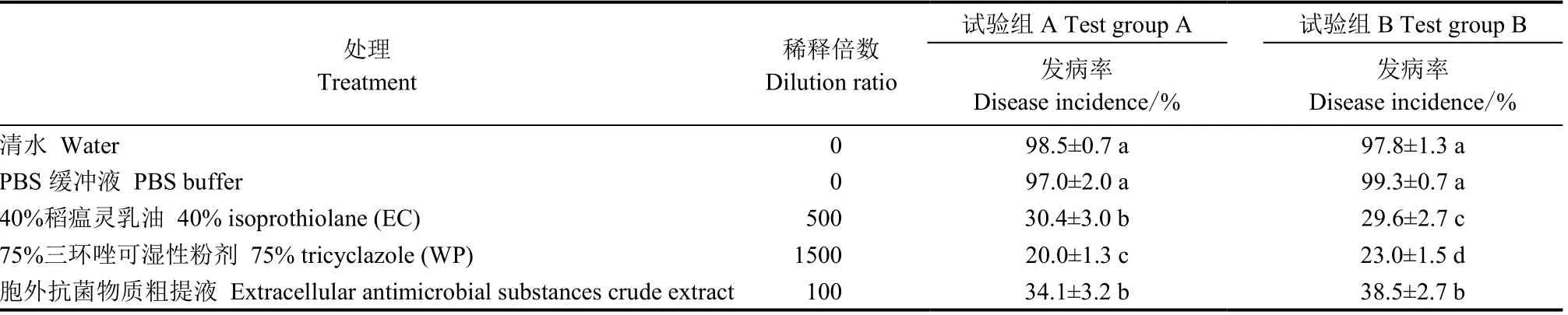
表1 JN005 菌株胞外抗菌物质粗提液对叶瘟的防效(离体接种)Table 1.Control efficacy of crude extracts of JN005 extracellular antimicrobial substances on leaf blast(indoor detached-leaf inoculation).
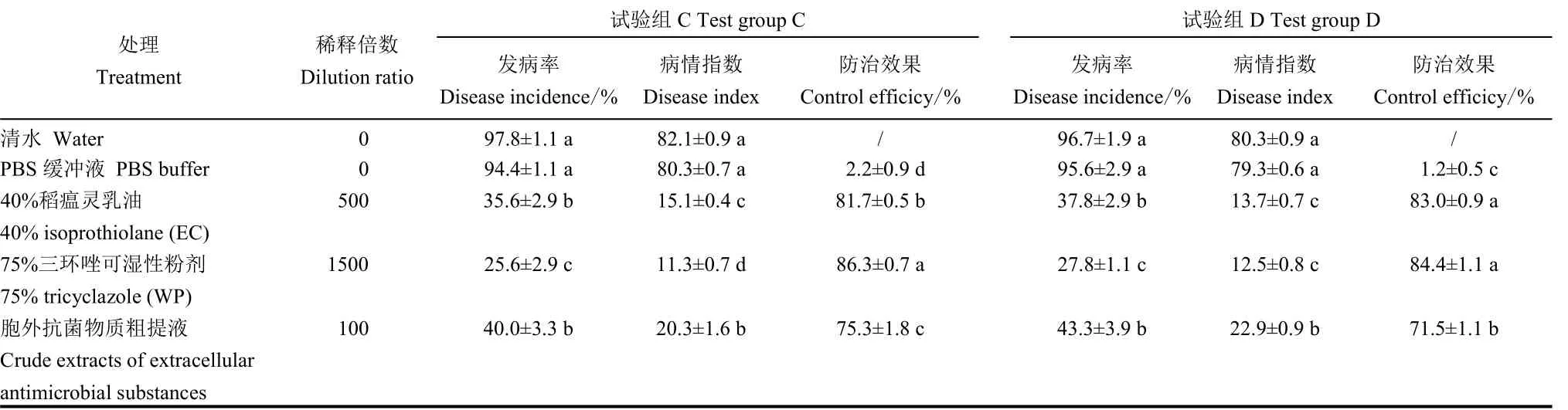
表2 JN005 菌株胞外抗菌物质粗提液对叶瘟的防效(活体接种)Table 2.Control efficacy of crude extracts of JN005 extracellular antimicrobial substances on leaf blast(indoor live inoculation).
黄娜等[29]的枯草芽孢杆菌胞外粗提蛋白防治苹果炭疽病室内活体试验表明,先蛋白处理后接种试验中,不稀释的胞外蛋白的防效可达100%,在先接种后蛋白处理的试验中,胞外蛋白的防效为55%。对于枯草芽孢杆菌JN005 胞外抗菌物质防治水稻叶瘟而言,不论是离体还是活体接种试验,提前施用胞外抗菌物质能提高防治效果,可见胞外抗菌物质一定程度上影响了叶瘟的发生,起到了保护水稻叶片的作用。稻瘟灵和三环唑是对抗稻瘟病最常用的两种化学药剂[30],而接种实验中,稀释100倍胞外抗菌物质粗提液效果比较接近40%稻瘟灵(EC),不如75%三环唑(WP)。枯草芽孢杆菌在农业方面研究得十分广泛,也被美国食品和药物管理局认定为“公认安全”的微生物[31]。考虑到枯草芽孢杆菌JN005 胞外抗菌物质的实用性,将其纯化鉴定后的物质作为防治稻瘟病的生物防治剂,应用于农业可持续发展是非常有潜力的。
