色氨酰-tRNA 合成酶基因WRS1 调控水稻种子发育
2020-09-17唐小涵刘世家刘喜田云录王云龙滕烜段二超张元燕江玲张文伟王益华万建民
唐小涵 刘世家 刘喜 田云录 王云龙 滕烜 段二超 张元燕 江玲张文伟 王益华, 万建民,
(1 南京农业大学 作物遗传与种质创新国家重点实验室/江苏省植物基因工程技术研究中心, 南京 210095;2 中国农业科学院 作物科学研究所/中国农作物基因资源与基因改良重大科学工程, 北京100081;*通信联系人, E-mail: yihuawang@njau.edu.cn)
水稻(Oryza sativaL.)作为世界上最重要的粮食作物之一,其食用部分胚乳的发育状况直接影响稻米的产量和品质。胚乳粉质主要是因为胚乳中造粉体和蛋白体充实不良、相互间存在空隙造成,该表型降低了稻米外观品质和碾磨品质,并对食味和营养品质产生影响[1]。谷类作物中,淀粉在胚乳造粉体中合成,主要由直链淀粉和支链淀粉组成。淀粉的生物合成主要通过4 类淀粉合成关键酶共同参与:ADP 葡萄糖焦磷酸化酶(AGPase)、淀粉合酶(SS)、淀粉分支酶(SBE)以及淀粉脱分支酶(DBE)[2]。另外,葡聚糖-水二激酶(GWD)、磷酸葡聚糖-水二激酶(PWD)、α-葡聚糖磷酸化酶(PHO)以及FLO6、PTST、SSG4 等靶向淀粉颗粒的蛋白被证实对淀粉合成具有重要影响[3-9]。除淀粉合成代谢途径中的关键酶类,还有证据表明,胚乳中淀粉合成也受内质网胁迫、贮藏蛋白运输异常等蛋白合成及分选相关细胞活动的影响[10]。例如,Hunter 等[11]使用基因芯片研究经典的玉米胚乳粉质突变体o1,o2,o5,o9,o11,Mc,DeB30和fl2的基因表达模式发现,编码重链结合蛋白(Bip)、蛋白质二硫键异构酶(PDI)、热激蛋白70(HSP70)等内质网胁迫响应的基因表达均显著上调。进一步研究发现,在水稻中过表达或抑制Bip1的表达都会导致内质网质量控制(ER quality control)相关基因表达上调,并形成粉质胚乳[12]。水稻PDI 缺失同样会导致籽粒粉质表型,这可能是由于内质网胁迫(ER stress)影响淀粉合成相关酶的活性[13]。此外,GPA1/OsRab5a 、 GPA2/OsVPS9a 、 GPA3 、GPA4/GOT1B和GPA6/OsNHX5等蛋白在贮藏蛋白的胞内运输以及水稻胚乳细胞内膜系统发育中起重要作用,发生基因突变会造成谷蛋白前体异常积累,且成熟种子呈现出粉质表型[14-18]。
tRNA 的氨酰化是蛋白质合成的第一步,在该过程中aaRSs 将特定氨基酸连接到同源tRNA 以完成蛋白质合成[19]。该过程分两步实现,首先aaRSs协助氨基酸与三磷酸腺苷缩合形成紧密结合的氨基酰腺苷酸(aa-AMP),释放无机焦磷酸(PPi);随后,活化的aa-AMP 从腺苷酸转移到tRNA 的3′端,形成aa-tRNA 并释放AMP 和aaRS。由于它们在蛋白质合成中的重要作用,编码aaRSs 的基因在生命诞生时随之出现,这个通常由20 个酶组成的家族(每个氨基酸对应一个aaRS)受到进化压力的限制始终保持这一基本活性[20]。基于蛋白结构特点的差异,aaRSs 被分为两类,第Ⅰ类酶具有HIGH、KMSKS 两段保守基序和罗斯曼折叠(Rossmann fold, RF)作为活性中心结构,第Ⅱ类酶催化结构则围绕反向平行的β 折叠形成,其中色氨酰-tRNA 合成酶(tryptophanyl-tRNA synthetase, WRS)属于第Ⅰ类酶,它是由两个相同亚基组成的双亚基酶,单个亚基肽链长度约330 个氨基酸,随种属来源不同长度略有变化[20-21]。
作为一类看家蛋白,aaRSs 普遍存在于所有具有蛋白质合成能力的生物体中,由于细胞器和细胞质翻译机制具有不同的系统发生起源,每一个真核生物都携带数个特定aaRSs 间隔区室,分别用于细胞质翻译及细胞器翻译[22]。除了氨基酰化功能外,大约一半的aaRSs 还具有校对功能,可以从同源tRNA 中去除错误的氨基酸[23]。同时,aaRSs 在进化过程中还衍生出其他生物学功能。以哺乳动物的WRS 为例,它可以通过选择性剪接和蛋白水解切割进一步扩展功能,并且WRS 还可以异位至细胞核乃至胞外空间,在非特异性免疫的激活、血管生成和γ-干扰素(Interferon-γ, IFN-γ)信号传导中起关键作用[24]。另外,胞质的一些aaRSs 和1~3 个辅助因子组成多合成酶复合物(multi-protein complex,MSC)保留在胞质中,可以在特定的生理或应激条件下从这些复合物中释放出来,重新定位到其他亚细胞区室发挥非常规功能。综合这些特性,高等生物中的氨酰-tRNA 合成酶被认为是“系统内稳态的守护者”[25-26]。
在植物中,关于aaRSs 在生长发育中所起的生物功能方面的研究也取得了一些进展。拟南芥有45个aaRSs,其中21 个是胚珠发育和胚胎发生所必需的[27]。水稻谷氨酰-tRNA 合成酶OsERS1 在花药发育早期维持体细胞组织正常发育,并限制雄性生殖细胞的过度增殖[28]。定位于线粒体的半胱氨酰-tRNA 合成酶(SYCO)在雌性配子体的中央细胞中表达,影响相邻的反足细胞寿命[29]。一些质体定位的aaRSs 突变体植株呈现明显的叶色表型,伴随细胞器数量显著减少或叶绿体中核糖体生物合成缺陷等问题[30-32]。编码线粒体天冬氨酰-tRNA 合成酶(AspRS)的OKI1通过维持WUS-CLV3 反馈调节途径关键基因表达以维持茎间分生组织(SAM)的大小[33]。小麦TaMetRS基因受脱氧雪腐镰刀菌烯醇激活表达,影响其他基因的转录以抵御真菌病原体或真菌毒素[34]。IBI1编码的天冬氨酰-tRNA 合成酶(AspRS)作为β-氨基丁酸(BABA)的植物受体参与防御反应[35]。但植物中有关色氨酰-tRNA 合成酶的研究尚未见报道。
本研究中发现了一个wrs1突变体,该突变体成熟种子胚乳腹部粉质皱缩,纯合突变体幼苗致死,进一步分析该突变体的籽粒理化性质并结合胚乳淀粉结构观察,发现该突变体存在明显的淀粉合成缺陷,通过图位克隆的方法证明该表型是由编码色氨酰-tRNA 合成酶(WRS1)的基因突变造成,该基因在胚乳中有较高的表达量。我们的数据还表明,这个细胞质定位的色氨酰-tRNA 合成酶突变后可能影响游离氨基酸稳态,进而阻碍蛋白的合成和淀粉的积累,最终导致胚乳发育和水稻幼苗生长严重受阻。
1 材料与方法
1.1 材料
wrs1是从籼稻品种N22 的EMS 突变体库中筛选得到的一份稳定遗传的胚乳腹部粉质皱缩突变体。选择杂合单株与粳稻品种滇粳优1 号配制杂交组合用于基因的精细定位。
基因定位的F2群体种植于南京农业大学土桥实验基地,其余实验材料种植于南京农业大学牌楼实验基地。
1.2 扫描电镜观察
将野生型和突变体成熟种子自然断开,后续样品的制备由南京农业大学生命科学学院电镜实验室完成,采用日立S-3000N 电子扫描显微镜观察和拍照记录。
1.3 胚乳半薄切片观察
取灌浆10 d 的胚乳,参照Long 等[36]所述方法切成1 μm 厚度的薄片。切片用0.05% I2-KI 溶液染色后,在Zeiss AX10 荧光显微镜下观察和拍照。
1.4 成熟种子理化指标测定
成熟种子去壳,磨成米粉并过筛(孔径为0.15 mm),50℃下烘干至恒重。
采用Megazyme 总淀粉测定试剂盒测定总淀粉含量。按照农业部NY147-88 标准测定直链淀粉含量。采用全自动凯氏定氮仪(KJELTEC2300 型,FOSS 公司)测定总氮含量,换算成蛋白质含量(转换系数为5.95),根据种子干质量进一步计算出平均每粒糙米蛋白含量。参考Long 等[36]所述方法进行米粉尿素膨胀实验,量取并记录装有0~9 mol/L尿素溶液的离心管中米粉可溶部分的体积,淀粉颗粒的膨胀体积=总体积(1 mL)-可溶部分体积。采用RVA(Rapid Visco Analyzer,瑞典波通公司)快速黏度分析仪进行米粉的黏度特性分析,每个样品准确称取3.0 g 米粉,加入25 mL 蒸馏水混合均匀后测定。采用全自动氨基酸分析仪(日本Hitachi公司,L-8900 型)测定游离氨基酸含量,每个样品准确称取0.4 g 米粉,充分溶解于1.5 mL 纯水,将样品置于摇床4℃下旋转过夜;12 000 r/min 下离心15 min后吸取上清液于新的离心管中并加入等体积4%磺基水杨酸溶液,混匀后12 000 r/min 下离心15 min,0.22 μm 水系滤头过滤上清液用于测定。
所有测定每个样品重复3 次,取平均值。
1.5 WRS1的图位克隆和转基因后代鉴定
选择杂合单株与粳稻品种滇粳优1 号配制杂交组合,分单株收取F1植株上的种子,从有分离的单株中选取与突变体表型一致的粉质皱缩籽粒,利用溴化十六烷基三甲铵(cetyltrimethylammonium bromide, CTAB)法提取种子DNA,进行基因定位。InDel 标记来自 RiceVarMap(http://ricevarmap.ncpgr.cn/)。PCR 扩增体系包括DNA 模板(约40 ng)1 μL,前后引物各(2 μmol/L)1 μL,dNTPs(10 mmol/L)0.03 μL,rTaqDNA 聚合酶(5 U/μL,TaKaRa)0.1 μL,10×缓冲液(含有Mg2+)1 μL,加ddH2O 至10 μL。用聚丙烯酰胺凝胶电泳分离PCR 产物。
利用胚乳粉质皱缩的wrs1种子进行转基因互补试验。提取T0代转基因植株叶片的DNA,分别进行转基因阳性PCR 检测,N10 为633 bpWRS1基因特异的编码区片段的扩增引物,Hyg 为1081 bp的潮霉素选择标记基因片段的扩增引物(表1)。收获突变体背景的转基因阳性植株上的种子(T1代),单粒播种,出苗后提取幼苗DNA,使用引物N4(前后引物均位于基因组序列上)进行扩增,并测序验证突变位点(野生型中碱基为G,突变体中碱基为T),当突变位点纯合而种子表现透明视为互补。
1.6 RNA 提取以及qRT-PCR
使用植物总RNA 提取试剂盒(康为世纪公司)提取不同组织的总RNA。反转录得到cDNA 后,在美国ABI 7500 型荧光定量PCR 仪(ABI-PRISM 7500HT)上扩增,进行 qRT-PCR 分析,以水稻Ubiqutin基因(Os03g0718100)作为内参,每个样品做3 次重复。采用2−ΔΔCT法进行计算。
反应体系(20 μL)包括SYBR Premix ExTaqTM(TaKaRa) 10 μL,2 μmol/L 前后引物混合液5 μL,模板cDNA 5 μL(10~30 ng)。
反应程序:95℃下预变性30 s,95℃下5 s,60℃下34 s,循环数为40;添加溶解曲线95℃下15 s,60℃下1 min,95℃下15 s。
1.7 生物信息学分析
在NCBI 网站(http://www.ncbi.nlm.nih.gov/)搜索并下载不同物种色氨酰-tRNA 合成酶的同源蛋白,使用MEGA7 软件进行进化树构建,从PHYRE2网站(http://www.sbg.bio.ic.ac.uk/phyre2/)获得蛋白质二级结构预测, 使用 ESPript3.0 网站(http://espript.ibcp.fr/ESPript/ESPript/)进行氨基酸序列比对。
1.8 GUS 染色
GUS 工作液含50 mmol/L 磷酸缓冲液(pH 7.0,避光保存),0.1% Triton X-100,1 mmol/L 铁氰化钾,1 mmol/L 亚铁氰化钾,10 mmol/L EDTA,1 mg/mL X-Gluc。将配制好的GUS 染液加入15 mL离心管中,将转基因样品完全浸没在染色液中,置于37℃培养箱过夜,染色后用75%乙醇对叶绿素脱色,然后拍照记录。
1.9 亚细胞定位
构建WRS1片段与GFP 融合载体。挑选单克隆,测序验证正确后采用TIANGEN 公司的无内毒素质粒大提试剂盒(DP117)提取质粒。参考文献[31]进行水稻原生质体分离。使用Leica 公司SP8 型激光共聚焦显微镜观察WRS1 的亚细胞定位情况。
1.10 种子蛋白提取以及Western blotting 分析
将成熟种子磨粉,每1 mg 米粉加入20 µL 蛋白提取液[SDS 4.0 g,尿素24.0 g,1 mol/L Tris-HCl(pH 6.8)12.5 mL;β-巯基乙醇5 mL;ddH2O 定容到100 mL;加入适量溴酚蓝指示剂],涡旋振荡充分溶解,50℃下烘12 h。配制浓度为8%~18%的聚丙烯酰胺梯度分离胶,电泳结束后利用湿转设备(Bio-Rad 公司)将蛋白转印到孔径为0.45 μm 的聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF),转膜结束后,将PVDF 膜在5%脱脂牛奶(PBST 溶解;PBST 配方:氯化钠8 g,氯化钾0.2 g,磷酸氢二钾0.27 g,磷酸氢二钠3.85 g,500 µL 吐温-20,双蒸水定容至1 L)中封闭1 h,然后移至新的封闭液中加入一抗(1∶1000)孵育2 h,PBST 漂洗PVDF膜3 次,每次5 min;将PVDF 膜转移至封闭液稀释的二抗溶液(1∶5000)中孵育1 h,PBST 漂洗PVDF 膜3 次,每次10 min。采用化学发光法(ECL)曝光。内参抗体为Actin 单克隆抗体(Sigma 公司)。
2 结果与分析
2.1 wrs1突变体的表型分析
与野生型N22 相比,wrs1突变体的成熟种子表现出胚变大、胚乳粉质皱缩的表型。种子横断面观察发现突变体种子中部和腹部表现为粉质,背部则相对透明(图1-A~B)。进一步利用扫描电镜观察发现,不同于野生型中高度紧密、相互挤压成多面体排布的淀粉颗粒(图1-C~E),wrs1粉质部位的淀粉颗粒呈球体,排列较松散(图1-F~H)。wrs1成熟种子千粒重下降了16.33%(图1-N),粒宽略有下降(图1-O)。
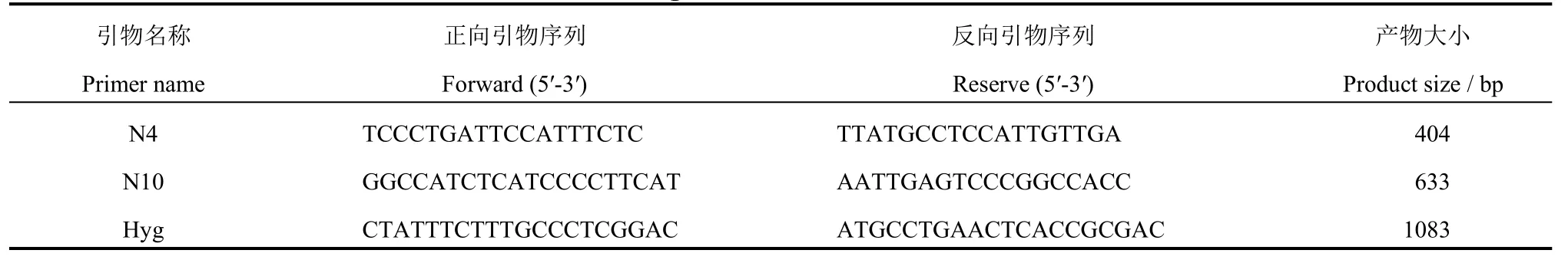
表1 wrs1转基因家系鉴定所用引物Table 1.Markers used for identification inwrs1 transgenic lines.
对吸胀10 h 的种胚横截面观察,wrs1胚部变得狭长,结构分化相对模糊(图1-I~J)。与野生型相比,wrs1自种子萌动阶段始终表现出明显的发育滞后,20 d 后逐渐萎蔫死亡(图1-K~M)。以上结果表明wrs1突变体在胚乳发育、种胚形成、植株生长等多方面存在明显缺陷。
2.2 wrs1与野生型成熟籽粒理化性质
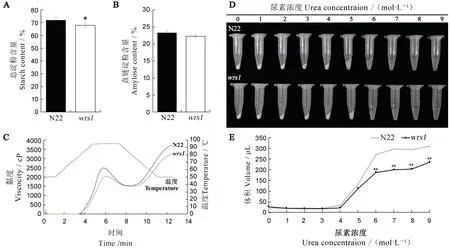
图2 野生型和wrs1 突变体种子淀粉含量和理化特性分析Fig.2.Content and physicochemical characteristics of starches in mature seeds of wild-type and thewrs1 mutant.
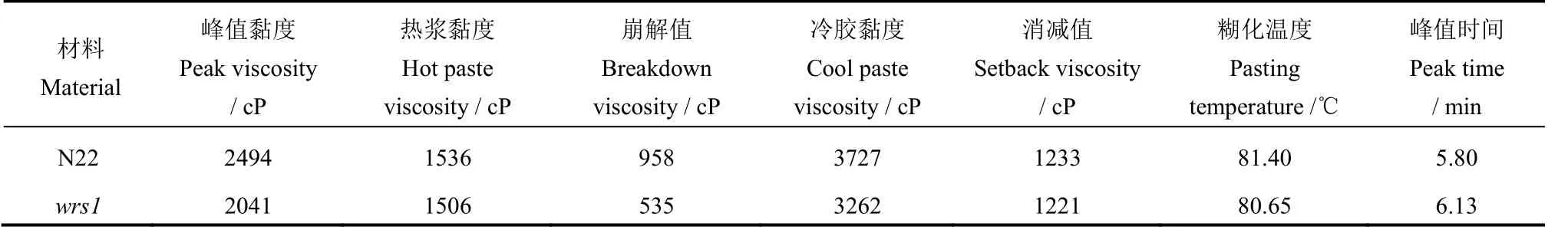
表2 野生型wrs1 突变体淀粉RVA 谱特征分析Table 2.Analysis of RVA characteristic values of starch in wild-type and thewrs1mutant.
与野生型相比,wrs1突变体籽粒总淀粉含量下降了7.18%,直链淀粉含量无差异(图2-A~B)。基于上述淀粉颗粒形态及总淀粉含量的变化,对突变体中淀粉理化特性进一步探究。RVA 谱分析野生型和突变体淀粉糊化特性的变化,结果表明wrs1突变体淀粉的黏度分布类似于野生型但水平较低,其峰值黏度和最终黏度分别为野生型的81.84%和87.52%(图2-C,表2)。尿素浓度梯度溶解实验显示,突变体米粉更难溶于尿素溶液中,在4 mol/L时突变体和野生型溶解体积出现差异,6 mol/L 时差异达到显著(图2-D~E)。综上所述,wrs1突变体中胚乳的主要填充物淀粉的含量及理化特性发生相应改变。
2.3 wrs1造粉体发育异常
鉴于以上观察到的胚乳表型,我们想知道wrs1突变体造粉体发育是否存在异常。取开花后8 d 的胚乳样品制备半薄切片并通过I2-KI 染色观察。结果显示,野生型中造粉体发育正常,内部包含典型的水稻复合淀粉颗粒,淀粉颗粒充实,呈规则的多面体晶体结构(图3-A~C),而突变体中复合淀粉颗粒变小,淀粉颗粒间疏松排列,存在较多单粒淀粉颗粒(图3-D~F)。相应地,与粉质程度相对较轻的种背部分胚乳(图3-A,D)相比,wrs1突变体发育胚乳的中部(图3-B,E)与腹部(图3-C,F)观察到更明显的造粉体发育迟滞。该结果表明,wrs1突变体中淀粉颗粒填充受到影响。
2.4 WRS1的图位克隆
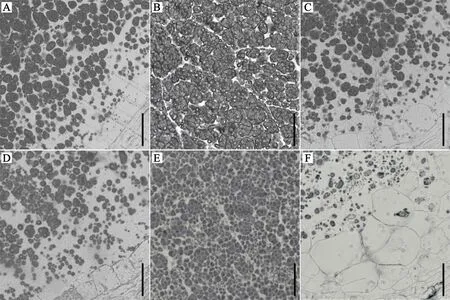
图3 野生型和wrs1 突变体发育中的胚乳半薄切片观察Fig.3.Semi-thin section analysis of developing endosperm of wild-type and thewrs1 mutant.
由于wrs1突变体纯合致死,将wrs1杂合植株与粳稻滇粳优1 号配组,从F2群体中挑选46 个具有粉质胚乳表型的隐性极端个体,利用133 个覆盖水稻12 条染色体的InDel 和SSR 多态性标记进行连锁分析。初步将基因定位在第12 染色体长臂的3.7 Mb 区间内,进一步筛选了974 个极端个体并开发标记将基因限定在183 kb 区间内(图4-A)。利用NCBI 数据库预测,该区间内有16 个开放读码框(open reading frames, ORFs)。进一步测序发现wrs1突变体在基因Os12g0540900的第6 外显子上存在一个SNP(由G 变成T),导致甲硫氨酸(Met)被异亮氨酸(Ile)替换(图4-B)。Os12g0540900基因编码区序列全长1227 bp,编码一个色氨酰-tRNA 合成酶(WRS1)。
为验证Os12g0540900是目的基因,构建了由花椰菜花叶病毒的35S 启动子驱动WRS1编码区的pCAMBIA1305.1-WRS1-GFP 载体,转化wrs1突变体愈伤。提取T0代转基因植株叶片的DNA,进行转基因阳性PCR 检测(图4-C),进一步测序确认转基因阳性家系基因组序列中Os12g0540900基因型与突变体一致,且植株能正常生长、种子表型恢复透明(图4-D)。因此,突变的Os12g0540900确实是导致wrs1表型的基因。
WRS1基因编码一个具有471 个氨基酸的蛋白,进化树分析显示该蛋白在真核生物中广泛存在(图5-A),具有一个高度保守的核苷酸转移酶超家族的催化核心结构域,其中包含Ⅰ类氨酰-tRNA 合成酶特有的HIGH 和KMSKS 基序(图5-B)[20-21],wrs1突变位点是核心结构域的保守位点(图5-C)。
2.5 WRS1的表达模式分析
为探究WRS1在各器官中的表达,利用qRT-PCR 进行检测,发现其在植株中呈组成型表达,且在发育的胚乳中有较高的表达量(图6-A)。同时,构建了WRS1启动子驱动β-葡萄糖苷酸酶基因(β-glucuronidase,GUS)表达的载体转化到日本晴中。对阳性转基因植株不同组织的GUS 染色发现,WRS1在根、茎、叶、鞘、穗中均有一定表达,在发育种子中表达量最高(图6-B)。
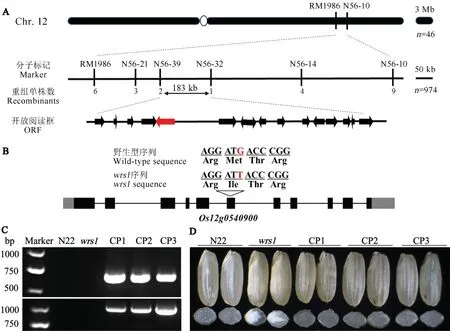
图4 WRS1的图位克隆Fig.4.Map-based cloning ofWRS1.
为确定WRS1 的亚细胞定位,分别构建了WRS1 的C 端融合绿色荧光蛋白(green fluorescent protein, GFP)标签与N 端融合GFP 标签的瞬时表达载体转入水稻原生质体中观察荧光信号,发现两个表达载体的GFP 荧光信号均弥散在细胞质中(图6-C)。因此,WRS1 是一个胞质定位的蛋白。
2.6 淀粉合成相关基因表达分析
由于wrs1突变体成熟种子腹部粉质皱缩,具有明显的淀粉合成缺陷表型,因此,利用qRT-PCR比较N22 与wrs1突变体发育12 d 胚乳中淀粉合成相关基因表达水平,结果显示突变体中大部分基因表达水平发生下调(图7-A)。随后通过Western blotting 对成熟籽粒中部分淀粉合成酶的蛋白水平进行检测,结果显示突变体胚乳中GBSSⅠ蛋白水平上升,PHOⅠ、FLO4 蛋白水平较野生型明显下调表达,BEⅠ、BEⅡb、SSⅢa 蛋白水平略微下降(图7-B)。因此,推测WRS1突变导致淀粉合成途径产生缺陷,导致淀粉含量降低,复合淀粉颗粒减少(图2-A,图3),形成胚乳皱缩表型。
2.7 WRS1基因突变影响氨基酸稳态
氨酰-tRNA 合成酶在维持蛋白质合成与细胞稳态中起着至关重要的作用[28]。比较野生型和wrs1成熟籽粒的蛋白含量,wrs1中平均每粒糙米蛋白含量降低7.35%(图8-A),暗示基因的突变可能影响了种子中蛋白的合成。进一步对野生型N22 和wrs1突变体中游离氨基酸含量进行测定,结果显示wrs1突变体中游离氨基酸总量极显著增加,各类游离氨基酸含量均显著增加,其相对含量也表现出不同的变化(图8-B~D)。基于上述结果,说明wrs1突变体籽粒中蛋白质合成量减少,氨基酸稳态受到破坏。
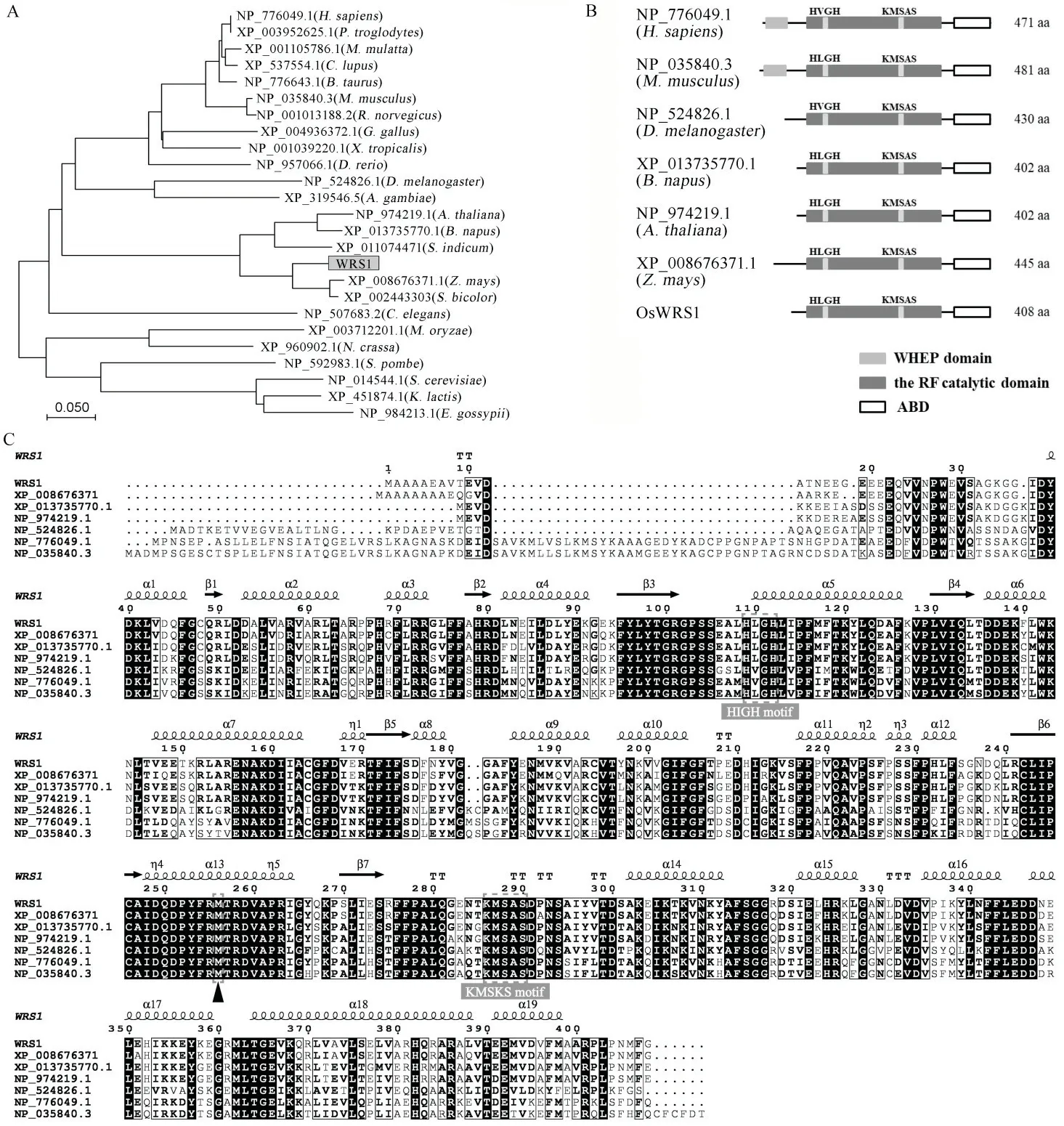
图5 WRS1 与其同源蛋白结构及进化树分析Fig.5.Structure and phylogenetic analysis of WRS1 protein and its homologs.

图6 WRS1的表达模式和亚细胞定位Fig.6.Expression pattern and subcellular localization ofWRS1.
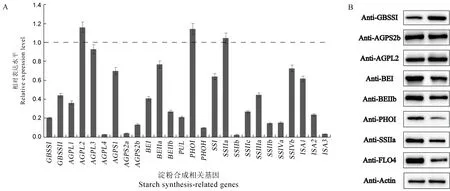
图7 淀粉合成相关基因的表达及淀粉合成酶蛋白的积累Fig.7.Expression and immunoblotting analyses of starch synthesis-related genes.

图8 wrs1突变体的蛋白含量与游离氨基酸含量Fig.8.Contents of protein and free amino acids inwrs1.
3 讨论
本研究通过筛选EMS 处理的N22 突变体库发现一个籽粒腹部粉质皱缩突变体wrs1。与野生型N22 相比,wrs1成熟种子横断面中央和腹部区域呈现粉质。扫描电镜显示,wrs1中淀粉颗粒变圆且排列松散,这种变化在种子中央和腹部区域尤其显著。进一步半薄切片观察到开花后8 d 的细胞中造粉体数目较少,且呈现出较疏松的结构。此外,wrs1成熟种子千粒重及淀粉含量显著下降,淀粉黏度特性、尿素溶液的溶解特性发生显著变化。基于上述结果,可以认为wrs1胚乳中存在淀粉发育缺陷的现象,wrs1是一个新的水稻胚乳发育异常突变体。
通过构建突变体wrs1与粳稻品种滇粳优1 号的F2定位群体,我们利用图位克隆将该突变基因定位在第12 染色体的长臂标记N56-32 与N56-39 之间约183 kb 区间内,其中包含16 个预测的开放阅读框。基因测序发现Os12g0540900基因的第6 个外显子上存在单碱基突变,导致甲硫氨酸(Met)被异亮氨酸(Ile)替换。构建由花椰菜花叶病毒的35S启动子驱动WRS1全长CDS的pCAMBIA1305.1-WRS1-GFP 载体并侵染wrs1突变体的愈伤组织,转基因阳性家系种子表型恢复透明。由此证实了Os12g0540900确实是导致wrs1表型的基因。WRS1在植物体中组成型表达,且胚乳中表达量较高。我们利用qRT-PCR 比较了野生型与突变体中这些淀粉合成关键基因表达情况,发现大部分淀粉合成相关基因下调表达,检测部分重要的淀粉合成酶蛋白积累情况,其在野生型和突变体中所呈现的差异与基因表达水平的差异并不完全一致。由此认为wrs1中的籽粒表型和理化性质变化可能归因于WRS1基因间接影响多个水稻淀粉合成相关基因表达的联合效应。另外,对成熟籽粒蛋白质含量、游离氨基酸含量进行测定,突变体wrs1蛋白含量显著降低,游离氨基酸含量极显著上升。综合以上结果,WRS1编码一个影响水稻种子胚乳发育的关键基因,且WRS1可能通过影响到蛋白合成和体内氨基酸稳态而间接影响到胚乳的发育。
WRS 属于Ic 类aaRSs 家族,含有一个RF 结构域以及两个高度保守基序,其中KMSKS 基序用于促进氨基酸活化,HIGH 基序负责氨基酸活化过程中稳定ATP,并在tRNA 的3′端稳定氨基酸转移,此外,还有C 末端的α 螺旋结构域作为tRNA 反密码子的结合位点。本研究克隆到了植物中的WRS基因,同源蛋白序列比对显示,WRS1 具有上述Ic类aaRSs 家族承担核酸到蛋白质的信息转化功能的保守结构。亚细胞定位结果显示,水稻WRS1 是一个细胞质定位的蛋白,由于植物的蛋白质合成在胞质、叶绿体、线粒体三个细胞区室中发生,因此水稻中还存在着其他WRS基因维持叶绿体和线粒体中的蛋白正常合成。同源比对发现,基因Os01g0743400编码的WRS2 与拟南芥中叶绿体和线粒体双定位的TrpRS(At2g25840编码)[22]高度同源。基于上述结果,推测WRS1 主要负责胞质中的蛋白合成,而WRS2 负责叶绿体和线粒体的蛋白质合成。蛋白合成是一个复杂而精密的过程,线性遗传信息被解码成蛋白质,这种大分子对几乎所有的生物途径都有贡献[38]。在这期间aaRSs 协助tRNA 结合对应氨基酸,完成对mRNA 链的解读。多肽链在核糖体上被合成之后转运往内质网和高尔基体进一步折叠和修饰。目前已报道的蛋白合成突变体如核糖体大亚基蛋白3B 突变体rml1[39]、真核翻译延伸因子eEF1A 突变体spl33[40]的研究中未见胚乳淀粉合成缺陷的表型。另外,植物中aaRSs参与配子发生与胚发育[28]、茎分生组织发育[33]、质体的早期发育[31]及免疫信号的感知与病害防御[34]等生物学过程已有相关研究,足以说明该家族蛋白对植物生长发育进程中的多方面造成影响。目前有关色氨酰-tRNA 合成酶功能研究的报道主要是以高等动物为对象,其功能的延展涉及蛋白域特异性结合、激酶抑制剂活性、蛋白同源二聚化等,并且有证据显示这些功能与脊椎动物特有的WHEP 结构域关系密切[21,41-42]。本研究在植物中克隆到WRS1基因,该基因缺乏WHEP 结构域,但从其特殊的胚乳缺陷表型来说,植物中WRS 蛋白可能存在的多功能性还需进一步探讨。
综上所述,色氨酰-tRNA 合成酶WRS1 的突变影响了细胞的蛋白翻译系统,打破了游离氨基酸的稳态,影响了蛋白的合成和淀粉的积累,导致胚乳发育和幼苗生长严重受阻,WRS1对水稻种子发育与植株的生长至关重要。
谢辞:感谢农业部长江中下游粳稻生物学与遗传育种重点实验室/长江流域杂交水稻协同创新中心/江苏省现代作物生产中心对本研究给予资助。本项目还受到江苏省农业科技自主创新基金[CX(19)1002]和南京农业大学中央高校基本科研业务费(KYTZ201601)等项目的资助。
