黏性红酵母WP3 产培养基条件的响应面优化*
2020-09-16王蓉
王 蓉
(湖南环境生物职业技术学院图书馆,湖南 衡阳 421005)
类胡萝卜素是最大的一类天然有机色素,在一些微生物和植物中均有发现[1]。SUTTER 与WHITAKER[2]将类胡萝卜素进行分类,划分为碳水化合物类胡萝卜素和氧化的叶黄素两组,代表物分别为β-胡萝卜素和虾青素。能合成类胡萝卜素的微生物有藻类、霉菌、酵母、细菌[3]。对比来说,酵母生产类胡萝卜素更具优势,原因是酵母为单细胞生物,且生长周期短[4]。红酵母发酵存在较多影响因素,其中比较重要的是周围环境与发酵参数,尤其是培养基条件[5]。
本文采用从苹果皮上分离得到的菌株黏性红酵母WP3[6]进行类胡萝卜素发酵。首先进行单因素试验,分别是碳源、氮源、接种量和初始pH 值4 个因素。接着对单因素试验进行方差分析,得出其中的显著性因素。而后采用响应面法中的Box-Behnken 设计进一步优化类胡萝卜素生产,得到最佳参数。以最佳参数发酵,将得到的实际类胡萝卜素产量与预测值进行比较,以期用于工业化生产。
1 黏性红酵母产培养基条件优化实验材料与方法
1.1 材料与试剂
试验菌株:Rhodotorula mucilaginosaWP3[6],使用试剂为国产分析纯,参见文献[7]。
1.2 仪器与设备
使用仪器参见文献[8]。
1.3 试验培养基
斜面培养基:葡萄糖20 g,酵母粉10 g,蛋白胨20 g,琼脂20 g,补水至1 000 mL,自然pH 值。
MS3 培养基:葡萄糖30 g,酵母粉1.5 g,NH4NO35 g,KH2PO41 g,MgSO4·7H2O 0.4 g,NaCl 0.4 g,补充自来水至1 000 mL(添加微量元素)[9]。
MS3-A 培养基:酵母粉1.5 g,KH2PO41 g,NH4NO35 g, MgSO4·7H2O 0.4 g,NaCl 0.4 g,补充自来水至1 000 mL(添加微量元素)。
MS3-1 培养基:葡萄糖30 g,酵母粉1.5 g,KH2PO41 g,MgSO4·7H2O 0.4 g,NaCl 0.4 g,补充自来水至1 000 mL(添加微量元素)。
MS3-2 培养基:葡萄糖30 g,KH2PO41 g,NH4NO35 g,NaCl 0.4 g, MgSO4·7H2O 0.4 g,补充自来水至1 000 mL(添加微量元素)。
1.4 试验方法
1.4.1 保藏菌种
配制斜面培养基,将培养基加热融化,分装到试管,然后将分装的试管放入灭菌锅灭菌,趁热摆出斜面。用接种环将菌株WP3 在斜面划“Z”字形,将划好的试管放入28 ℃培养箱培养2 d,之后放入4 ℃冰箱保藏,一个月转接一次进行活化[10]。
1.4.2 培养种子
用接种环挑一环活化的菌株WP3 接种于装有50 m LMS3 培养基的150 mL 锥形瓶中,在30 ℃,150 r/min[11]的摇床中培养3 d。取5 mL 培养液放入装有50 mL MS3 培养基的容量为150 mL 的锥形瓶中,在30 ℃,150 r/min 的摇床中继续培养3 d。将培养液离心,取细胞沉淀加无菌水,混匀后计数,使接种量一致达到107个/mL[12]。
1.4.3 摇床发酵
无菌吸取一定量的种子液放入装有300 mL 培养基的500 mL 锥形瓶中,使接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d[4],一次做3 组平行试验[13]。
1.4.4 测定生物量
将发酵液摇匀,取一定量该液体离心去上清,加等体积水重悬,应用紫外可见分光光度计测其在600 nm 处的吸光度值[14]。
1.4.5 提取类胡萝卜素
提取方法参见文献[8]。
1.4.6 测定类胡萝卜素含量
用紫外可见分光光度计测定发酵液在最大吸收波长450 nm 处的吸光度值,类胡萝卜素含量的计算公式[14]为

式中:A为测定液在450 nm 处的吸光度值;V为测定液体积为消光系数,指450 nm 的光线透过装有质量分数为1%的类胡萝卜素标准品的内径为10 mm 的比色杯时的吸光度值;P为用来提取类胡萝卜素的发酵液体积,L。
1.4.7 单因素试验
1.4.7.1 培养基组分的单因素试验
1.4.7.1.1 最佳碳源的确定
往MS3-A 培养基中分别加入质量浓度为30 g/L的不同碳源(葡萄糖、麦芽糖、蔗糖、果糖、甘油),自然pH 值,装液量为300 mL/500 mL。将菌株WP3 接种至培养基中,使接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。结束培养后,进行生物量与类胡萝卜素含量的测定,以研究最适碳源。
以MS3-A 为基础培养基,各加入果糖,使其质量浓度分别为10 g/L,20 g/L,30 g/L,40 g/L,50 g/L,维持自然pH,装液量为300 mL/500 mL。将菌株WP3 接种至培养基中,接种量为107个/mL。在30℃,150 r/min 的摇床中培养7 d。结束培养后,进行生物量与类胡萝卜素含量的测定,以研究最佳碳源质量浓度。
1.4.7.1.2 最佳氮源的研究
1) 无机氮源。往MS3-1 培养基里各加入不同氮源(KNO312.63 g,NH4Cl 6.69 g,NH4NO35 g),使含氮量达到1.75 g/L,装液量为300 mL/500 mL。将菌株WP3 接种至培养基中,接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。结束培养后,进行生物量与类胡萝卜素含量的测定,以研究最佳无机氮源。
在MS3-1 培养基里加入不同质量浓度的NH4Cl(1.15 g/L,2.29 g/L,3.44 g/L,4.59 g/L,5.73 g/L,6.88 g/L),装液量为300 mL/500 mL。将菌株WP3接种至培养基中,接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。结束培养后,进行生物量与类胡萝卜素含量的测定,以研究最佳无机氮源浓度。
2) 有机氮源。往MS3-2 培养基里各加入质量浓度为10 g/L 的有机氮源(尿素、酵母粉、蛋白胨),装液量为300 mL/500 mL。将菌株WP3 接种至培养基中,接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。结束培养后进行生物量与类胡萝卜素含量测定,以研究最适有机氮源。
以MS3-2 为基础培养基,各加入酵母粉,使质量浓度分别为3 g/L,5 g/L,10 g/L,15g/L,装液量为300 mL/500 mL。将菌株WP3 接种至培养基中,接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。结束培养后,进行生物量与类胡萝卜素含量的测定,以研究最佳有机氮源浓度。
1.4.7.2 摇床发酵条件的单因素试验
1) 接种量。配制MS3 培养基,装液量均为300 mL/500 mL,使接种量变化,各达105个/mL、105.5个/mL、106个/mL、106.5个/mL、107个/mL,置30 ℃,150 r/min 的条件下发酵7 d。终止发酵后,进行生物量与类胡萝卜素含量的测定,求得最适接种量。
2) 初始pH 值。配制MS3 培养基,装液量为均300 mL/500 mL,使初始pH 值不同,分别为4,5,5.5,6,6.5,7,7.5,8,将菌株WP3 接种至培养基中,接种量为107个/mL。在30 ℃,150 r/min 的摇床中培养7 d。培养结束后,测量类胡萝卜素含量和生物量,得出最佳初始pH 值。
1.4.8 单因素试验的方差分析
综合试验对类胡萝卜素含量的影响,对单因素试验进行方差分析,根据P值选出显著的影响因子(P<0.05 为差异显著,P<0.01 为差异高度显著,P<0.001 为差异极显著)[15]。
1.4.9 响应面优化试验
根据单因素试验,得出对类胡萝卜素含量影响的显著因子,选择Design Expert 8.0 软件[16],将响应值设为类胡萝卜素含量,进一步优化,确定最优工艺参数,用该参数进行验证。
2 黏性红酵母产培养基条件优化实验结果与分析
2.1 培养基组分的单因素试验
2.1.1 最佳碳源的确定
培养结束后,测量类胡萝卜素含量和生物量,结果见文献[8]。通过分析得出果糖为最佳碳源,最佳果糖质量浓度为40 g/L。
2.1.2 最佳氮源的研究
1) 无机氮源。培养结束后,测量类胡萝卜素含量和生物量,结果见文献[7]。通过分析得出最佳氮源为氯化铵,最佳氯化铵氮质量浓度为0.9 g/L,即氯化铵质量浓度为3.44 g/L。
2) 有机氮源。培养结束后测量类胡萝卜素含量和生物量,见图1 和图2(均显示均值标准差)。

图1 几种有机氮源对Rhodotorula mucilaginosa WP3生物量和类胡萝卜素合成的影响

图2 不同浓度酵母粉对Rhodotorula mucilaginosa WP3生物量和类胡萝卜素合成的影响
由图1 可见添加尿素时生物量最小,细胞生长不好,而添加酵母粉时生物量最大,菌株长势较好,表明加入尿素不适于红酵母生长;而加入酵母粉时,测得最大类胡萝卜素含量,加入蛋白胨时,得到最小类胡萝卜素含量,表明添加蛋白胨对合成类胡萝卜素不利,综合可见酵母粉是最佳有机氮源。FERRAO 等[17]研究禾本红酵母RC04 在β-胡萝卜素合成和细胞生长时不同碳源的影响,得出有机氮源中最利于细胞生长和β-类胡萝卜素合成的有机氮源也是酵母粉。
由图2 可见酵母粉浓度越大,菌株生物量也越大,表明稍高浓度酵母粉促进菌株生长。添加质量浓度为15 g/L 酵母粉,得到最低类胡萝卜素含量,表明类胡萝卜素的次级代谢合成同菌株生长不是正比关系。添加质量浓度为10 g/L 酵母粉,得到类胡萝卜素含量最大,细胞长势也较好,说明酵母粉最佳质量浓度为10 g/L。翟红梅[18]用红酵母进行5 L罐发酵,结果显示质量浓度为20 g/L 是酵母粉最适宜质量浓度,此试验与本研究有出入,大致缘由是菌株差异。
2.2 摇床发酵条件的单因素试验
1) 接种量。结束培养后进行生物量与类胡萝卜素含量的测定,见图3(显示均值标准差)。
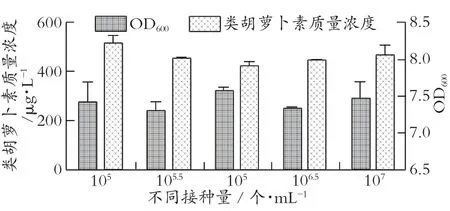
图3 接种量对Rhodotorula mucilaginosa WP3生物量和类胡萝卜素合成的影响
由图3 可见,当接种量达到3.16×105个/mL(即105.5个/mL) 时,得到最小生物量;而当接种量达到1×106个/mL 时,得到最大生物量,表明菌株生长的最佳接种量是1×106个/mL。但接种量达到1×106个/mL 时,所得类胡萝卜素含量却最小;接种1×105个/mL 时,得到最大类胡萝卜素含量,这表明类胡萝卜素合成同菌株生长不是正比关系,1×105个/mL 是最适宜接种量。Govindaswamy Vijayalakshmi 等[19]优化红酵母类胡萝卜素合成,接种量表达形式不同,为6.0 mL/100 mL。
2) 初始pH 值。培养结束后,测量类胡萝卜素含量和生物量,结果见文献[8]。分析该图得出最适初始pH 值为7.5。
2.3 单因素试验的方差分析
方差分析单因素试验,研究其对类胡萝卜素含量的影响。从第84 页表1 可见,果糖浓度与初始pH 值对类胡萝卜素含量影响极显著,酵母粉质量浓度对类胡萝卜素含量影响高度显著,而接种量和NH4Cl 质量浓度影响类胡萝卜素含量不显著。根据单因素试验对类胡萝卜素含量的影响,选出3 个影响因子:初始pH 值、果糖质量浓度、酵母粉质量浓度,并将响应值设为类胡萝卜素含量,进一步响应面优化。

表1 单因素试验对类胡萝卜素含量的方差分析表
2.4 响应面试验
1) 优化方案。研究红酵母菌株类胡萝卜素合成,单因素试验后用响应面法进一步优化,软件应用Design Expert 8.0,选择Box-Behnken 设计,确定3 个考察因子:初始pH 值A、果糖质量浓度B、酵母粉质量浓度C,将响应值设为类胡萝卜素质量浓度Y,三水平三因子优化发酵,方案设计与试验结果见表2 和表3。响应面优化试验菌株发酵,得到的类胡萝卜素含量比单因素试验高43.96%。
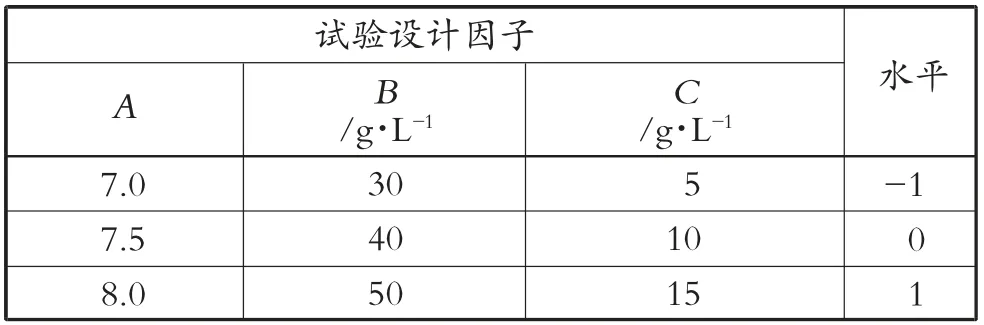
表2 试验设计因子与水平取值
采用响应面法回归分析试验数据(见表3),综合可得以类胡萝卜素含量为响应值的三因子(初始pH 值A、果糖质量浓度B、酵母粉质量浓度C) 的三元二次回归方程为

对此方程进行显著性检验与方差分析,结果见表4。从表4 可见,回归模型P值<0.000 1,表明得到的模型差异极显著,模型的失拟项P值为0.144 7>0.05,表明失拟项差异不显著,此方程模型与发酵情形很好拟合,因而发酵可用模型代替进行结果分析。该模型的(决定系数)为0.999 2,表明99.92%类胡萝卜素含量的变化能用此模型解释,实际发酵中用此模型仅存在0.08%的变异不能说明。所以研究所得模型能可靠地应用于试验菌株的发酵,能够预测试验得到的类胡萝卜含量,清楚其变化。
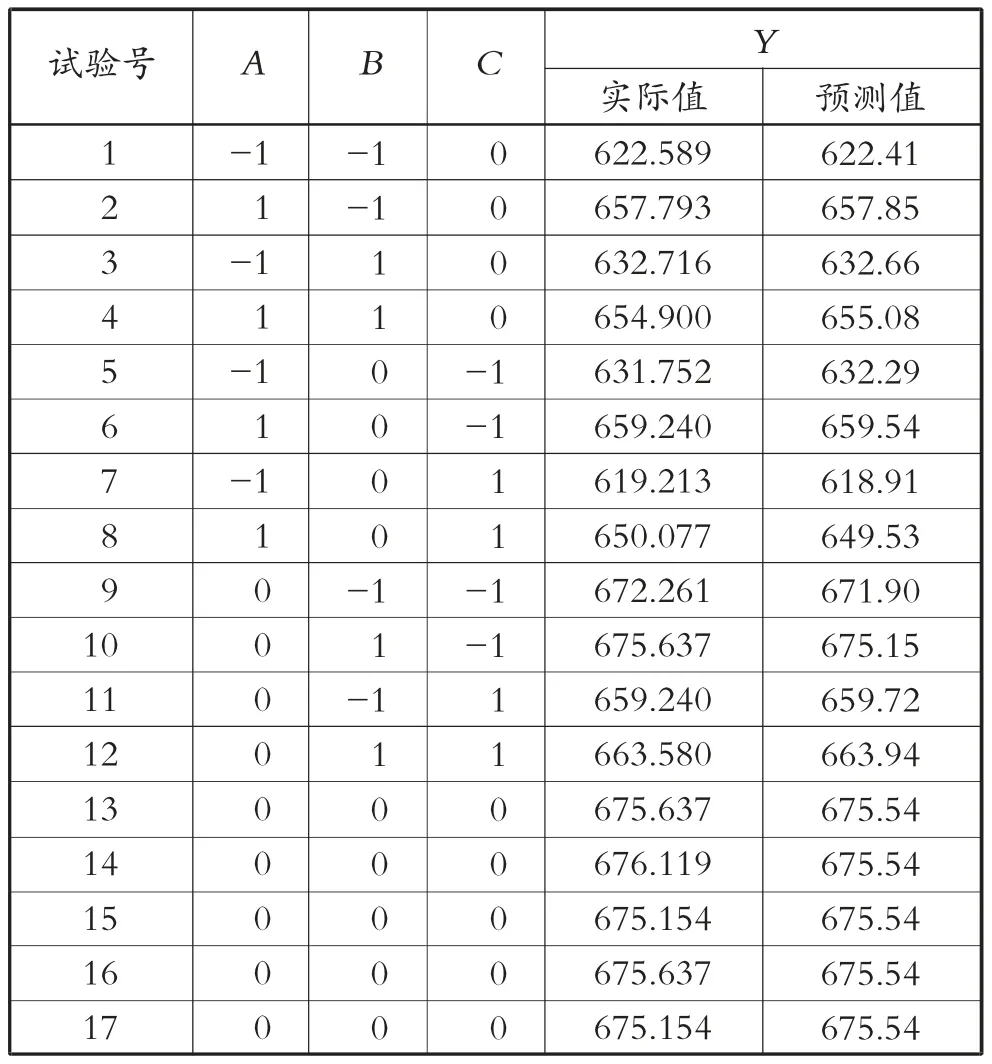
表3 Box-Behnken 试验设计与响应值

表4 回归模型方差分析
2) 最佳发酵参数的预测及验证。综合处理试验数据,选择Design Expert 8.0 软件进行优化与预测,得到发酵的最优工艺参数:酵母粉质量浓度为7.13 g/L,果糖质量浓度为41.70 g/L,初始pH 值为7.61。将最优参数代入方程得到类胡萝卜素质量浓度预测值为678.967 μg/L。采用最优参数进行试验,得类胡萝卜素含量试验值为678.048 μg/L,预测值和试验值接近,表明选择响应面方案所得模型与参数可信度高。
3 结论
本试验先开展单因素试验,在此基础上,用响应面法优化试验菌株类胡萝卜素合成工艺,建立了显著影响因子对类胡萝卜素含量的三元二次回归方程模型,通过验证,该回归模型可信度高,能用来预测类胡萝卜素含量。综合单因素试验与响应面优化试验,得出试验菌株最佳发酵参数是果糖质量浓度为41.70 g/L,酵母粉质量浓度为7.13 g/L,初始pH 值为7.61。以最佳参数预测与验证,类胡萝卜素质量浓度实际值为678.048 μg/L,预测值为678.967 μg/L,实际值与预测值很接近。
