黄精多糖对MFC 胃癌荷瘤小鼠抑瘤及免疫调节作用
2020-09-15吕品田段昕波
吕品田 段昕波
(河北省人民医院肿瘤二科, 河北石家庄050000)
黄精为百合科多年生草本植物黄精、滇黄精和多花黄精的干燥根茎,具有健脾、润肺、益肾、补气、养阴之功效[1]。研究表明,黄精多糖是黄精的主要的活性成分,具有改善记忆力、抗病毒、调节血糖血脂、抗炎、抗菌、抗氧化、增强免疫力及抗肿瘤等作用[2]。研究发现,黄精多糖可以促进环磷酰胺致免疫抑制小鼠溶血素的形成,提高胸腺指数、脾脏指数及腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数,改善免疫功能[3];进一步对黄精多糖的结构进行分析,发现酸性多糖的免疫活性高于中性多糖[4]。黄精多糖也可以显著抑制H22 肝癌荷瘤小鼠的肿瘤生长,其机制与激活caspase 系统诱导肿瘤细胞凋亡及阻滞肿瘤细胞于G0/G1期,进而影响细胞周期分布等有关[5];此外,黄精多糖与顺铂联合使用具有协同作用,可以更好的抑制H22 肝癌移植瘤的生长,并降低顺铂毒性[6]。黄精多糖对胃癌的研究报道较少,且考虑到抗癌作用和免疫调节作用的相关性,本研究以MFC 胃癌荷瘤小鼠为模型,观察黄精多糖的体内抑瘤作用及免疫调节作用。
1 材料
1.1 动物与细胞 BALB/c 小鼠,体质量(20±2) g,SPF级,雌、雄各半,动物生产许可证号SCXK (京) 2012⁃0001,购自北京维通利华公司;自由摄食、饮水,分笼饲养,湿度45%~55%,温度20~25 ℃。MFC 胃癌细胞,中科院上海细胞库。
1.2 药物及试剂 黄精多糖由本实验室制备[7],采用水提、醇沉法,纯度>85.0%;复方环磷酰胺片 (批号160706,上海华联制药有限公司);胎牛血清(杭州四季青生物工程材料有限公司);DMEM、RPMI1640 培养基(美国Gibco 公司);TNF⁃α、IL⁃2、IL⁃6 检测试剂盒(南京建成生物研究所);RNA 提取试剂盒、RR047A 逆转录试剂盒及SYBR Premix Ex Taq TM Ⅱ(日本TaKaRa 公司)。
1.3 仪器 SW⁃CJ⁃2FD 超净工作台(上海博迅生物科技有限公司);BPN⁃RHP/RWP 型CO2培养箱(上海一恒仪器有限公司);ELx800TM酶标仪 (美国Bio Tek 公司);760CRT 紫外⁃可见分光光度计(上海精科仪器有限公司);CFX96 荧光定量PCR 仪(美国Bio⁃Rad 公司)。
2 方法
2.1 造模、分组及给药 取冻存于液氮中的MFC 胃癌细胞,在37 ℃水浴中快速解冻,转移至离心管后加入DMEM培养液(含10%胎牛血清),1 000 r/min 离心3 min,弃上清;加入DMEM 培养液(含10%胎牛血清),常规条件培养至对数生长期。将 MFC 胃癌细胞浓度调整至1.5×106/mL,于BALB/c 小鼠腋下接种,0.2 mL/只,当瘤块直径达到0.5 cm 时可用于实验(剔除体积过小或过大者)。40 只筛选合格小鼠随机分为模型组、环磷酰胺组(20 mg/kg)、黄精多糖高剂量组(400 mg/kg) 和黄精多糖低剂量组(100 mg/kg),另随机选取10 只健康BALB/c 小鼠作为对照组;灌胃给药,连续21 d,对照组及模型组灌胃等体积的生理盐水。
2.2 抑瘤率及脏器指数测定 末次给药24 h 后,摘眼球取血,分离血清,冻存备用;颈椎脱臼法处死小鼠,无菌条件下剖取瘤块及脾脏、胸腺,精密称定质量后,分别计算抑瘤率及脏器指数。抑瘤率= [(模型组瘤重⁃给药组瘤重) /模型组瘤重] ×100%,脏器指数=脏器质量/体质量。
2.3 脾淋巴细胞增殖刺激指数及NK 细胞活性测定 颈椎脱臼法处死小鼠,无菌条件下剖取脾脏,称定质量后放于200 目尼龙网上,置于35 mm 组织培养皿中 (内含EZ⁃SepTM 小鼠淋巴细胞分离液)。通过轻轻碾压脾脏,使其分散成单细胞,于RPMI1640 培养液中培养。分别采用MTT 法和乳酸脱氢酶(LDH) 释放法测定脾淋巴细胞增殖刺激指数及NK 细胞活性。
2.4 血清细胞因子测定 取冻存的血清,采用ELISA 法检测TNF⁃α、IL⁃2 和IL⁃6 水平,具体操作方法参照ELISA 试剂盒说明书中的操作指南。
2.5 脾脏TLR4、MyD88、NF⁃κBmRNA 表达测定 取脾脏组织20 mg,加入液氮,充分研磨,TRIzol 法提取总RNA;经RR047 A 逆转录试剂盒将mRNA 逆转录为cDNA,-20 ℃冰箱中保存。采用SYBR 法在CFX96 荧光定量PCR仪中检测TLR4、MyD88、NF⁃κBmRNA 表达,20 μL 反应体系,扩增条件为95 ℃、5 min 预变性,95 ℃、10 s,60 ℃、20 s,40 个循环,系统自带软件分析溶解曲线。以β⁃actin为内参,通过2-△△Ct法计算目的基因的相对表达量。引物由大连生物工程技术有限公司合成,序列见表1。

表1 引物序列
3 结果
3.1 黄精多糖对荷瘤小鼠抑瘤作用的影响 灌胃给予荷瘤小鼠黄精多糖21 d 后,与对照组比较,模型组小鼠瘤重增加(P<0.05);与模型组比较,黄精多糖高、低剂量组瘤重均降低(P<0.05),抑瘤率分别为37.71、22.22%。见表2。
3.2 黄精多糖对荷瘤小鼠脏器指数的影响 如表3 所示,与对照组比较,模型组小鼠脾脏、胸腺指数均降低(P<0.05);与模型组比较,黄精多糖低、高剂量组小鼠的脾脏指数增加(P<0.05)。
表2 黄精多糖对荷瘤小鼠抑瘤作用的影响(, n=10)

表2 黄精多糖对荷瘤小鼠抑瘤作用的影响(, n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
表3 黄精多糖对荷瘤小鼠脏器指数的影响(, n=10)
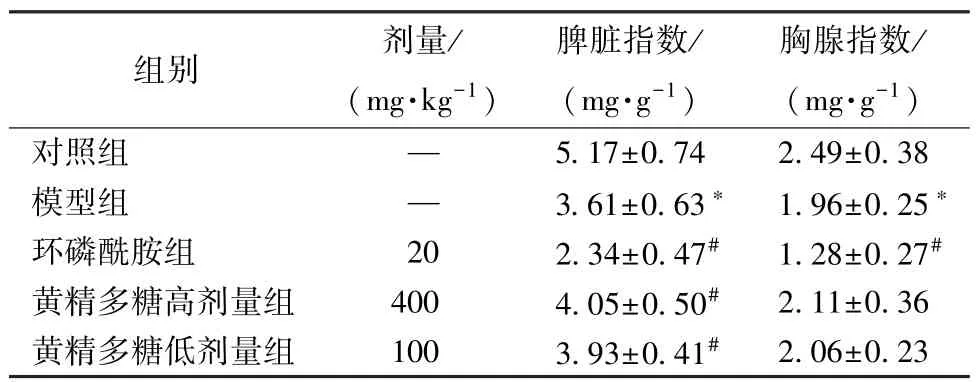
表3 黄精多糖对荷瘤小鼠脏器指数的影响(, n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.3 黄精多糖对荷瘤小鼠脾淋巴细胞增殖刺激指数及NK细胞活性的影响 灌胃给予MFC 胃癌荷瘤小鼠黄精多糖21 d后,与对照组比较,模型组小鼠脾淋巴细胞增殖刺激指数及NK 细胞活性均降低(P<0.05);与模型组比较,黄精多糖低、高剂量组小鼠脾淋巴细胞增殖刺激指数及NK细胞活性增加(P<0.05)。见表4。
表4 黄精多糖对荷瘤小鼠脾淋巴细胞增殖刺激指数及NK细胞活性的影响(, n=10)

表4 黄精多糖对荷瘤小鼠脾淋巴细胞增殖刺激指数及NK细胞活性的影响(, n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.4 黄精多糖对荷瘤小鼠血清细胞因子的影响 灌胃给予MFC 胃癌荷瘤小鼠黄精多糖21 d 后,与对照组比较,模型组小鼠血清TNF⁃α、IL⁃2、IL⁃6 水平降低(P<0.05);与模型组比较,除黄精多糖低剂量组小鼠血清TNF⁃α、IL⁃6 水平无变化外(P>0.05),其余各组小鼠血清TNF⁃α、IL⁃2、IL⁃6 水平增加(P<0.05)。见表5。
表5 黄精多糖对荷瘤小鼠血清TNF⁃α、IL⁃2、IL⁃6 水平的影响(, n=10)

表5 黄精多糖对荷瘤小鼠血清TNF⁃α、IL⁃2、IL⁃6 水平的影响(, n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.5 黄精多糖对荷瘤小鼠脾脏TLR4/NF⁃κB 信号通路的影响 灌胃给予MFC 胃癌荷瘤小鼠黄精多糖21 d 后,与对照组比较,模型组小鼠脾脏TLR4、MyD88、NF⁃κBmRNA 表达增加(P<0.05);与模型组比较,环磷酰胺组小鼠脾脏TLR4、MyD88、NF⁃κBmRNA 表达均增加(P<0.05),而黄精多糖高、低剂量组小鼠脾脏TLR4、MyD88、NF⁃κBmRNA 表达均降低(P<0.05)。见表6。
表6 黄精多糖对荷瘤小鼠脾脏TLR4、 MyD88、 NF⁃κB mRNA 表达的影响(, n=10)

表6 黄精多糖对荷瘤小鼠脾脏TLR4、 MyD88、 NF⁃κB mRNA 表达的影响(, n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
4 讨论
在全球范围内,胃癌位于恶性肿瘤发病率的第4 位,发病率高、生存率低是其主要特征;而在我国,胃癌发病率虽有所下降,但仍高居第2 位,在各类癌症引起的死亡原因中居于前列[8]。目前常用的治疗胃癌手段疗效不理想,5 年生存率仅为25%~30%[9]。抗肿瘤化疗药物长期使用容易产生耐药及不良反应,而中药因其疗效确切、不良反应小等优点在肿瘤的治疗中得到越来越多的关注[10]。近年来,免疫类中药多糖如党参多糖、刺五加多糖等因其具有不良反应小、抗肿瘤活性和调节机体免疫功能等特点逐渐引起人们的重视[11⁃12]。在本研究中,观察到黄精多糖高、低剂量组瘤重均显著降低,抑瘤率分别为37.71%、22.22%;同时,黄精多糖也可以增加模型小鼠的脾脏指数、脾淋巴细胞增殖刺激指数及NK 细胞活性;以上结果表明,黄精多糖具有抑制MFC 胃癌荷瘤小鼠肿瘤生长的作用,该作用与免疫调节作用有关。
免疫系统是机体主要的肿瘤防御系统,与肿瘤的发生、发展和转移密切相关,TNF⁃α、IL⁃2 和IL⁃6 等细胞因子是机体免疫系统发挥免疫调节作用和抗癌作用的主要参与者[13]。TNF⁃α 对正常细胞无明显毒性,而能够直接杀伤肿瘤细胞,是抗肿瘤作用最强的细胞因子,具有增强机体免疫反应、促进肿瘤细胞溶解和抑制肿瘤细胞增殖的作用[14]。IL⁃2 由活化T 细胞产生,具有强大的抗肿瘤效应,具有诱导LAK 细胞生成,参与细胞免疫,增强NK、CTL 细胞杀伤活性,促进效应细胞分泌TNF、IL⁃4 等作用,被誉为免疫系统抗肿瘤的关键蛋白和核心调控因子[15]。IL⁃6 由活化的成纤维细胞和T 细胞生成,可以促进NK 细胞裂解功能的增强;IL⁃6 与IL⁃2 的水平可间接反映机体免疫功能和肿瘤的进展情况[16]。研究发现,消化系统肿瘤患者的预后与血清IL⁃6、IL⁃2 水平呈正相关,血清IL⁃6、IL⁃2 水平检测有利于肿瘤的预后及早期诊断[17]。本研究结果证实,除黄精多糖低剂量组小鼠血清TNF⁃α 和IL⁃6 水平无明显增加外,其余各组小鼠血清TNF⁃α、IL⁃2、IL⁃6 水平均有明显增加,表明黄精多糖可以通过促进免疫因子的表达发挥免疫调节作用,进而抑制肿瘤的生长。
近年研究表明,许多中药抗肿瘤及免疫调节作用的发挥均与TLRs 信号通路有关[18]。在所有TLRs 信号通路中,TLR4/NF⁃κB 信号通路在中药多糖主导的抗肿瘤及免疫调节作用中有重要作用,且有研究证实,黄精多糖可以抑制TLR4/NF⁃κB 信号通路[19]。鉴于上述原因,本研究在确认了黄精多糖具有抗肿瘤及免疫调节作用的基础上,进一步探讨了黄精多糖对TLR4/NF⁃κB 信号通路中相关基因表达的影响。TLR4 在各种细胞中均可表达,其被活化后可促进免疫因子的产生;MyD88 是TLRs 大多数信号通路中的接头分子,TLR4 能够通过MyD88 激活NF⁃κB,进而调节免疫因子的分泌;NF⁃κB 是理想的免疫信号通路调节靶点,处于TLRs 信号转导通路的下游枢纽位置[20]。本研究结果发现,黄精多糖高、低剂量组小鼠脾脏TLR4、MyD88、NF⁃κBmRNA 表达明显降低,表明黄精多糖具有抑制TLR4/NF⁃κB信号通路的作用。TLR4/NF⁃κB 信号通路的激活受阻可能是黄精多糖在MFC 胃癌荷瘤小鼠体内发挥抑瘤作用及免疫调节作用的潜在机制之一,但深入机制有待于进一步的研究。
