马凡综合征合并基底动脉闭塞血管内治疗1例报告☆
2020-09-15梁朝辉李晓波徐燕平
梁朝辉 李晓波 徐燕平
马凡综合征(Marfan syndrome,MFS)是一种罕见的结缔组织常染色体显性遗传性疾病,主要是原纤维蛋白1(fibrillin 1,FBN-1)基因突变引起[1],早在 1991 年 DIETZ 等[2]就报告了FBN1基因突变导致MFS,并在1996年建立了Ghent疾病分类标准[3]。在MFS患者的随访研究中发现,发生神经血管并发症的事件仅涉及少数患者[4],合并脑梗死的临床报告亦很少。本文通过介绍1例马凡综合征合并基底动脉闭塞型脑梗死的青年患者的临床、影像学表现和治疗,对相关文献复习从而加深对该疾病的认识与处理。
1 病例资料
1.1 发病情况 患者,32岁男性,主因“突发意识不清6 h”于2019年07月17日15:43入院。患者6 h前与人交谈时突发意识不清伴双眼上翻、言语不能,左侧肢体无力,无肢体抽搐,无口吐白沫,无大小便失禁,发病至来我院时仍意识不清。急送至我院途中呕吐2次,呕吐物为胃内容物,伴有一过性四肢抽搐,持续数秒钟后自行停止,无舌咬伤,无口吐白沫,无大小便失禁。既往史:2004年诊断马凡综合征,心脏超声提示主动脉瘤样扩张并行主动脉根部置换+主动脉瓣置换术,术后病理提示瓣膜组织纤维组织增生、水肿、粘液样变性,少量淋巴细胞浸润。术后不规律口服华法林,未规律监测凝血酶原标准化比值(international normalized ratio,INR);2018 年有左眼视网膜脱离手术史,双眼晶状体全脱位。否认其他病史,个人史及家族史无特殊。
1.2 体格检查 体温36.4℃,脉搏82次/min,呼吸18次/min,血压136 mmHg/70 mmHg,身高185cm,体重65kg。体型消瘦,长脸,四肢纤长。神志昏睡,言语含糊不清,双侧眼球向外凸出,双侧瞳孔不等大,右侧直径3 mm,对光反射迟钝,左侧瞳孔不规则,直径约5 mm,对光反射消失,眼球活动检查不能合作,伸舌不合作。心率82次/min,律齐,可闻及机械瓣膜音,双肺呼吸音粗,未闻及干湿性啰音,疼痛刺激左上肢无活动,左下肢可见屈曲,右侧肢体有自主活动,四肢肌张力正常,共济、感觉查体不合作,双侧腱反射对称存在,双侧病理征阳性,脑膜刺激征阴性。NIHSS评分16分。
1.3 辅助检查 随机血糖 7.2 mmol/L (3.9~6.1 mmol/L),白细胞17.56×109/L (3.5×109~9.5×109/L),D-二聚体测定 0.76 mg/L(0~0.5 mg/L),凝血酶原标准化比值(INR)0.96(0.75~1.25);钾 3.44 mmol/L (3.5~5.5 mmol/L),N 末端 B 型钠尿肽原218 pg/mL (0~450 pg/mL); 肌钙蛋白 I测定 0.099 ng/mL(0~0.034 ng/mL);肝肾功能、感染性标志物、免疫指标等未见明显异常。心电图:窦性心律;左心室高电压;ST-T改变。头颅电子计算机断层扫描(computed tomography,CT):未见出血及缺血灶。两侧眼球凸出。头颈动脉CT血管成像(computerized tomography angiography,CTA):基底动脉尖及右侧大脑后动脉起始部栓子形成。右侧椎动脉颅内段纤细。左侧椎动脉优势(见图A、B)。胸部CT:两肺纹理增多。心脏术后改变。肝脏低密度影。
1.4 诊断、治疗与随访 患者诊断为基底动脉尖综合征;马凡综合征;低钾血症;心脏瓣膜病主动脉瓣置换术后;左眼视网膜脱离术后。患者发病时间超过静脉溶栓时间窗,入院后予以监测生命体征,行脑血管数字减影血管造影(digital substraction angiography,DSA)+动脉取栓手术治疗(手术时间:2019年 7月17日 16:30至 18:50),造影提示基底动脉中远段未见显影。采用4 mm×20 mm RECON取栓支架取栓2次,取出两粒栓子,复查造影:基底动脉中远段未见显影。然后采用RECON、Solitaire双支架技术于双侧大脑后动脉取栓2次,取出一长条栓子,复查造影:基底动脉及双侧大脑后动脉显影良好,TICI 3级 (见图C、D)。栓子病理:混合性血栓,镜下见呈网状、小粱状分布的伊红色无结构物,其间见红细胞。术后头颅CT提示无出血,头颅MRI:右侧颞叶、右侧丘脑、脑干及小脑多发急性梗死灶。两侧眼球凸出(见图E)。复查头颈动脉CTA:相较于手术前,基底动脉尖及右侧大脑后动脉充盈尚可,未见明确充盈缺损影(见图F、G)。超声心动图:主动脉瓣机械瓣置换术后,机械瓣功能正常,心脏各房室腔未见增大,左室射血分数60%(见图H)。术后给予华法林抗凝、改善循环、营养神经、清除氧自由基、脱水降低颅内压、补钾等对症治疗。治疗2周后出院时患者神志清楚,言语清晰,左侧肢体肌力5-级,右侧肢体肌力正常。随访4个月时,患者无任何症状,日常活动不受限,mRS评分为0分,复查颅内多普勒血流图提示脑动脉超声未见异常。
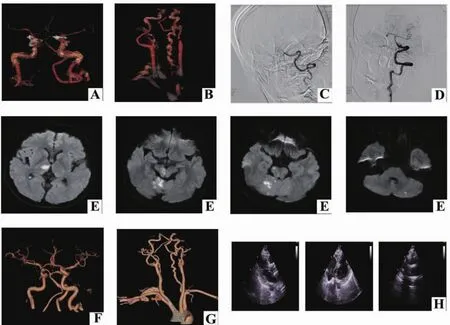
图1 影像学表现 A、B:取栓前 CTA;C、D:取栓前后 DSA;E:头颅 MRI长 T1长 T2、DWI高信号影;F、G:取栓后 CTA;H:心脏超声。
2 讨论
MFS是结缔组织常染色体显性遗传性疾病,发病机制主要为FBN-1基因突变,可调节转化生长因子β(transform growth factor β,TGF-β) 信号通路,功能失调的FBN增加了TGF-β的生物利用度和细胞外基质中的浓度,导致促炎转录因子的激活[5]。此外,TGF-β可引起活性氧的积累,导致弹性纤维蛋白进一步降解,可致主动脉中层发生炎症反应、弹力纤维降解以及原纤维蛋白的缺陷,促使主动脉瘤或主动脉夹层的发生和发展[5-6]。成人的临床诊断主要根据Ghent疾病分类标准或其相应修订版本进行[3,7]。Ghent疾病学说将诊断重点放在心血管表现上,其中主动脉根部动脉瘤和轻度外翻是主要临床特征。在没有任何家族史的情况下,可根据这两种表现来诊断MFS。如果这两个都不存在,则需要进行FBN1基因检测并结合全身临床表现,通过评分系统来评估[7-8]。虽然FBN1突变分析逐渐兴起,然而FBN1突变还可见于其他疾病,如Weill-Marchesani综合征、MASS 表型、Shprintzen-Goldberg综合征、二尖瓣脱垂综合征和家族性角膜外翻等[9-10],基因检测缺乏敏感性和特异性,而且因FBN1含有较多外显子[11],对所有外显子进行常规序列检测费用昂贵,所以将其作为主要的诊断检测手段仍然受到限制。本例患者无家族史,结合患者体貌特征如体型消瘦、长脸、四肢纤长和双侧眼球凸出,既往有主动脉瘤样扩张并行主动脉根部置换+主动脉瓣置换术,以及有左眼视网膜脱离手术史,双眼晶状体全脱位,MFS已诊断明确。
MFS合并脑梗死的临床研究很少,国内仅有少数的病例报道[12-15]。MFS者发生颅内血管病变的可能性较小,合并神经血管并发症者亦少见,近年来KIM等[16]研究发现与没有MFS的患者相比,MFS患者脑梗死、脑出血和脑动脉瘤的患病率略有增加,但尚未能发现与颅内动脉夹层明显的相关性,缺血性和出血性事件的病因似乎与MFS所致的结缔组织缺损没有直接关系[5],更多是其心源性栓塞或长期抗凝治疗产生的并发症所致。WITYK等[4]通过回顾性研究分析8年间收治的513例MFS患者,发生脑血管病者18例,其中缺血性脑卒中13例,12例为心源性脑栓塞型,由此推测发生缺血性脑卒中的机制主要是心源性脑栓塞。本例为青年脑梗死患者,尚未发现有与动脉粥样硬化性脑梗死相关的常见危险因素(如高龄、吸烟、高血压、高血脂等)以及符合动脉粥样硬化的血管病变。该患者既往有MFS以及主动脉瓣膜置换术,不规律口服法华林抗凝治疗,未规律监测INR及时调整药物剂量,入院查INR 0.96未达标。此次发病为基底动脉急性闭塞,头颅、颈动脉CTA及脑血管DSA均未提示动脉夹层及动脉瘤,心脏超声未发现卵圆孔未闭,双下肢血管超声示左、右下肢所见动脉及静脉未见明确异常,结合患者相关临床表现和体征、既往史、血生化检测、影像学检查以及栓子病理提示心源性脑栓塞可能性大,并推测其与瓣膜置换术后不规律口服抗凝药相关。
对于青年缺血性脑卒中患者,需考虑到动脉夹层、卵圆孔未闭、血液系统肿瘤、促血液高凝药物使用、免疫系统疾病等可能,需系统的进行排除诊断[17]。颅内动脉夹层常常是青年缺血性脑卒中的潜在病因,预防再发可予抗血小板或抗凝治疗、血管内治疗和外科手术,由于缺乏随机对照研究和国际认可的指南而使治疗方案备受争议,对于非出血性自发性颅内动脉夹层患者,考虑到其自发性改善的可能性以及获益和风险[18],大多数专家建议进行药物治疗。传统观念认为颅内动脉夹层患者发生缺血性卒中多归因于血栓栓塞,使用抗凝治疗能更有效地降低再发风险,有研究通过将患者分为颅内/颅外动脉夹层和自发性/外伤性动脉夹层观察临床功能预后,结果发现使用抗凝治疗或抗血小板治疗其临床功能预后或血管再通无明显差异[19-22],目前没有证据支持抗凝优于抗血小板治疗。对于合并MFS的患者,仅有1例由MASKI等[23]报告的颅内血管本身病变引起,即颅内动脉夹层引起的青年脑梗死,在治疗上尚无相关随机对照实验研究或大样本研究来观察抗凝/抗血小板治疗后临床预后结果。由于MFS者通常具有人工心脏瓣膜、心房颤动、二尖瓣脱垂、主动脉根部扩张等临床特征,发生缺血性脑卒中多由于心源性栓塞,使用抗凝治疗能更有效地降低再发缺血性脑卒中风险,但具体疗效仍需在未来进行对比研究。
本例脑梗死患者病因考虑为心源性脑栓塞,入院后头颈动脉CTA提示大血管闭塞,发病时间超过静脉溶栓时间窗,尚处于动脉取栓时间窗内,积极行脑血管造影及采用Solitaire双支架技术动脉取栓使基底动脉血流再通。术后患者神经功能恢复良好,复查头颅CT未见出血,既往有MFS和瓣膜置换术病史,评估风险后口服华法林进行二级预防,规律监测并控制INR在2~3之间,随访至4个月时mRS评分为0分,日常生活不受限。MFS合并有瓣膜疾病患者行主动脉瓣置换术后发生主动脉并发症,如胸主动脉夹层瘤、动脉瘤形成、主动脉手术的机率更高[24],因此对于MFS的管理尤为重要。IAMS等[25]提出对MFS的管理应注重在心血管疾病及限制体育运动上,有条件者应进行详细的血管评估,虽可通过手术治疗管理心血管疾病,但仍需规律药物治疗。
综上所述,MFS可致全身多系统损害,因此对于MFS的诊断和管理需要多学科参与,包括心脏病科、眼科、骨科、遗传学专家等进行综合评估,定期监测心脏超声、血管超声、眼科及骨骼等。对于合并MFS的脑血管病患者,尤其是处于发病时间窗内者,需评估获益与风险,有条件者可完善CTA或DSA评估血管,必要时采取血管内治疗,以使患者最大程度受益。
利益冲突声明:作者声称无任何利益冲突。
