枣ZjRNase1 基因的克隆及功能分析
2020-09-15王玖瑞刘孟军
张 玉,程 壮,甄 曼,王玖瑞,刘孟军
(1.河北农业大学 林学院,河北 保定 071001;2.河北农业大学 园艺学院,河北 保定 071001; 3.北京林果业生态环境功能提升协同创新中心,北京 100000)
核糖核酸酶(Ribonucleases)是一类核酸水解酶,广泛存在于动植物体内。它可以降解非保护环境下的RNA 分子,其主要生理功能是控制生物体细胞内RNA 的种类与数量分布,在核糖核酸转录后的剪切、修饰和降解以及RNA 的转运等过程中起作用,通常被简写为RNases。RNases 不仅与植物的抗逆、衰老、雄性不育和自交不亲和有密切关系,还与动物器官发生、宿主的防御、控制肿瘤血管生成、杀灭肿瘤细胞及抑制病毒的复制等过程有关[1-2]。Sato和Egami 于1957 年从真菌米曲霉菌中发现了该家族中的重要成员核糖核酸酶T2 基因[3]。RNases T2家族属于酸性内切酶类,在真核生物的进化过程中,此类酶绝对保守,可能有着重要的生物学功能[4]。近几年,关于植物RNases T2 家族成员的研究取得了很大进展,揭示出其在植物生长发育和抗逆反应等过程发挥重要作用[5]。
枣(Ziziphus jujuba Mill.)属鼠李科(Rhamnaceae)枣属(Ziziphus),由酸枣驯化而来,是重要的干果树种且可以药食两用。枣果实营养价值丰富,但枣结实率不高,百花结一果[6]。枣树抗逆性强,适应干旱、盐碱等恶劣条件,是改善生态的先锋树种。随着枣全基因组测序工作的完成[7],枣生长发育和抗性等相关的功能基因的挖掘正深入展开,已经涉及枣MADS-box 家族[8]、TCP 家族[9]和bHLH[10]等家族基因,但未见RNase T2 家族Class I 基因的报道。本研究基于已经报道的拟南芥RNase T2 家族中Class I 的RNS1 基因[11],克隆获得了枣同源ZjRNase1 基因,并对其进行了理化性质、基因结构、蛋白保守域结构和不同组织器官的表达量分析,在此基础上还进行了农杆菌介导的拟南芥遗传转化试验,以探究该基因的功能。
1 材料与方法
1.1 试验材料
在河北农业大学枣中心枣资源圃,选取‘冬枣’叶片作为ZRNase1 基因的克隆材料,根、茎、叶、花和幼果作为ZjRNase1 基因不同组织表达量的分析材料。试验材料在田间采集后包裹进锡箔纸中,迅速保存在液氮里,带回室内后存于-80 ℃,用作后续RNA 提取。每个样品均采自3 棵树,然后进行混样,采样植株具有相同的生长年龄、栽培条件和管理水平。
1.2 试验方法
1.2.1 枣ZjRNase1 基因的克隆 通过NCBI 数据库Blastp 查找拟南芥RNS1 在枣中的同源序列,利用Primer5.0 软件设计所需的特异引物(F: ATGAGATACAGAAGCTCAATCTTGA / R: CTAAAATTTAGCAAATTGAACTTGA)进行目的基因扩增。以‘冬枣’叶片反转录所得的cDNA 为模板,进行PCR 扩增。PCR 反应体系为:引物F/R 各1 μL,2×Taq PCR MasterMix 为12.5 μL,ddH2O 9.5 μL,cDNA 1 μL。反应条件为94 ℃ 10 min, 94 ℃ 40 s,56.6 ℃ 40 s,72 ℃ 1 min,共35 个循环,72 ℃ 10 min。回收扩增获得的目的片段产物,并克隆测序。
1.2.2 生物信息学分析 利用NCBI 数据库进 行Blastp 比对分析氨基酸序列的相似性,查找同源蛋白序列;通过CD Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行序列的结 构域分析;利用NCBI 开放阅读框在线预测软件 ORF Finder(http://www.ncb i.nlm.nih.gov/gorf/gorf.html)对获得的基因序列进行预测;利用DNAMAN 进行序列比对和拼接;利用GSDS(http://gsds.cbi.pku.edu.cn/)进行基因结构分析;利用ExPASy(https://www.expasy.org/)计 算 蛋 白 质 相对分子量和理论等电点;通过SOPMA 在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_automat.pl?page=npsa_sopma.html)分析蛋白的二级结构;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白的跨膜结构预测进行预测;利用SignaIP-5.0 Serve(rhttp://www.cbs.dtu.dk/services/SignalP/)预测该基因的信号肽;利用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)在线网站进行细胞定位预测;用MEME(http://meme-suite.org/)进行氨基酸序列保守结构域分析。1.2.3 基因的表达分析 取用‘冬枣’不同组织器官cDNA 进行Real-time PCR 扩增。采用天根公司多糖多酚植物总 RNA 提取试剂盒 DP441 提取枣材料总RNA,使用全式金公司Trans Script First-Strand cDNA Synthesis SuperMix AT301 反转录试剂盒获取cDNA。设计枣ZjRNase1 实时定量基 因 引 物(2F:GCTGTCCAAGTAGCAACGGA / 2R:CCCTGTTGCAGTCAATCCCT), 进行 表 达 量 的 分 析, 枣Actin 内 参 基 因 为(F:5′-GCGAGCTTCCCTGTAGGTA-3′,R:5′-CG- AACCCAGCCTTCACCATAC-3′[12])。PCR 反应 程序为:95 ℃预变性10 min,95 ℃变性10 s, 59.2 ℃退火35 s,72 ℃延伸35 s,共40 个循环,于72 ℃,55 s 处收集荧光信号。基因相对表达计算采用2-ΔΔCT方法。
1.2.4 过表达载体的构建PCR 获得基因片段 根据NCBI 登录的基因序列,并含有SmaΙ 酶切位点,设计引物如下(3F:CTCTAGGATCCCCATGAGAT ACAGAAGCTCAATCTTGA / 3R:AGGGACTG AC CACCCCTAAAATTTAGCAAATTGAACTTGA) 所示,以已有全长菌液为模板进行PCR 扩增。PCR反应程序:94 ℃预变性10 min;94 ℃变性40 s, 58 ℃退火40 s,72 ℃延伸1 min,40 个循环;72 ℃ 10 min。PCR 产物克隆pMD19-T 载体并转化大肠杆菌感受态细胞测序。
载体的构建及鉴定:将上述重组质粒及过表达载体pBI121 用SmaΙ 酶切后,通过琼脂糖凝胶电泳回收DNA 片段。平末端连接酶50 ℃连接30 min后,转化大肠杆菌DH5α,利用Kan 筛选阳性克隆,测序鉴定为相应片段,提取质粒。
农杆菌菌株的制备及鉴定:参考梁芳等人[13]的具体制备及鉴定方法。
1.2.5 拟南芥的遗传转化及转基因鉴定 利用农杆菌介导法进行遗传转化试验,将构建好的过表达载体采用浸染花序的方式转化拟南芥,转化方法参考李业等人[14]。将侵染后收获的T0代转基因植株和野生型种子使用相同的方法种植和移栽。T0代拟南芥种子播于含有潮霉素抗性的1/2MS 培养基上,春化2 d 后放置培养室培养。非转入目的基因的拟南芥不具有抗性而被抗生素杀死,正常生长的拟南芥初步预测为转基因植株,待其长到4 片子叶时移栽,正常放置培养室内生长,观察生长状态。
2 结果和分析
2.1 枣ZjRNase1 基因的克隆及结构分析
将拟南芥RNS1 氨基酸序列在枣数据库中进行Blastp 比对,搜索得到了一个同源蛋白,序列同源性为63.35%, 将其命名为ZjRNase1(LOC107429010)。以冬枣叶片RNA 反转录的cDNA 为模板,经特异引物PCR 扩增所得产物,与预期基因片段大小吻合(图1)。将该片段进行切胶回收并克隆测序后,将测序结果通过 DNAMAN 进行序列比对,得到681 bp 的完整ORF 区序列。利用在线网站GSDS 分析(图2)发现该基因含有2个内含子和3 个外显子。

图 1 ZjRNase1 基因的克隆Fig. 1 Cloning of ZjRNase1 gene
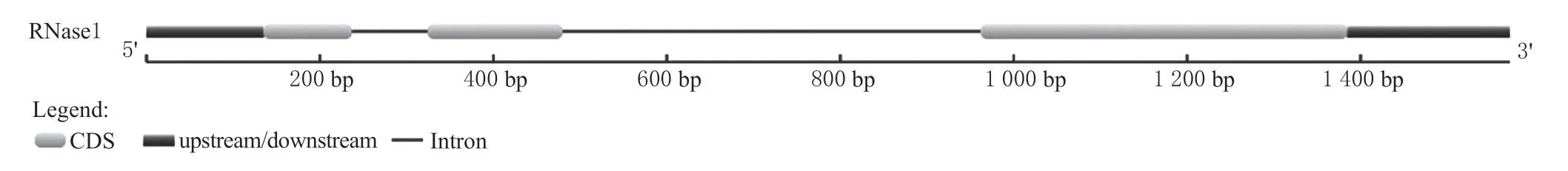
图 2 枣ZjRnase1 基因结构图Fig. 2 Gene structure of ZjRnase1 gene in Chinese jujube
2.2 枣ZjRNase1 基因的理化性质分析及亚细胞 定位
枣ZjRNase1 基因编码226 个氨基酸,蛋白分子量为25.78 kD,理论分子式C2090H3501N681O882S132,该蛋白GRAVY(即总平均亲水性)值为0.707,表明其为疏水性蛋白。该蛋白不稳定系数为42.66,其值大于40,说明该蛋白是一个不稳定蛋白。该基因编码的氨基酸中由75 个α-螺旋结构(33.19%)、30 个扩展链(13.27%)、113 个无规则卷曲氨基酸残基(50.00%)、8 个β-转角(3.54%)组成,它们交替散布于整个蛋白质中。RNase1 蛋白在第1 ~6 氨基酸处位于膜内,在7 ~26 氨基酸处存在跨膜现象,第27 ~226 氨基酸处则位于膜外;经SignalP-5.0 Server 在线网站分析(图3)。该蛋白含有信号肽,属于分泌蛋白。经Plant-mPLoc 在线网站分析,基因定位在细胞质基质。

图 3 ZjRNase1 蛋白的跨膜结构及信号肽预测Fig. 3 Prediction of transmembrane structure and signal peptides
2.3 枣ZjRNase1 蛋白的保守结构域分析
从基因结构来看,基因ZjRnase1 内含子没有超过4 个,不属于Class II 类基因,故将该基因的蛋白与Class III 基因(即S-RNase)蛋白及Class I 蛋白进行结构域分析。与其他十个物种的S 蛋白进行保守域比较,发现该蛋白与其他物种Class III 基因蛋白仅具有部分大体一致的保守结构(图4),但与属于Class I 的拟南芥中的RNS1、RNS3、番茄中的RNaseLE、RNaseLX 以及水稻OsRNS4蛋白[17]保守域结构具有高度相似性,因此,获得的枣Rnase1基因应属于RNase T2家族中Class I 基因。

图 4 枣ZjRnase1 与其他物种同源蛋白的保守域分析Fig.4 Analysis of the conserved domain of ZjRnase1 among Chinese jujube and other species
2.4 枣ZjRNase1 基因的组织特异性分析
经组织器官特异性表达分析发现,枣ZjRNase1基因在茎、叶、花中表达量远远高于果实和根,具有明显的特异性表达(图5),符合RNase T2 家族中Class I 基因编码蛋白具有很强组织特异性的特征[17]。
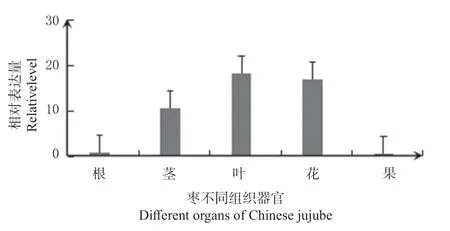
图 5 枣不同组织器官中ZjRNase1 基因的表达Fig. 5 Expression of ZjRNase1 gene in different organs of Chinese jujube
2.5 枣ZjRNase1 基因的遗传转化分析
2.5.1 重组载体的构建 重组质粒连接、转化之后,在相应抗性培养基上培养,长出单菌落并对其进行特异性扩增,保菌送测序,并留菌保存用于后续将载体转入农杆菌中,进行拟南芥的侵染。使用引物3F/3R 对构建的过表达载体及转入农杆菌后扩繁好的载体进行特异性扩增,电泳检测结果如图6 所示,与目的基因大小一致。
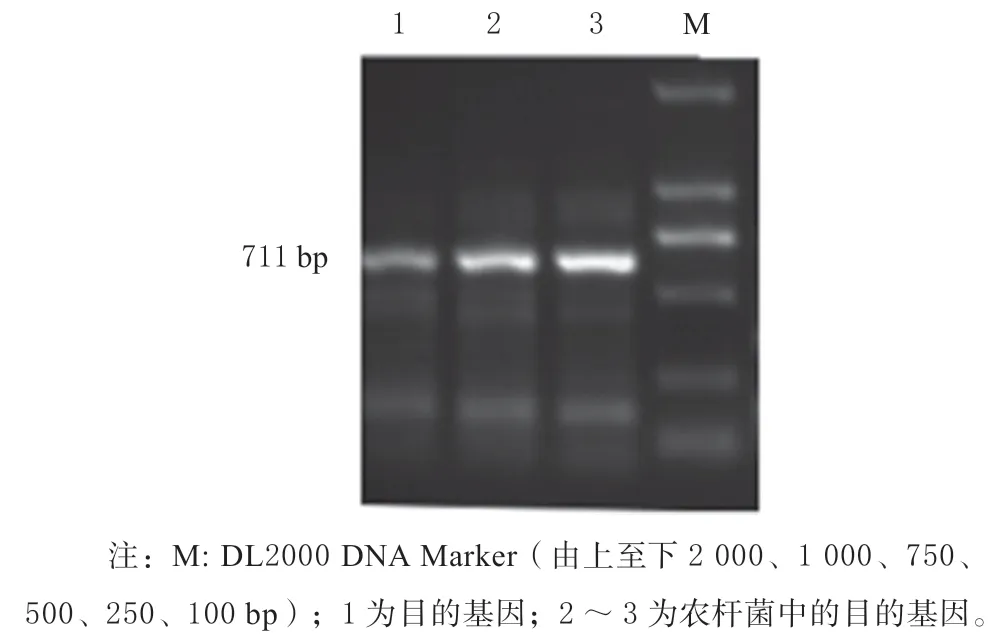
图6 目的片段的PCR 检测Fig. 6 PCR detection of target fragments
2.5.2 转基因拟南芥植株表型特征 经潮霉素抗性筛选,从T0代拟南芥种子获得了T1代抗性植株,可在含潮霉素的培养基上生根生长。移栽后继续观察发现,与野生型(WT)相比T1代抗性植株(MT)叶片发生明显扭曲现象。因此,外源ZjRnase1 基因转入导致拟南芥叶片发育异常,说明ZjRnase1 基因可能参与了叶片发育过程(图7)。

图 7 枣ZjRnase1 基因转化拟南芥Fig. 7 Transformation of Arabidopsis with Chinese jujube ZjRNase1 gene
3 讨论与结论
植物RNase T2 家族分为S-RNases 和S-like RNases 两类[1,15],也可以依据系统进化树分析分为三大类。 第一类和第二类为S-like RNases 基因,S-RNases 则为第三类,不同类别含有的内含子的拷贝数量和位置存在差异[16]。第一类含有来自许多高等植物的非S-RNase 基因,其中一些酶由于保守活性区域发生突变而失去核酸酶活性。这类酶具有多重复制子,其基因组中一般不超过4 个内含子,且具有很强的组织特异性,可能会因为环境胁迫而被诱导。第二类基因普遍存在于大多数植物中,内含子多于4 个,典型的Class II 成员有7 个或8 个内含子。其酶在N 末端有独特的一个保守的二硫化物结构,多在植物中组成性表达,具有明显的保守遗传特征。第三类基因内含子数目一般为1 ~2 个。该类基因存在于存在于玄参科、茄科、蔷薇科等植物的花中,可以降解转运花粉管中的RNA(tRNA),在植物配子体不亲和性中起作用[17]。本研究中获得的ZjRnase1 基因具有2 个内含子,其表达具有器官组织特异性,其蛋白与拟南芥等物种中属于RNase T2 家族Class I 基因编码的蛋白具有高度相似的保守结构,因此,枣ZjRnase1 属于为RNase T2 家族的Class I 基因[16-17]。
拟南芥中的RNS1、RNS3,番茄中的RNaseLE和RNaseLX,以及水稻中的OsRNS4 属于RNase T2家族的Class I 基因[16-17],这些基因参与了生长发育与抗逆反应。番茄RNaseLX 基因可以木质部分化过程[18]或磷酸盐缺失[19]的情况下表达;反义抑制RNaseLX 可以延缓叶片脱落[20];离体叶片在黑暗胁迫[21]下可以诱导番茄中的RNaseLE 和RNaseLX基因表达;损伤后RNaseLE 转录物优先在茎段的韧皮部和形成层细胞中积累,在伤口愈合中发挥作 用[18]。此外,Theierl K 等人研究提出了拟南芥中的RNS1 基因会在机械伤口下被快速诱导表达[11,22]。水稻中的OsRNS4 基因会在虫害或伤口损坏及病原菌侵染植株时被诱导,而且过表达OsRNS4 基因会增加植株的耐盐性,且正调控ABA 反应[23]。因此,该类基因在叶片发育和寄主的防卫反应过程起到了重要作用,但是具体反应机制以及RNase 活性是否为非生物胁迫抵抗不良环境所必须的,还有待考 证[24]。本研究将枣ZjRNase1 基因转入拟南芥,发现转基因植株叶片发生明显卷曲现象。因此,初步明确了该基因参与叶片发育过程,但具体作用机制仍需进一步研究。
