小麦TaTCTP 蛋白的原核表达及抗体制备
2020-09-15孙天杰焦园园王冬梅
麻 楠, 孙天杰, 刘 超, 焦园园, 王冬梅
(华北作物改良与调控国家重点实验室/ 河北省植物生理与分子病理学重点实验室/ 河北农业大学 生命科学学院, 河北 保定 071001)
小麦(Triticum aestivum L.)是世界上重要的粮食作物,而其产量受到多种病害的影响。由小麦叶锈菌(Puccinia triticina)引起小麦叶锈病,是造成小麦产量减少的主要病害之一[1-2]。减少真菌病害是提高小麦产量的有效途径,尽管化学药剂可用于防治小麦真菌病原体,但培育抗病品种是一种更具成本效益和有利于环境保护的主要措施[3]。
翻译控制肿瘤蛋白(Translationally controlled tumor protein, TCTP)是广泛存在于真核细胞中的一种蛋白,并且高度保守[4-5]。在动物中,TCTP 可以调控生长发育[6]、保护染色体[7]、参与细胞凋亡[8]、调节组胺的释放[9,10]和调控微管稳定性[11]等生物学功能。到目前为止,对于TCTP 在植物中的功能的相关研究相对较少。在拟南芥中TCTP 参与细胞生长及分裂,且当TCTP 沉默后,其花粉管的形成及生长发育受阻[12]。在烟草中,TCTP 通过与组氨酸激酶(Tobacco histidine kinase, NTHK)相互作用来响应乙烯信号[13]。而水稻TCTP 可以响应重金属汞的胁迫,并减少活性氧对植物造成的伤害[14]。此外,在植物与病原菌互作方面,对TCTP 的功能研究也少有报导。郑舒畅等研究表明TCTP 参与了小麦抵御白粉菌的侵染过程[15]。番茄和烟草植株中的TCTP 响应胡椒黄花叶病毒(Pepper yellow mosaic virus, PepYMV)的侵染[16]。烟草中的NbTCTP 沉默后,由青枯病菌、菊苣假单胞杆菌和丁香假单胞杆菌诱发的超敏性反应-细胞程序性死亡(Hypersensitive response- programmed cell death, HR-PCD)面积增加[17],表明TCTP 的功能与植物受病原菌侵染时HR-PCD 的诱发有关。
本课题前期研究发现,HR-PCD 是小麦抵抗叶锈菌侵染的重要防卫反应[18-20]。而HR-PCD 受多种信号分子调控,这其中就包括Ca2+信号[19]、H2O2[21]信号及NO[20]信号。而Ca2+作为上游信号在由叶锈菌侵染小麦诱导的防卫反应中发挥着极为重要的作用[20]。课题组前期工作证明,在叶锈菌侵染小麦过程中,TaTCTP 在转录水平响应叶锈菌的侵 染[22],并且位于Ca2+信号通路中。为了对TaTCTP在小麦-叶锈菌互作过程中的作用机制进行深入研究,制备高效、特异的TaTCTP 抗体,对TaTCTP的蛋白水平检测、互作蛋白筛选等研究是至关重要的。本研究对TaTCTP 基因进行了克隆,制备了TaTCTP 的多克隆抗体,并使用制备的TaTCTP 抗体对TaTCTP 在小麦-叶锈菌互作中的表达水平进行了检测。研究结果将为深入研究TaTCTP 的生物学功能,以及进一步完善TaTCTP 在小麦-叶锈菌互作中的分子机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料及供试菌株 小麦近等基因系TcLr26、叶锈菌生理小种260 为本课题组保存的植物材料。大肠杆菌TOP10 感受态细胞为本实验室保存;克隆载体pEASY-T1 购自宝日医生物技术(北京)有限公司;原核表达载体pCOLD II 和大肠杆菌表达菌株BL21(DE3)购自北京全式金生物技术有限公司。
1.1.2 试剂与药品 限制性内切酶Sac I 和Sal I、T4 DNA 连接酶、反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser、高 保 真DNA 聚 合酶PrimeSTAR GXL DNA Polymerase 购自宝日医生物技术(北京)有限公司;RNA 提取试剂盒、质粒提取试剂盒、琼脂糖凝胶回收试剂盒、亲和层析空柱、Ni 离子亲和琼脂糖凝胶、考马斯亮蓝R-250、1×TBST、脱脂奶粉购自生工生物工程(上海)有限公司;Immobilon Western HRP 底物购自西格玛奥德里奇(上海)贸易有限公司;6×Protein loading buffer、蛋白酶抑制剂、Anti-His 抗体、HRP 标记的羊抗兔IgG 购自北京全式金生物技术有限公司。
1.2 试验方法
1.2.1 植物培养 选取健康、饱满的小麦种子播种于直径15 cm 花盆中,在昼夜温度为25/20 ℃,光照时间为14 h/d,日光型镝灯照射,光照强度为 400 W/m2的人工培养室中培育小麦。
1.2.2 基因克隆及载体构建 选取生长7 d 小麦叶片接种叶锈菌生理小种260 的夏孢子,在接种后 24 h 将接种叶片经液氮研磨,提取总RNA,并反转录为cDNA。以cDNA 为模板,使用引物TCTP-F: 5’-gagctcatgctcgtgtaccaggacaag-3’ 和TCTP-R: 5’-gtcgacttagcacttgacctctttcagccc-3’(带有下划线 序列为酶切位点)扩增TaTCTP 编码区全长(长度为507 bp),连接至克隆载体pEASY-T1 上,经蓝白斑筛选、PCR 鉴定后,送深圳华大基因科技有限公司北京测序部测序。将测序正确的菌株提取质粒,使用限制性内切酶Sac I 和Sal I 酶切,1%琼脂糖凝胶电泳后,回收TaTCTP 条带(约为507 bp),并与同样经过双酶切的载体pCOLD II 连接,转化大肠杆菌表达菌株BL21(DE3)。使用引物pCOLD-F: 5’-acgccatatcgccgaaagg-3’和pCOLD-R: 5’-ggcaggg- atcttagattctg-3’对菌落进行PCR 鉴定,鉴定正确的菌落送深圳华大基因科技有限公司北京测序部测序。
1.2.3 蛋白质可溶性分析 使用DNAMAN 软件将克隆得到的TaTCTP 基因序列翻译为氨基酸序列。使用SignalP 软件分析TaTCTP 氨基酸序列中的信号肽[23],参与分析的神经网络偏好设置为真核生物(euk networks)。使用TMHMM 软件分析TaTCTP 中的跨膜结构[24]。
1.2.4 TaTCTP 蛋白的诱导表达 将测序正确的单菌落,接种至含有100 μg/mL 氨苄青霉素(Ampicillin, Amp)的LB 液体培养基(含有10 g/L 胰蛋白胨、5 g/L 酵母浸粉、10 g/L NaCl,pH 7.0)培养12 h。次日按1%的接种量在含有100 μg/mL Amp 的LB 液体培养基进行培养。当菌液的OD600达到0.5 左右时,将其在冰上冷却静置30 min,取菌液加入终浓度为0.5 mmol/L 的IPTG,于16 ℃,170 r/min 的恒温摇床诱导表达24 h。
1.2.5 TaTCTP 蛋白的纯化 经IPTG 诱导处理后的大肠杆菌菌体以25 mL 裂解液(150 mmol/L NaCl、50 mmol/L Tris、1% Triton X-100,pH 7.4)
重悬,于4 ℃,320 W 功率,超声破碎10 min 至菌体呈透明状。破碎的菌体于4 ℃ 15 000 r/min 离心10 min 后用于纯化。在空柱中加入1 mL Ni 离子亲和琼脂糖凝胶,加入5 mL 纯化缓冲液(150 mmol/L NaCl、50 mmol/L Tris,pH 7.4)以活化凝胶。在纯化缓冲液流出后,加入离心后的大肠杆菌裂解上清液与纯化介质孵育5 min,分别使用含有50、100、250 和500 mmol/L 咪唑的纯化缓冲液洗脱并收集。将样品在10%分离胶、5%浓缩胶的SDS-PAGE 凝胶上进行电泳。使用考马斯亮蓝R-250 染色,然后用脱色液脱色,不断更换脱色液至蛋白质条带清晰可见。
1.2.6 TaTCTP 蛋白多克隆抗体的制备及特异性检测 将2.0 kg 左右的新西兰大白兔,免疫之前耳静脉取阴性血清。取400 μg 重组TaTCTP (纯化的带有6×His 标签的目的蛋白),用生理盐水稀释到500 μL,再加入等体积弗氏佐剂(25% 羊毛脂、75% 石蜡油,2 mg/mL 灭活卡介苗);用混匀仪将溶液和佐剂混匀,形成油包水。将混匀好的重组TaTCTP 进行背部皮下注射免疫。初次免疫2 周后进行加强免疫,将200 µg 重组TaTCTP 与不含卡介苗的弗氏不完全佐剂等体积混合形成乳剂在背部皮下多点注射。此后每隔10 d,进行第2 次和第3次加强免疫。最后1 次免疫10 d 后,从耳静脉取血采用ELISA 测定免疫效价。再从颈动脉取血,收集,5 000 r/min 离心10 min。使用ELISA 测定抗体效价,最后使用Protein A 纯化IgG。
1.2.7 Western blotting 免疫印迹法检测抗体特异性 在7 日龄小麦叶片上接种叶锈菌生理小种260,并于接种后0 h 和48 h 取接种叶片,作为叶锈菌侵染前和侵染后样品。小麦样品经液氮研磨后提取可溶性蛋白,然后经10% SDS-PAGE 后,将凝胶转印至PVDF 膜。TBST 缓冲液(10 mmol/L Tris、150 mmol/L NaCl、0.05% Tween-20,pH 7.5)洗涤3遍后(每次5 min),使用封闭缓冲液(5%脱脂奶粉的TBST 缓冲液)室温封闭1 h。在封闭缓冲液中加入纯化后的Anti-TaTCTP 抗体(稀释1∶1 000),室温孵育4 h。使用TBST 缓冲液洗涤3 遍后(每次5 min),按1∶5 000 稀释加入辣根过氧化物酶标记的羊抗兔抗体,室温孵育1 h,使用TBST 缓冲液洗涤3 遍,加入HRP 底物,在暗室中显色并观察结果。
2 结果与分析
2.1 TaTCTP 的克隆、分析与表达载体的构建
以小麦TcLr26 的cDNA 为模板,成功克隆得到了TaTCTP 编码区全长。该基因CDS 区全长为507 bp ( 图1A, B),编码168 个氨基酸,预期分子量为18.8 kD (图1C)。分泌蛋白与胞浆蛋白往往需要不同的表达系统。为了确定TaTCTP 是否为分泌蛋白,需要预测该蛋白是否存在分泌信号。SignalP 分析结果显示,在预测的TaTCTP 氨基酸序列中不含有信号肽信息,表明TaTCTP 为胞内蛋白(图1D),可以 在不截短的情况下,在大肠杆菌细胞内正常表达。TMHMM 分析结果显示,TaTCTP 蛋白不含有明显 的跨膜区(图1E),表示该蛋白具有较高的可溶性,其表达产物在大肠杆菌中很可能分布在可溶性组 分中。
对转化有连接TaTCTP 的pCOLD II 载体的大肠杆菌单克隆进行PCR 鉴定,结果显示,在预期分子量附近可见预期条带(图1F)。测序分析结果显示序列正确,表示原核表达载体pCOLD II-TaTCTP 构建成功。
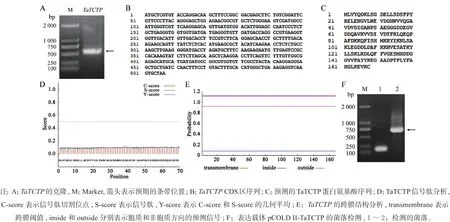
图1 TaTCTP 的克隆、分析及表达载体构建Fig.1 Cloning, solubility analysis and expression vector construction of TaTCTP
2.2 TaTCTP 的诱导表达及纯化
使用IPTG 诱导大肠杆菌中TaTCTP-6×His 重组蛋白表达,并以Anti-His 标签抗体为一抗,借助Western blotting 检测可溶性组分中重组蛋白的表达情况。结果显示(图2A),经IPTG 诱导后可以在预期分子量位置检测到强烈的His 标签信号,而诱导前则信号很弱,表明TaTCTP-6×His 重组蛋白诱导成功。诱导后大肠杆菌的可溶性组分经Ni 离子亲和纯化,并在50、100、250 和500 mmol/L 的咪唑浓度梯度下洗脱获得纯化后的重组蛋白(图2B),其中250 mmol/L 咪唑具有最高的洗脱效率。将纯化后的蛋白收集,并电泳检测纯度和浓度(图2C)。以BSA 为参照,TaTCTP 的浓度可达5 mg/mL 以上,且具有较高的纯度,可用于动物免疫。
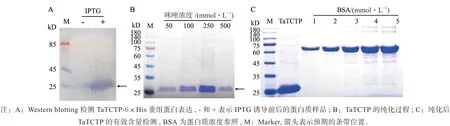
图2 重组TaTCTP 的原核表达Fig.2 Prokaryotic expression of recombined TaTCTP
2.3 TaTCTP 抗体的制备及效价检测
以纯化后的TaTCTP 为抗原包被酶标板,使用ELISA 对免疫45 d 后新西兰大白兔的静脉血清进行效价检测。结果显示(图3A),当抗体稀释梯度从200 ~102 400 倍时,底物反应后测得的OD450/630逐渐减小,最大值一半时对应的抗体稀释倍数为 6 400,即为抗血清的效价。进一步用ELISA 检测使用Protein A 纯化后的抗体纯化后抗体的效价,结果为6 400,表示纯化后的抗体对免疫原具有高亲和性。SDS-PAGE 检测纯化后抗体纯度(图3B),只观察到抗体重链(Heavy chain)和轻链(Light chain)的条带,表示抗体纯度较好。
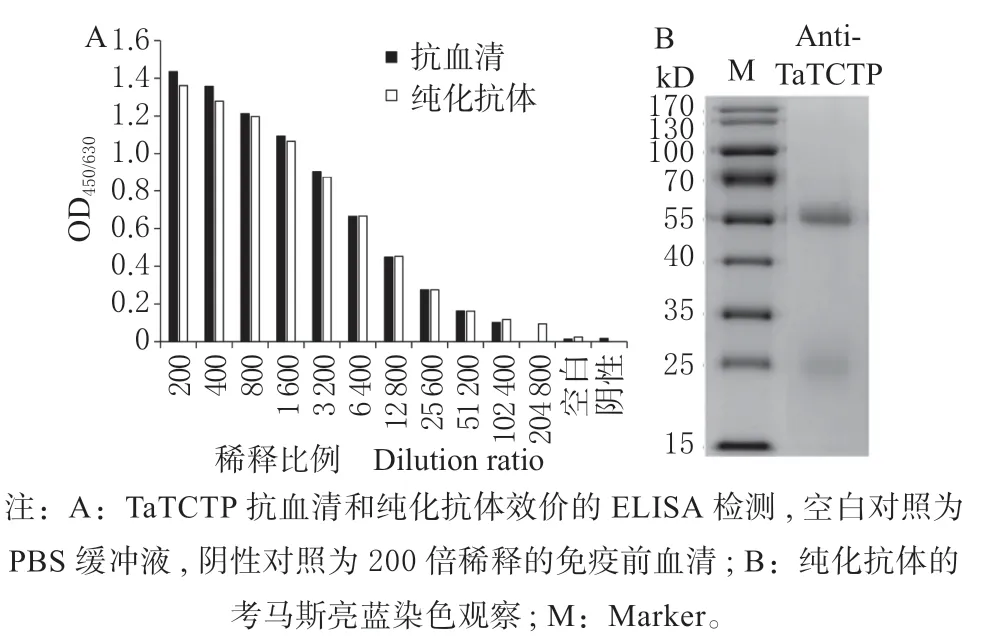
图3 TaTCTP 抗血清及纯化抗体的效价检测Fig.3 Titer detection of TaTCTP antiserum and purified antibody
2.4 TaTCTP 抗体的特异性检测
为了检测TaTCTP 抗体的特异性,将小麦TcLr26 的总蛋白进行电泳,并以BSA 为对照,将纯化后的TaTCTP 抗体为一抗,借助Western blotting检测抗体特异性。结果显示,在杂交后的整个泳道内,只有TaTCTP 预期分子量(18.8 kD)大小处可见清晰条带信号,且无杂带,而BSA (预期分子量为66 kD)无法被抗体识别(图4)。结果表明,TaTCTP抗体特异性良好,该抗体可用于后续的蛋白表达水平检测。
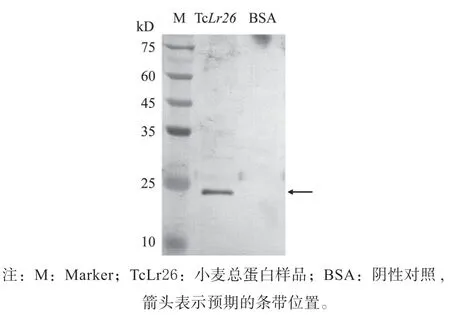
图4 TaTCTP 抗体特异性的Western blotting 检测Fig.4 Western blotting detection of TaTCTP antibody specificity
2.5 小麦-叶锈菌互作中TaTCTP 的表达
将叶锈菌生理260 接种小麦TcLr26,并于接种后0、48 h 分别检测接种叶片中TaTCTP 的表达水平,以丽春红S 染色的Rubisco 大亚基指示上样标准。结果显示,在未接种叶锈菌时小麦中TaTCTP 表达水平较低,叶锈菌接种48 h 后TaTCTP 的表达显著升高(图5)。这一结果说明,TaTCTP 在蛋白水平响应小麦被叶锈菌侵染。
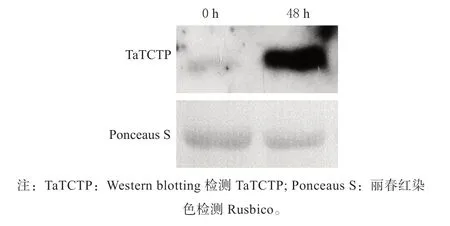
图5 TaTCTP 在叶锈菌侵染过程中的表达变化Fig.5 Expression patterns of TaTCTP in response to P. triticina infection
3 结论与讨论
植物遭受病原物侵染时,会触发多个层面的防卫反应。病原物如何被寄主识别,胞内防卫相关信号又如何传递,是诸多植物病理学家关注的重点。Ca2+[19]、H和NO[21],作为3 种重要的胞内第二信使,在小麦与叶锈菌互作的HR-PCD 诱发过程中发挥重要作用。前期研究表明,Ca2+在NO和H2O2信号上游发挥作用来诱发HR-PCD,以抵御叶锈菌的侵染[20]。通过2 代测序对小麦-叶锈菌互作中的转录组动态进行分析,并使用EGTA 螯合钙离子,以探究受钙信号调控的基因[25]。TaTCTP 在转录水平受叶锈菌侵染诱导升高,在螯合钙离子之后其表达水平显著降低,表示该基因的作用处于钙信号下游受到钙离子调控。为了进一步研究TaTCTP在小麦-叶锈菌互作中的功能及其作用机制,制备高效、特异的抗体具有重要的意义。
用于制备蛋白抗体的免疫原分为两类:蛋白全长,或其抗原表位。TCTP 是广泛存在于真核细胞中的一个小的可溶性蛋白,且高度保守,使用蛋白全长作为免疫原是最好的选择。本研究使用冷激活表达系统,重组蛋白的表达受冷激活启动子cspA驱动,可以有效降低背景蛋白水平[26]。常见的蛋白质纯化标签有6×His 标签和GST 标签[27],其中6×His 标签的优势主要为分子量较小,且不影响蛋白的免疫原性;GST 标签多用来增加蛋白的可溶性,但由于标签较大,常常在免疫前切除。通过对信号肽及跨膜区信息进行分析,发现TaTCTP 不存在信号肽及跨膜域,该蛋白主要分布在细胞质内,且可溶性较高,为此,本研究使用6×His 标签进行后续的蛋白纯化。虽然抗血清可直接用于Western blotting 等试验,但血清中杂质较多,所以后续试验常面临背景高、特异性差等问题,因此需要对血清中的抗体进行纯化。抗体纯化主要有2 种方法:Protein A/G 纯化和抗原亲和纯化[28]。抗原亲和纯化是指使用免疫原制备亲和纯化介质,可以特异性地纯化单一种类的抗体,因而纯化产物具有较高的特异性,但得率往往不高,且成本较高。Protein A/G 是抗体的天然配体,对绝大多数动物的抗体具有较高的亲和力,因此纯化效率高。本研究使用Protein A 纯化抗血清,并得到了特异性较强的纯化抗体。使用纯化后的抗体对叶锈菌侵染0 h (侵染前)和48 h (侵染后)小麦叶片中TaTCTP 的表达水平进行检测,发现与侵染前相比,侵染后TaTCTP 的蛋白水平出现了显著上调,意味着TaTCTP 可能在小麦-叶锈菌互作中发挥功能。
有研究表明,TCTP 参与植物抵御生物胁迫过程中HR-PCD 的调控。TCTP 响应小麦对白粉菌的防卫反应[15],对烟草受青枯病菌、菊苣假单胞杆菌和丁香假单胞杆菌诱发的HR-PCD 有一定调控作用[17]。TaTCTP 在小麦中响应叶锈菌侵染的具体时间和互作因子亟待进一步研究。随着本试验TaTCTP 抗体制备的完成,为深入探讨这些问题奠定了基础。
本研究从小麦TcLr26 中克隆了翻译控制肿瘤蛋白TaTCTP 基因,并成功构建了TaTCTP 原核表达载体。通过IPTG 诱导冷激活表达,Ni 离子亲和纯化,获得了重组TaTCTP 蛋白,将之作为抗原免疫新西兰大白兔,制备了兔源多克隆抗体。进一步借助Western blotting 试验证明TaTCTP 的表达响应叶锈菌的侵染。本研究为进一步研究TaTCTP 在小麦与叶锈菌互作过程中的功能及其作用机制奠定了 基础。
