miR-193a-3p在胃癌中调节细胞凋亡的分子机制研究*
2020-09-14潘新平
潘新平,田 立
(定西市人民医院肿瘤科,甘肃定西 743000)
胃癌作为恶性肿瘤之一,是与癌症相关的第二大常见死亡原因[1]。遗憾的是,早期胃癌很难诊断,患者通常无特异症状,因此该病的早期诊断存在一定困难。为了给分子治疗提供基础,有必要对胃癌发生、发展的分子机制进行了解[2]。微小RNA(miRNA)是体积较小(<20 bp)的非编码RNA家族成员之一,miRNA与靶mRNA结合,通过控制翻译、增加靶mRNA的降解、促进转录后翻译3种途径调控蛋白表达[3]。每个miRNA都有数百个靶区,可以调节大多数遗传途径,并可同30%的人类基因结合。已有研究表明,下调miR-193-3p可通过调控PTEN基因抑制肿瘤细胞的增殖、迁移和化疗耐药[4]。然而在胃癌细胞中miR-193-3p与细胞凋亡的相关研究尚未明了[5]。基于此,本研究旨在探讨miR-193a-3p在胃癌中调节细胞凋亡的分子机制。
1 材料与方法
1.1仪器与试剂 pMir-Glo utr1质粒购自广州基旦生物科技有限公司(货号:JD190929001M)。RPMI-1640培养基购自北京市普京康利科技有限公司(货号:PM150110)。胎牛血清(FBS)购自上海中乔新舟生物科技有限公司(货号:0025)。PAK4,GAPDH,cleaved-capase3抗体购自Abcam公司(货号:ab62509,ab37168,ab2302)。蛋白酶抑制剂Cocktail 购自上海皓元生物医药科技有限公司(货号:HY-K0010)。HiGene转染试剂购自广州市左克生物科技发展有限公司(货号:C1506)。磷酸盐缓冲液(PBS)购自北京华夏远洋科技有限公司(货号:C0221A)。快速定点突变试剂盒购自杭州开泰生物技术有限公司(货号:KM101)。2×预混快速实时荧光定量PCR试剂盒购自北京康润诚业生物科技有限公司(货号:A301-01)。青链霉素混合液(100×)购自北京强欣博瑞生物技术有限公司(货号:CC014a)。逆转录试剂盒购自深圳市凯联生物技术有限公司(货号:205313)。2×十二烷基硫酸钠(SDS)蛋白电泳上样缓冲液购自上海甄准生物科技有限公司(货号:ZZR-E270-1ML)。双荧光素酶报告基因试剂盒购自武汉纯度生物科技有限公司(货号:CDLG-4997)。蛋白裂解液购自碧云天生物技术有限公司(货号:P0013)。miR-193a-3p类似物,miR-193a-3p抑制剂均由上海生工合成。总RNA提取试剂盒购自北京索莱宝科技有限公司(货号:R1200-100T)。健康人胃黏膜细胞系GES-1购自北京博蕾德国际贸易有限公司(货号:CX0441)。人胃癌细胞系MKN-45购自成都乾辰生物医药科技有限公司(货号:CX0439)。人胃癌细胞系SGC-7901购自深圳市译码生物科技有限公司(货号:100674)。人胃癌细胞系MGC-803购自广州永诺生物科技有限公司(货号:CC0404)。人胃癌细胞系SNU16购自上海信裕生物科技有限公司(货号:XY-H0797)。
1.2方法
1.2.1细胞培养与转染 将正常人胃黏膜细胞系GES-1作为对照组,人胃癌细胞系MKN-45、SGC-7901、MGC-803、SNU16在RPMI-1640培养基中培养,加入10% FBS、100 IU/mL青霉素和100 mg/mL链霉素,在37 ℃含5% CO2的湿润环境中培养。将miR-193a-3pp类似物或miR-193a-3p抑制剂同HiGene转染试剂以1∶3的比例混合,在室温下静置20 min后缓慢滴入人胃癌细胞MGC-803的培养基中。
1.2.2RNA提取与实时荧光定量PCR 采用总RNA提取试剂盒联合DNase处理从健康人胃黏膜细胞系GES-1、人胃癌细胞系MKN-45、SGC-7901、MGC-803、SNU16中提取总RNA,并采用逆转录试剂盒进行逆转录。使用快速实时荧光定量PCR预混体系试剂盒进行实时荧光定量PCR。使用内参基因甘油醛-3-磷酸脱氢酶(GAPDH)序列检测系统进行定量PCR分析。使用GAPDH比较相对量化的mRNA水平,并采用2-ΔΔct法进行相关运算。
1.2.3免疫印迹试验 细胞在RIPA缓冲液(50 mmol/L Tris-base,1.0 mmol/L EDTA,150 mmol/L NaCl,0.1% SDS,1% Triton X-100,1%脱氧胆酸钠,1mm PMSF)中溶解。裂解液在4 ℃下、以12 000×g离心10 min。用Bradford法测定蛋白浓度。用SDS-聚丙烯酰胺凝胶电泳(PAGE)分离等量的蛋白,然后转移到聚偏二氟乙烯膜(PVDF)膜上。将膜清洗、堵塞,然后在4 ℃下用一抗(caspase3,GAPDH,PAK4)孵育过夜,然后在室温下用辣根过氧化物酶(HRP)标记的二抗孵育1 h。采用增强化学发光法对蛋白带进行检测。
1.2.4荧光素酶报告系统 使用miRDB在线预测miR-193a-3p靶基因。初步鉴定出目标基因P21活化激酶4(PAK4)。从人cDNA文库中扩增出PAK4 3′UTR的野生型序列。miR-193a-3p结合位点的突变是通过快速突变试剂盒定点突变引入的。PCR产物被克隆到pMir-Glo载体上,该载体位于限制位点XhoI和NotI之间的萤火虫荧光素酶编码区下游。通过双荧光素酶报告基因试剂盒进行荧光素酶活性的检测。
1.2.5细胞凋亡检测实验(Annexin V-FITC/PI双染色法) 转染24 h后,利用胰蛋白酶消化收获细胞,用预冷却的PBS洗涤并在-20 ℃下用70%乙醇溶液固定过夜。将胃癌细胞BGC-803洗涤两次,在黑暗中37 ℃下重悬于含有0.1 mg/mL RNase A和0.1%Triton X-100的PBS中30 min。根据制造商的方案,使用凋亡检测试剂盒,用膜联蛋白V(Annexin V)-荧光素异硫氰酸酯(FITC)和碘化丙啶(PI)对总共1×106个细胞进行双染色并通过荧光显微镜观察。将实验组中凋亡细胞的百分比与对照转染组进行比较。所有样品均进行3次重复试验。

2 结 果
2.1miR-193a-3p在胃癌细胞中低表达 健康人胃黏膜细胞系GES-1、人胃癌细胞系MKN-45、SGC-7901、MGC-803、SNU16的RNA被提取后,通过实时荧光定量PCR结果发现miR-193a-3p在健康人胃黏膜细胞系GES-1中高表达(P<0.05),而在人胃癌细胞系MKN-45、SGC-7901、MGC-803、SNU16中低表达(P<0.05),并且MGC-803细胞的表达量最低,见图1。

注:与人胃黏膜细胞系GES-1中miR-193a-3p表达量相比,*P<0.05。
2.2miR-193a-3p靶向PAK4的3端非编码区 通过TargetScan在线分析,发现miR-193a-3p与PAK4的3端非编码区存在互补区域。通过荧光素酶报告系统发现miR-193a-3p靶向PAK4的3端非编码区(P<0.05),见图2。
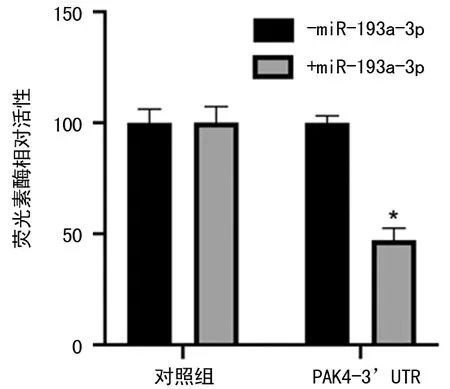
注:与对照组比较,*P<0.05。
2.3过表达miR-193a-3p细胞变化情况 转染miR-193a-3p类似物后,胃癌细胞MGC-803中的miR-193a-3p水平上升,与对照组相比,差异有统计学意义(P<0.05),见图3A。并且,免疫蛋白印迹发现PAK4的表达量降低,而凋亡标志蛋白cleaved-caspase3表达量升高,见图3B。同时,胃癌细胞MGC-803的凋亡水平上升,与对照组相比,差异有统计学意义(P<0.05),见图3C。

注:与对照组相比,*P<0.05。
2.4敲低miR-193a-3p后细胞变化情况 转染miR-193a-3p抑制剂后,胃癌细胞MGC-803中的miR-193a-3p水平下降,与对照组相比,差异有统计学意义(P<0.05),见图4A。并且,免疫印迹结果显示PAK4的表达量升高,而凋亡标志蛋白cleaved-caspase3表达量降低,见图4B。同时,胃癌细胞MGC-803的凋亡水平下降,与对照组相比,差异有统计学意义(P<0.05),见图4C。
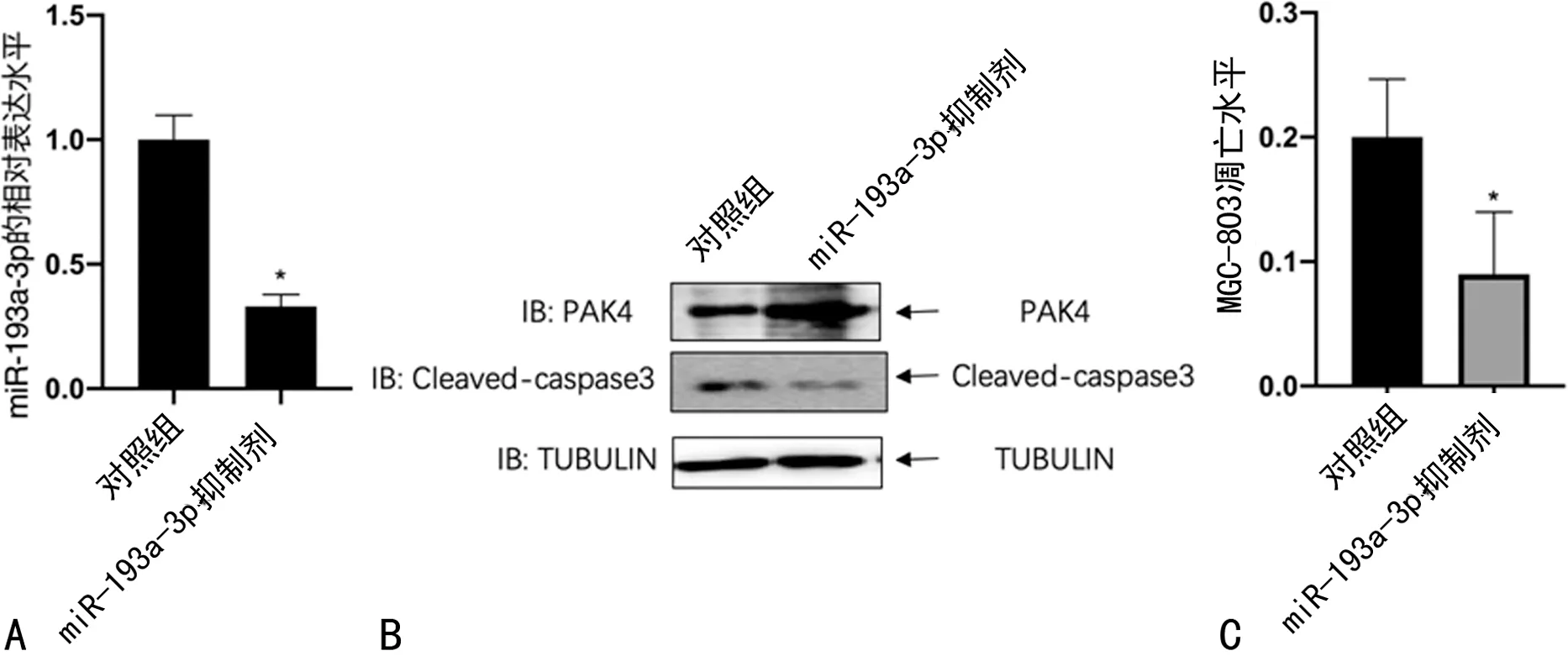
注:与对照组相比,*P<0.05。
3 讨 论
胃癌是全球范围内与癌症相关死亡的主要原因之一。尽管胃癌的手术和辅助治疗技术不断发展,但5年总生存率仍然很低,仅为30%[6]。胃癌的发病受到多因素的影响,包括遗传易感性和环境因素。胃癌也会发生一系列的基因改变,包括抑癌基因、癌基因、细胞黏附分子和生长因子[7]。为了增加治愈率或改善胃癌患者预后,明确疾病特有的额外基因和途径是至关重要的。
miRNA是一种内源性非编码调控rRNA,其核苷酸长度为17~25 bp,在转录后基因调控中发挥重要作用[8]。可在各种靶mRNA的3端非编码区同互补序列结合将导致mRNA直接降解或抑制翻译。miRNA调节基因表达,促进发育、分化、炎症和癌变。越来越多的证据表明,miRNA在癌组织和正常组织中的表达存在差异[9]。由于miRNAs在不同类型的组织甚至组织内的细胞类型都具有特异性,有研究对不同癌症类型的miRNA进行了分析,从而提出了miRNAs在临床应用中的诊断和预后价值[10]。在本研究中,相比于健康人胃黏膜细胞系GES-1,miR-193a-3p在人胃癌细胞系MKN-45、SGC-7901、MGC-803、SNU16中低表达,差异有统计学意义(P<0.05),并且MGC-803的表达量最低。
miR-193a-3p靶向PAK4的3端非编码区。miR-193a位于17号染色体上[11]。在加工过程中,发夹前体miRNA被裂解为成熟的miR-193a-3p和miR-193a-5p。有报道显示,miR-193a-3p在多种癌症中下调,包括乳腺癌、甲状腺髓样癌、非小细胞肺癌和鳞状细胞肺癌[12]。在一些癌症类型中,miR-193a的DNA位点的高甲基化与该miRNA的表达降低有关,如白血病、口腔癌和非小细胞肺癌[13]。因此,miR-193a-3p在相关癌症中的下调发生在转录前,miR-193a很可能位于CpG岛。
PAK家族成员最初被确定为Rac家族小型鸟苷三磷酸酶1(Rac1)和细胞周期蛋白42(Cdc42)的分子靶点[14]。目前,在哺乳动物细胞中已经发现了PAK家族的4个主要成员。PAK4最初是根据其作为细胞骨架调节蛋白的作用被识别的[15]。它是PAK家族中第一个被证明与Cdc42和丝状伪足形成有关的成员。据报道,PAK1通过一种独立于其结合Rac1的能力和部分独立于其激酶活性的机制来诱导丝状足和膜皱褶[16]。本研究发现,过表达miR-193a-3p后,PAK4的表达量降低,而凋亡标志蛋白cleaved-caspase3表达量升高,胃癌细胞MGC-803的凋亡水平上升,差异有统计学意义(P<0.05)。敲低miR-193a-3p后,PAK4的表达量升高,而凋亡标志蛋白cleaved-caspase3表达量降低,胃癌细胞MGC-803的凋亡水平下降(P<0.05),差异有统计学意义。近年来,虽然不同的PAKs具有不同的功能,但也被证明均在调节凋亡反应方面具有重要的作用,例如PAK4可以促使caspase3发生切割,激活了细胞凋亡标志蛋白caspase3,进而有助于细胞凋亡过程中发生形态和膜的变化[17]。
4 结 论
综上所述,miR-193a-3p通过靶向调节PAK4促进胃癌细胞发生细胞凋亡。
