基因传输载体综合实验设计
2020-09-14李晓霞乔立红
程 度, 李晓霞, 乔立红
(中山大学材料科学与工程学院,广州510275)
0 引 言
随着现代生物医学技术的快速发展,基因组测序、生物信息学以及基因编辑等新技术和新策略不断涌现,这些技术极大推进基因治疗等技术的发展,为肿瘤等重大疾病以及众多遗传病的治疗提供了有效手段。目前,向细胞内传输核酸分子的载体材料主要有病毒载体和非病毒载体两大类。虽然病毒载体具有传输效率高的优点,但其较强免疫原性也限制了其临床应用。基于高分子材料的基因传输载体因其功能多样性、无免疫原性和基因传输效率高的特点,在临床基因治疗方面展示出很好的应用前景。
经过近20 年的发展,根据临床的需求,高分子材料基因传输载体发展出了多种类型的载体材料,不仅满足了低毒性和生物可降解的临床需求[1-2],也发展出具有体内长循环、生理微环境(如pH、还原性、酶)响应性、诊疗一体化等功能多样的基因输送载体[3-6]。而且,随着生物材料学科的发展,新的基因输送新技术和载体会不断涌现,为生物医学的发展带来新的变革。为了使学生对基因载体的设计、材料制备方法、纳米粒子组装及其生物功能评价有较为全面的认知和掌握,本文选择经典的高分子基因载体材料-聚乙二醇-聚乙烯亚胺设计综合实验。
1 实验部分
1.1 实验试剂
聚乙烯亚胺(polyethyleneimine,PEI,Mn=25 kDa),聚乙二醇单甲醚(mPEG-OH,Mn=2 kDa),溴化氢的醋酸溶液(33%),对甲苯磺酰氯(p-toluenesulfonyl chloride, TsCl ), N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS),N,N′-二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(N-Ethyl-N′-(3-dimethylaminopropyl ) carbodiimide hydrochloride,EDC),二甲基亚砜(DMSO),均为分析纯,购于Sigma-Aldrich(St. Louis,MO,USA);其他化学试剂均购于广州化学试剂厂,用时根据需要经过干燥纯化处理或直接使用。透析袋(MWCO:1,3. 5,14 kDa),购于上海绿鸟生物科技公司。MTT 检测试剂盒购自美国Sigma-Aldrich公司;细胞培养所用胰蛋白酶和胎牛血清(FBS)购自美国Invitrogen 公司(Carlsbad,CA,USA);人卵巢癌SKOV3 细胞购自中科院上海细胞库,由本教学实验室冻存保存。表达绿色荧光蛋白的质粒DNA(pDNA)pcDNA3. 1-EGFP购自上海康朗生物科技有限公司。
1.2 实验仪器
氢谱1H-NMR:采用VARIAN Mercury-Plus 300 型核磁共振仪进行分析,使用CDCl3作为溶剂。凝胶电泳装置:EPS-100 电源、HE-120 电泳槽和Tanon-1600成像系统购自上海天能科技有限公司。粒径和表面电位测定:使用BI-200 SM 动态光散射系统(Brookhaven Instruments,Holtsville,NY),在25 ℃下检测。散射光以90°检测,自动加速器上收集。倒置荧光显微显微镜采用徕卡DMi8 (Leica Microsystems Inc.,Buffalo Grove,IL 60089 United States)。CO2细胞培养箱采用377 型号(Thermo Fisher Scientific,Waltham,MA)。
1.3 单甲醚聚乙二醇-聚乙烯亚胺(PEG2k ~PEI25k)聚合物的制备
(1)用N,N-羰基二咪唑(CDI)活化单甲醚聚乙二醇(mPEG2k-OH),反应路线如图1 所示。mPEG2k-OH(4. 0 g)加入到250 mL圆底烧瓶瓶中,70℃条件下真空干燥4 h,加入30 mL四氢呋喃溶解mPEG2k-OH,再后加入3. 2 g (10eq.)的CDI,在氩气保护下室温反应24 h后,加入无水乙醚沉淀产物,减压过滤得到沉淀,干燥得白色粉末状产物,产率89%。

图1 PEG-CDI的合成路线
(2)mPEG2k-CDI和PEI25k上的氨基反应制备阳离子两嵌段聚合物PEG2k-PEI25k,反应路线如图2 所示。在50 mL圆底烧瓶中用二甲基亚砜(DMSO,20 mL)溶解PEI25k聚合物(1 g),再加入上步制备的mPEG2k-CDI 800 mg (10 eq.),室温下搅拌反应过夜。所得溶液在纯水中透析48 h,每4 h换一次蒸馏水,透析袋规格为:MWCO =14 kDa。冷冻干燥后得白色产物,产率83%。
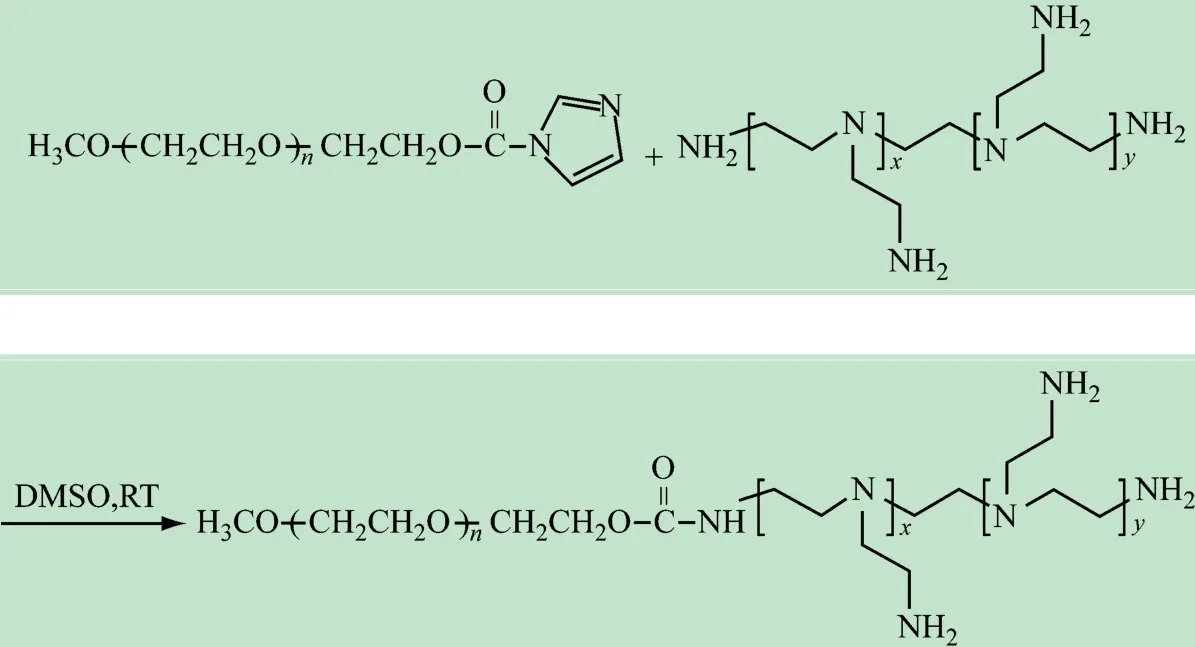
图2 阳离子聚合物PEG2k-PEI25k的合成路线图
1.4 负载pDNA纳米载体的制备
本综合实验所使用的pDNA为表达绿色荧光蛋白的质粒pcDNA3. 1-EGFP,由综合实验室提前制备。质粒DNA 溶于TE 缓冲液中,浓度为1 g / L。一定量pDNA(如1 μg)加入到已知量的载体聚合物PEG2k-PEI25k的溶液中,按照阳离子聚合物中氨基与pDNA磷酸根的摩尔比(N/ P)为0、0. 5、1、2、4、8、10、20 的条件,将聚合物和pDNA相混合,加入去离子水定容到一定体积,充分混匀后,室温下振荡孵育30 min,再静置10 min,即得不同N/ P条件下载pDNA的纳米粒子。
1.5 纳米粒子理化性能的评价
(1)粒径电位的测定。按照1. 4 中的方法制备负载pDNA的纳米粒子,用动态光散射系统测定N/ P =10 时纳米粒子的粒径和Zeta 电位。温度25 ℃,入射角45°。每组样品均取5 次测量的平均值。
(2)聚合物PEG-PEI 复合pDNA 的能力。按照1. 4 中的条件,在不同N/ P 下,将聚合物PEG-PEI 和pDNA充分混匀,将混合溶液加入到含GoldView(DNA染料)的1%琼脂糖凝胶的加样孔中进行电泳分析,100 V的电压下电泳20 ~30 min,电泳结束后,在紫外灯下观察琼脂糖凝胶中电泳条带。
1.6 基因输送性能的评价
(1)细胞培养。细胞培养基为RPMI 1640 培养基(添加10%胎牛血清和1%双抗)的,培养条件为37 ℃和5% CO2。当细胞密度达到80% ~90%时,用胰酶(Trysin,0. 25%)消化细胞,进行分瓶传代。
(2)细胞毒性评价。通过四唑盐比色法(MTT)检测纳米载pDNA纳米粒子对细胞的杀伤作用。细胞以1 × 103/孔的密度接种于96 孔细胞培养板,培养过夜。次日,弃去原有细胞培养基,更换成不含血清的新鲜培养基,加入不同N/ P 条件下制备的载pDNA 纳米粒子。进行MTT分析时,弃去原有培养基,加入150 μL不含血清的RPMI 1640 新鲜培养基,加入50 μL MTT溶液(5 mg / mL),在37 ℃下继续孵育4 h,弃去培养孔中的上清液,每孔加入150 μL DMSO,震荡5 min,用酶联免疫检测仪(美国国腾)检测OD570nm处的吸光度值,按照以下公式计算细胞增殖率。

(3)基因表达效率评价。将细胞(密度为1 × 104细胞/孔)接种于24 孔培养板上,加入400 μL 培养基培养过夜。次日,更换为新鲜培养基,加入不同N/ P比下制备的载质粒DNA 的纳米粒子,在37 ℃下继续培养48 h。倒置荧光显微镜下观察细胞表达绿色荧光蛋白的情况。
2 结果与分析
2.1 聚合物材料的制备与表征
将末端羟基PEG接枝到PEI上,需要对PEG上的羟基进行活化。根据综合实验的实际情况和需求,采用一种步骤较少和易于操作的方法活化PEG 上的羟基。如图3(a)所示,首先用CDI 活化PEG,其中化学位移的归属如下:δ = 3. 4 (s,3H, CH3—OCH2CH2—),3. 65(s,4H,—OCH2CH2—),4. 6(m,2H—OCH2CH2—O(C =O)—,7. 05(s,1H,—CO—NCH =CH—N—),7. 40(s,1H,—CO—N—CH =CH—N—),8. 12(s,1H,—CO—N—CH =N—)。由δ 3. 4 μm 及δ 7. 40 μm 两处化学位移的积分面积算出端基转化率为81%。然后再把PEG-CDI 偶联到PEI上,如图3(b)所示,在δ 2. 5 ~3. 5 μm 处出现了PEI上—CH2CH2NH—的质子特征化学位移,同时δ 4. 4 μm,δ 7. 05 μm ,δ 7. 40 μm ,δ 8. 12 μm等处的化学位移消失,表明PEG-CDI 已经成功地连接到PEI 上,其中的咪唑基团已经被作为副产物除掉。
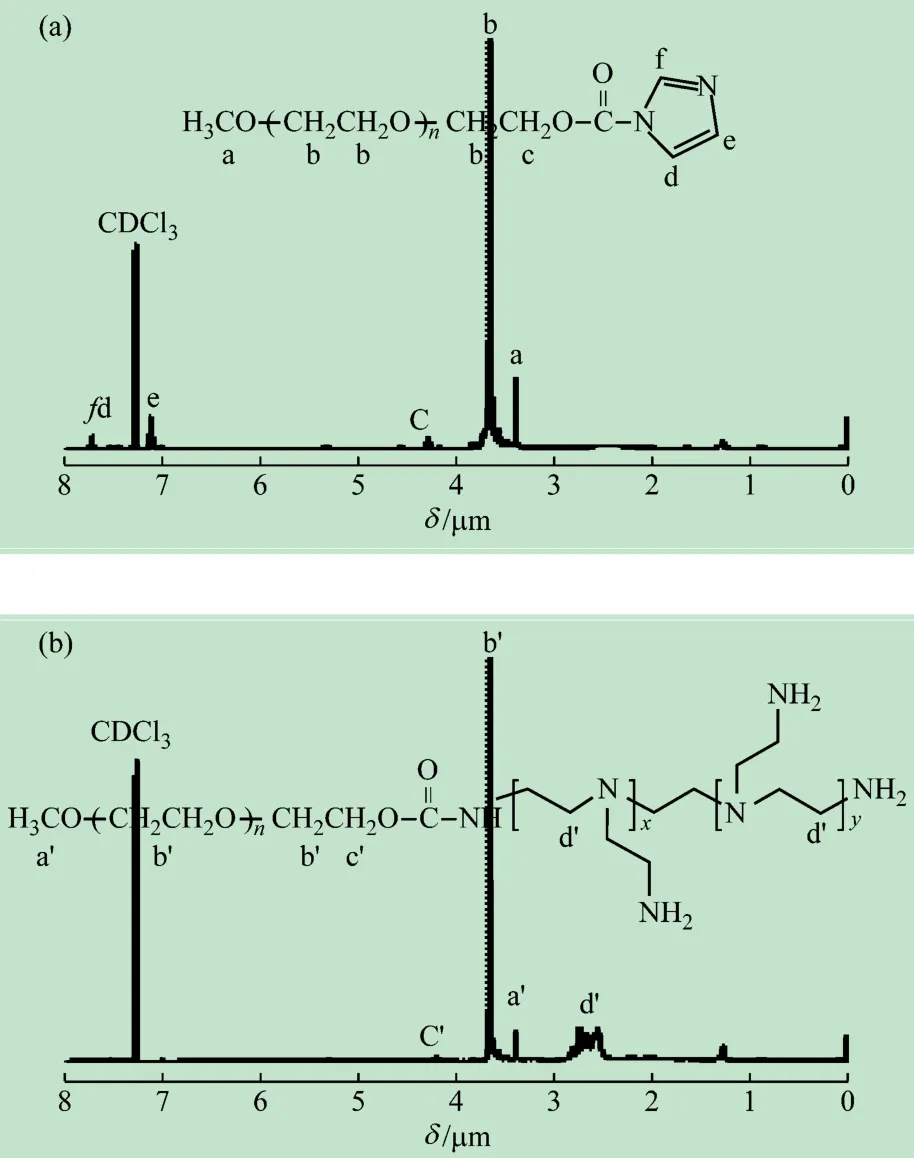
图3 聚合物mPEG2k-CDI(a)和PEG2k-PEI25k(b)的1H-NMR图谱(CDCls,300 MHz)
2.2 纳米粒子的组装
PEI聚合物具有枝化结构,携带有伯胺、肿胺和叔胺(图4(a)),在pH 7. 4 条件下,部分胺基可质子化,携带较强的正电荷,通过静电相互作用与携带负电荷的pDNA组装形成纳米粒。根据不同状态pDNA在电场下泳动速度和距离的不同,可用凝胶阻滞方法评价PEG-PEI复合pDNA 的能力(图4(b))。在N/ P≤4时,PEG-PEI 量相对较少,部分pDNA 仍处于游离状态,形成较窄的DNA电泳条带。随着N/ P 的提高,游离pDNA条带亮度逐渐降低直至消失,而弥散DNA带型则呈逐渐增加而后消失的现象。其原因在于:随着PEG-PEI含量的增加,PEI 的正电荷逐步中和pDNA的负电荷,使游离的pDNA减少;当PEG-PEI量仍不足以完全复合pDNA 时,纳米粒子上的pDNA 未被完全中和,形成携带不同负电荷的纳米粒子,从而导致pDNA在凝胶上呈现出弥散的带型;在N/ P ≥8 时,pDNA带型完全消失,表明pDNA 的负电荷已被完全中和,pDNA在电场下的泳动被阻滞。
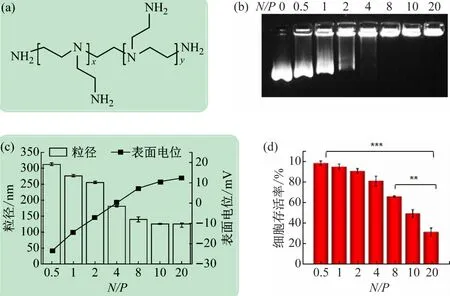
图4 (a)PEI结构式;(b)不同N/ P比下所制备纳米粒子的凝胶阻滞电泳;(c)不同N/ P条件下,所制备纳米粒子的粒径和表面电位;(d)MTT法评价不同N/ P下所制备纳米粒子的细胞毒性
但是凝胶阻滞并不能对所形成的纳米粒子的表面电位和粒径给予定量表征,而这些是影响纳米粒子转染细胞效率的重要因素。因此,需要进一步通过动态光散射对PEG-PEI和pDNA所形成纳米粒子的表面电位和粒径进行表征。如图4(c)所示,在N/ P =0. 5时,表面电位和粒径分别为- 23 mV 和313 nm,表明pDNA未被完全复合和压缩,导致粒径偏大和电位偏负;随着N/ P 增加到4,纳米粒子负电位减小直至为0,粒径呈现减小的趋势;当N/ P >4 时,纳米粒子表面电位的正电性逐渐增加,而粒径逐渐减小;在N/ P 在10 ~20 时,纳米粒子表面电位和粒径则稳定在+ 10 mV和125 nm左右。
由此可见,当PEG-PEI 刚好完全中和pDNA 的负电荷时,并没有很好地压缩pDNA,未形成较为致密和稳定的纳米粒子;高N/ P 下,纳米粒子具有较强的正电位和较小的粒径,有利于提高细胞转染效率。但是,较高正电荷会导致明显的细胞阳离子毒性。因此,需要选择合适N/ P,合理调控纳米粒子的表面电位和粒径,才能获得较高的转染效率。
2.3 基因载体的安全性初步评价
MTT方法是一种简单实用的评价聚合物细胞安全性的方法,在材料的安全性评价中得到广泛的应用。如图4(d)所示,当N/ P <2 时,细胞存活率大于90%,与对照组没有显著差异,当N/ P >10 时,细胞存活率逐渐下降,N/ P =20 时,细胞存活率低于50%。
因此,综合考虑表面电位、粒径以及细胞毒性等数据,在N/ P =8 时制备的纳米粒子,具有较为适宜的电位、较小的粒径和较低的细胞毒性,是较为适宜的载基因纳米粒子制备条件。
2.4 基因转染效率的评价
考察不同特性纳米粒子对转染效率的影响。如图5 所示,用N/ P =8 条件下所制备纳米粒子转染细胞时,表达绿色荧光蛋白的细胞数量最多,而且绿色荧光强度最高;在N/ P =0. 5 条件下,所制备纳米粒子为负表面电性和较大的粒径,导致其基因转染效率降低,表达绿色荧光蛋白的细胞数量最少;当N/ P =20 时,所制备纳米粒子转染细胞,虽然表达绿色荧光蛋白的细胞百分比也较高,但是存活的细胞数量明显降低,这表明纳米粒子具有较高的细胞毒性。
3 讨 论
PEI的结构单元(—CH2CH2NH2—)含有一个可质子化的氮原子,正电性氨基可有效复合和压缩质粒DNA,而且仲氨和叔氨在酸性条件下的质子海绵效应发挥破溶酶体的作用,这些因素协同提高了PEI 转染基因的效率。但是,PEI 强正电荷具有较强的细胞毒性和吸附血液或细胞培养基的蛋白,导致转染效率的下降[7-8]。PEG是一种无毒和低免疫原性的水溶性聚合物,具有优良的生物相容性,在药物改性方面有广泛的应用[9],PEG修饰可降低PEI的细胞毒性和减少蛋白在其表面的沉积。在PEG修饰改性技术中,采用具有琥珀酰亚胺酯端基、环氧化物端基或醛基端基的活性PEG 修饰PEI 是行之有效的方法[10-11]。但是这些具有特异性端基活性PEG的制备复杂且价格昂贵,限制了其在学生实验中的应用。端羟基PEG 来源广泛且价格较低,是较为理想的供学生实验使用PEG修饰剂。但是羟基的反应活性较低,需要对其进行活化。已有多种文献报道了活化端羟基PEG的方法,如通过丁二酸酐或马来酸酐与羟基反应引入羧基,再用DCC / NHS活化羧基,再和PEI上的氨基进行酰胺化反应,从而将PEG接枝到PEI[12]。但是该方法操作步骤较多,不利于本科生实验的开展。二异氰酸酯也可作为端羟基PEG 的活化剂[13],但要经过多次纯化去除干净二异氰酸酯,才能避免残余二异氰酸酯和PEI 的副反应,也增加了实验操作步骤和难度。
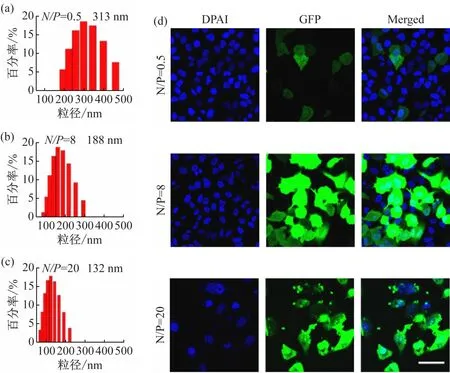
图5 制备纳米粒子的粒径及其分布及转染细胞的荧光显微成像(细胞核经DAPI染色后发蓝色荧光,GFP蛋白发绿色荧光。图(d)中的标尺为50 μm)
N,N-碳酰二咪唑(CDI)是一种羧酸活化和甲酰基转移的试剂[14],具有反应活性高、反应后处理简单和易得廉价的特点,常用来合成酰胺类聚合物。与EDC和DCC等同类试剂相比,CDI在学生实验中具有更高的应用价值。由于咪唑基团的影响,CDI 中的碳酰基具有非常好的甲酰化反应活性,可与羧酸反应生成具有高反应活性的酰基咪唑。酰基咪唑与胺可在非常温和的条件下生成相应的酰胺[15],可以应用于多肽的合成。
所设计的综合实验选择操作简单且易于掌握的方法来实施,便于学生实验的开展。将实验分解为载体制备与表征、纳米粒子组装与表征、基因的负载与表征和生物功能评价4 个模块,较为全面体现了基因载体研究的基本内容。通过该综合实验可以使学生对基因载体的制备与评价有较为全面了解,并初步掌握基因载体的研究方法,是对高年级本科生进行科研训练较为适宜的综合实验。
4 结 语
本实验设计通过CDI 活化PEG 的羟基来制备PEG-PEI聚合物,聚合物和纳米粒子表征结果表明,所制备聚合物可以高效负载pDNA,并将pDNA 导入细胞和表达绿色荧光蛋白。实验设计需要使用核磁、动态光散仪、凝胶电泳和倒置荧光显微镜和细胞培养箱等仪器。可使生物材料专业的学生掌握常见基因载体的制备方法,综合运用材料制备、纳米粒子表征和生物评价等方面的知识解决问题,深化对生物材料设计、结构和应用的认识,巩固理论课所学知识,培养高年级本科生操作能力和研究性科研思维能力,为其后续的学习深造和工作奠定良好的基础。
