鹿瓜多肽注射剂质量评价与研究
2020-09-14周朝东伏圣青税凤春黄哲甦
苏 喆,周朝东,马 冰,张 晶,伏圣青,王 冲,税凤春,黄哲甦
(天津市药品检验研究院,天津300070)
鹿瓜多肽注射剂包括鹿瓜多肽注射液和注射用鹿瓜多肽,属于多组分生化药。鹿瓜多肽注射剂是从动物梅花鹿骨骼和中草药甜瓜子中分离、提取制成的灭菌水溶液或无菌冻干品。无菌冻干品的辅料为甘露醇或右旋糖酐40。鹿瓜多肽注射剂的主要成分鹿骨提取物中含有骨诱导多肽、多种游离氨基酸,以及钙、磷等活性因子,可以诱导成骨细胞的转化,促进骨折愈合;甜瓜子提取物富含多肽、不饱和脂肪酸,可以降低毛细血管通透、减少炎性渗出,有效缓解各种炎性症状。鹿瓜多肽注射剂临床上主要用于风湿、类风湿关节炎、强直性脊柱炎、各种类型骨折、创伤修复等[1]。
目前鹿瓜多肽注射剂在我国共有3 家企业生产,7 个国药准字批准文号。现行标准包括:国家药品标准 WS1-XG-002-2002-2005、试行标准YBH12682005(8 mg)/ YBH12432006(16 mg)/YBH13522006(24 mg)、试行标准YBH13342005及补充申请批件2006B01192。历版《中华人民共和国药典》及国外药典均未收载鹿瓜多肽注射剂。
国家药品监督管理局将鹿瓜多肽注射剂列入2019 年国家药品评价性抽验计划,隶属于多组分生化药专项。此次国家药品监督管理局药品监督管理司共抽样鹿瓜多肽注射剂69 批次,其中注射用鹿瓜多肽有4、8、16 和24 mg 4 种规格;鹿瓜多肽注射液有2 mL∶4 mg和4 mL∶8 mg两种规格。
在对生产企业进行实地调研及样品法定检验时发现了如下问题:(1)现行标准暂无样品新鲜度质控项目。现场调研时发现甜瓜子原料存在霉变、酸败的现象,中间提取液存在反复冻融的情况,且企业未对生物胺、真菌毒素、酸价及过氧化值等影响产品新鲜度的指标进行控制;(2)现行质量标准WS1-XG-002-2002-2005 未对高相对分子质量物质进行控制;其余质量标准均采用凝胶色谱法测定高相对分子质量物质。经法定检验发现,由于制剂成分非常复杂,色谱流出峰难以有效分离,对积分和定量都造成一定困难,导致测定结果不准确;(3)现行标准缺失溶血与凝聚、生物学活性测定项目,无法从安全性、有效性方面控制产品质量;(4)现行标准采用福林酚法测定多肽含量,该法存在辅料干扰、对照品和供试品溶解稀释所用溶剂不一致的情况。基于上述问题,本研究开展一系列探索,包括建立新鲜度质量属性的检测项目、优化高相对分子质量物质和多肽含量测定检测方法、考察溶血与凝聚及生物学活性测定,从安全性、有效性角度系统研究鹿瓜多肽注射剂的质量状况,以期为鹿瓜多肽注射剂质量标准的完善奠定理论基础。
1 材 料
1.1 药品与试剂
8 种生物胺对照品,包括:组胺、酪胺、尸胺、腐胺、2-苯乙胺、色胺、精胺、亚精胺(纯度均大于98.0%,美国Sigma-Aldrich公司);黄曲霉毒素混合对照品溶液(批号LC01086,含黄曲霉毒素B1、B2、G1、G2质 量 浓 度 分 别 为:0.961、0.280、0.903、0.296µg/mL,美国Supelco公司);黄曲霉毒素免疫亲和柱(AflaTest,1 mL,美国Vicam 公司);核糖核酸酶A(批号E1624067,上海阿拉丁生化科技股份有限公司);超低相对分子质量蛋白质Marker(3.3-20.1 kD,北京索莱宝科技有限公司);Pierce Quantitative Colorimetric Peptide Assay 多肽含量测定试剂盒(批号UD286404C,美国Thermo Fisher 公司);牛血清白蛋白(批号SLBC3968V,美国Sigma-Aldrich 公司);RPMI 1640 培养基(批号0022919,以色列Biological Industries 公司);胎牛血清(FBS)(批号1913445,以色列Biological Industries 公司);CCK-8 试剂盒(批号NY652,日本同仁化学研究所);乙腈、甲醇为色谱纯(德国Merck 公司);实验用水为Millipore 超纯水;其余试剂均为市售分析纯。鹿瓜多肽注射剂均为2019年国家药品抽验计划样品(69 批,来自3 个生产企业);鹿瓜多肽中间提取液、甜瓜子原料均由3个生产企业提供。
1.2 仪 器
Waters e2695 高效液相色谱系统,配2489 UV/Vis 紫外检测器、Aura Industries 光化学衍生器(254 nm紫外灯衍生光源)及2475 FLR荧光检测器(美国Waters 公司);T50 自动电位滴定仪、XS205电子天平(瑞士Mettler Toledo 公司);Mini-Protean Tetra 垂直电泳系统及Universal Hood Ⅱ凝胶成像系统(美国Bio-Rad 公司);Varioskan Flash 多功能酶标仪、HERAcell 240i 二氧化碳培养箱(美国Thermo Fisher 公司);CF16RXII 冷冻离心机(日本Hitachi 公司);R-215 专业型旋转蒸发仪(瑞士Buchi 公司);ECLIPSE TS100-F 倒置显微镜(日本Nikon 公司);SpectraMax M2 多功能酶标仪(美国Molecular Devices 公司);纯化水仪(美国Millipore公司)。
1.3 细胞株
人髓系白血病单核细胞株(THP-1),购自武汉普诺赛生命科技有限公司;以含10%胎牛血清的RPMI 1640培养基培养,定期传代。
1.4 动 物
家兔(2.5~3.3 kg,普通级)购自天津裕达实验动物养殖有限公司,合格证号:0010784。
2 方 法
2.1 生物胺的测定
生物胺是食品或药材新鲜程度和被微生物污染程度的标志[2]。本研究以丹磺酰氯为衍生试剂,衍生化RP-HPLC 法测定鹿瓜多肽注射剂中的生物胺类成分。
2.1.1 溶液的制备 对照品溶液:取8 种生物胺对照品各适量,精密称定,分别置10 mL量瓶中,用0.1 mol/L 盐酸溶液制成每1 mL 中约含各生物胺2.5 mg 的溶液,作为对照品贮备液。分别量取各生物胺对照品贮备液1.0 mL,置同一25 mL 量瓶中,用0.1 mol/L 盐酸溶液稀释至刻度,摇匀,制得生物胺混合对照品溶液(0.1 mg/mL);精密量取此混合对照品溶液0.01,0.10,0.50,1.00,2.00,5.00 mL,分别置10 mL 量瓶中,用0.1 mol/L 盐酸溶液稀释至刻度,摇匀,制得0.10,1.00,5.00,10.00,20.00,50.00 µg/mL 的系列混合对 照 品溶液。
供试品溶液:取鹿瓜多肽注射液(A 企业),作为供试品溶液;取注射用鹿瓜多肽(B、C 企业),用0.1 mol/L 盐酸溶液溶解并稀释制成2 mg/mL 的溶液(以多肽计),作为供试品溶液。
空白溶剂:取0.1 mol/L 盐酸溶液,作为空白溶剂。
衍生剂溶液:精密称取丹磺酰氯适量,用丙酮制成10 mg/mL的溶液,作为衍生剂溶液。
精密量取上述系列混合对照品溶液、供试品溶液和空白溶剂各0.5 mL,依次加入衍生剂溶液1 mL、饱和碳酸氢钠溶液0.3 mL 与氢氧化钠溶液(2 mol/L)0.2 mL,60 ℃水浴避光反应30 min,取出加入氨水(1∶1)0.2 mL,室温避光反应30 min,加乙酸乙酯5 mL 提取3次,合并提取液,40 ℃水浴氮气吹干,加甲醇1.0 mL 溶解残留物,用0.22µm 有机滤膜滤过,进行HPLC测定。
2.1.2 色谱条件 采用Inertsil ODS-3 色谱柱(250 mm×4.6 mm,5 µm),以水(A)-90%乙腈(B)为流动相,梯度洗脱(0~30 min,50%B→100%B;30~38.5 min,100% B;38.5~39 min,100% B→50% B;39~43 min,50% B),检测波长为254 nm,柱温30 ℃,进样量30µL。
2.1.3 专属性 取生物胺混合对照品溶液(10µg/mL)、供试品溶液(批号120180407)和空白溶剂分别进行衍生,并进样分析。
2.1.4 线性关系、定量限及检测限 精密量取衍生后的系列混合对照品溶液各30µL进样分析,以8 种生物胺质量浓度(X)为横坐标,各生物胺的峰面积(Y)为纵坐标建立标准曲线,考察各生物胺的线性关系。取上述衍生后的混合对照品溶液用甲醇适当稀释,以信噪比S/N=10 和S/N=3 分别作为定量限和检测限。
2.1.5 回收率 取批号为220190106 的供试品溶液0.25 mL,共制9 份,分成3 组。分别精密加入1.00、5.00、10.00 µg/mL 混合对照品溶液0.25 mL,每个质量浓度重复3 份,分别衍生后进样分析。
2.1.6 精密度 取混合对照品溶液(10 µg/mL)0.5 mL进行衍生反应,平行制备6份,进样分析。
2.1.7 样品测定 取3 个厂家的样品按照“2.1.1”项下方法制备供试品溶液及对照品溶液并分别进行衍生反应,按照“2.1.2”项下色谱条件进样分析,记录色谱图,按外标法以峰面积计算各生物胺的含量。
2.2 黄曲霉毒素的测定
按照《中华人民共和国药典》(2015 年版)四部通则2351黄曲霉毒素测定法指导原则及相关的文献[3-4],建立了鹿瓜多肽注射剂及中间提取液中黄曲霉毒素的HPLC 柱后光化学衍生测定方法。采用Phenomenex Luna C18色谱柱(250 mm×4.6 mm,5 µm),荧光检测器(激发波长360 nm,发射波长450 nm),以甲醇-乙腈-水(30∶15∶55)为流动相,柱温30 ℃,进样量50µL。将适宜浓度的黄曲霉毒素混合对照品溶液、鹿瓜多肽注射剂样品溶液及中间提取液分别通过免疫亲和柱,流速为每秒1~2滴,用水20 mL 洗脱,弃去洗脱液,使空气进入柱子,最后用甲醇洗脱并进样分析。
2.3 甜瓜子原料酸价及过氧化值的测定
参考食品安全国家标准《食品中酸价的测定(GB 5009.229-2016)》及《食品中过氧化值的测定(GB 5009.227-2016)》,对甜瓜子原料(A 企业3 批,B 企业5 批)的酸价、过氧化值进行检测。首先将甜瓜子粉碎,用水搅匀并浸泡2~3 h;再加入石油醚,浸泡过夜;经装有无水硫酸钠的滤纸过滤,取滤液置圆底烧瓶中,在40 ℃水浴中用旋转蒸发仪蒸干石油醚,残留物即为待测油脂;用滴定法测定待测油脂的酸价和过氧化值。酸价测定采用乙醇制氢氧化钾滴定液(0.1 mol/L)进行电位滴定;过氧化值测定采用硫代硫酸钠滴定液(0.002 mol/L)进行电位滴定。
2.4 高相对分子质量物质
参考相关文献[5-6],进行条件优化后采用Tricine-SDS-PAGE 电泳法测定鹿瓜多肽注射剂的高相对分子质量物质。优化后的电泳条件为:16.5%的分离胶,10%的积层胶,4%的浓缩胶;阳极缓冲液为Tris-HCl缓冲液(pH 8.9),阴极缓冲液为Tris-Tricine-SDS 缓冲液;染色液为甲醇-冰醋酸-水(200∶50∶250)、含0.2%考马斯亮蓝R-250;脱色液为0.5 mol/L 氯化钠溶液。实验时先用Tricine-SDS-PAGE 分离供试品溶液中的多肽成分,然后用考马斯亮蓝R-250进行染色,对相对分子质量大于5 800的高相对分子质量蛋白进行定量。精密称取核糖核酸酶A 适量,加水溶解并稀释制成含核糖核酸酶A 800,600,400,200,100 µg/mL 的系列溶液,作为蛋白对照品溶液1~5。以蛋白对照品溶液1~5 的蛋白含量为横坐标,灰度值为纵坐标进行线性回归,得出线性方程。根据供试品溶液中蛋白条带的灰度值计算出供试品中高相对分子质量物质的含量。
2.5 溶血与凝聚
取家兔耳动脉血,按《中华人民共和国药典》(2015 年版)四部通则1148 溶血与凝聚检查法制备2%红细胞悬液,69 批鹿瓜多肽注射剂均按照2 mg/mL 多肽含量制备供试品溶液,同时设置阴性对照组(氯化钠注射液)和阳性对照组(灭菌注射用水)。采用直接观察法(试管内肉眼观察)考察受试物管中的溶液在3 h 内是否发生溶血和凝聚反应,直接观察法结束后,将供试品和对照组均以2 000 r/min 离心5 min,用酶标仪测定上清液在545 nm波长处的吸收度。每管加样3个复孔,求其平均值。按公式[溶血率=(供试品管吸收度-阴性对照管吸收度)/(阳性对照管吸收度-阴性对照管吸收度)×100%]计算溶血率,以溶血率大于5%表示有溶血发生。
2.6 多肽含量测定
多肽含量测定试剂盒基于《中华人民共和国药典》(2015 年版)四部通则0731 蛋白质含量测定第四法(BCA 法)测定原理,对照品贮备液为牛血清白蛋白溶液,用水配制成下列质量浓度标准溶液:500、250、125、62.5、31.25、15.625 和0µg/mL,按试剂盒使用说明书操作并用酶标仪在480 nm 波长处测定吸收度,同时绘制标准曲线。鹿瓜多肽注射剂用水溶解并稀释制成250 µg/mL(以多肽计)的溶液,作为供试品溶液。将供试品溶液的平均吸收度代入上述对照品标准曲线中,计算出供试品溶液的多肽含量。
2.7 生物学活性测定
针对鹿瓜多肽注射剂的抗炎作用,并参考相关文献[7-8],采用CCK-8 法考察鹿瓜多肽注射剂抑制THP-1 细胞增殖的作用,以此评价其生物学活性。取对数生长期的THP-1 细胞,调整细胞浓度,以每孔0.1 mL 接种于96 孔板,在37 ℃、5%CO2条件下培养24 h,然后以每孔0.1 mL 加入不同质量浓度的鹿瓜多肽注射剂受试物溶液,每个浓度设置3 个复孔,同时制备阴性对照组(不加受试物溶液,加入同体积的培养基)和空白组(不加细胞孔)。在37 ℃、5%CO2条件下培养72 h。终止培养前4 h,每孔加入CCK-8 溶液10µL,作用4 h 后,用酶标仪在450 nm 波长处测定吸收度,按公式[抑制率=(阴性对照组平均吸收度-空白吸收度)/(受试物组平均吸收度-空白吸收度)×100%]计算抑制率,以此评价鹿瓜多肽注射剂对THP-1 细胞的增殖抑制作用。
3 结 果
3.1 生物胺的测定
3.1.1 系统适用性和专属性 取空白溶剂、混合对照品溶液(10µg/mL)和供试品溶液分别衍生后进样分析。结果表明,该方法专属性良好,空白溶剂在目标峰出峰位置无干扰,各生物胺色谱峰理论塔板数均大于10 000,各相邻峰的分离度均大于1.5,色谱图见图1。
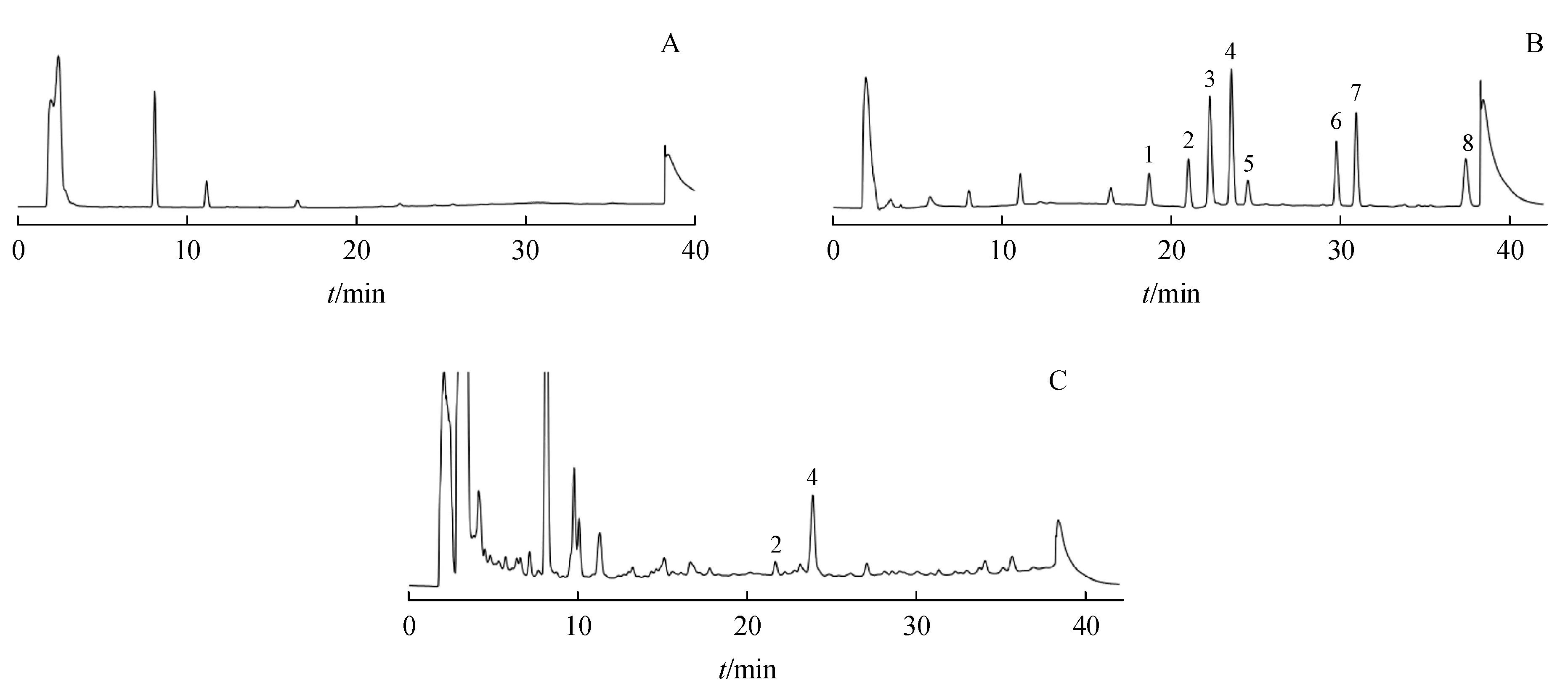
Figure 1 HPLC chromatogram of blank solution(A),reference solution(B)and sample test solution(C)of Cervus and Cucumis polypeptide injection
3.1.2 线性关系、定量限及检测限考察 8 种生物胺均在0.10~50.00 µg/mL 范围内线性关系良好;各生物胺的定量限在0.031~0.112 µg/mL 之间;检测限在0.009~0.034 µg/mL 之间,结果见表1。
3.1.3 回收率试验 结果显示8种生物胺的平均回收率在90.71%~97.88%之间,RSD在0.55%~2.04%之间,均符合《中华人民共和国药典》要求,结果见表1。
3.1.4 精密度试验 结果组胺、色胺、2-苯乙胺、腐胺、酪胺、尸胺、亚精胺、精胺8 种生物胺的衍生物峰面积RSD(n=6,%)分别为0.73、0.21、0.47、0.47、1.01、1.32、0.23、0.81,表明色谱系统精密度良好。
3.1.5 样品检测结果 结果显示,A 企业和C 企业的鹿瓜多肽注射剂检出组胺、2-苯乙胺、腐胺、尸胺等生物胺,但含量均较低(0.004%~0.038%,占多肽标示量的百分比计);而B 企业的10 批鹿瓜多肽注射剂均检出较高浓度的尸胺,范围从0.265%~0.333%。各样品检测结果见表2。
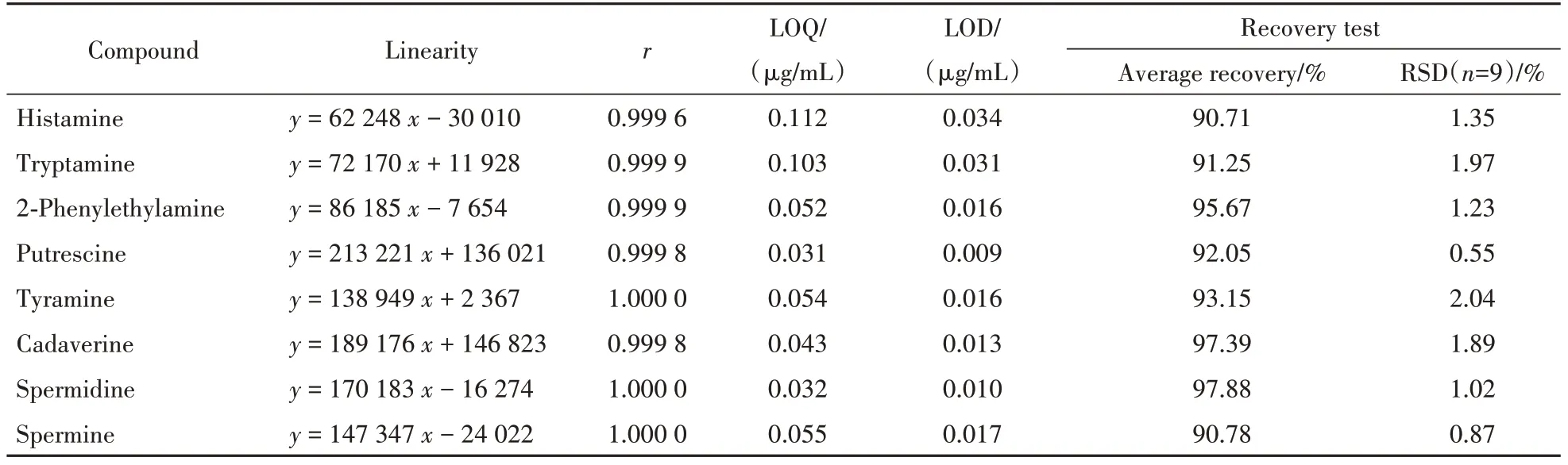
Table 1 Results of methodological validation tests for the content determination of biogenic amines
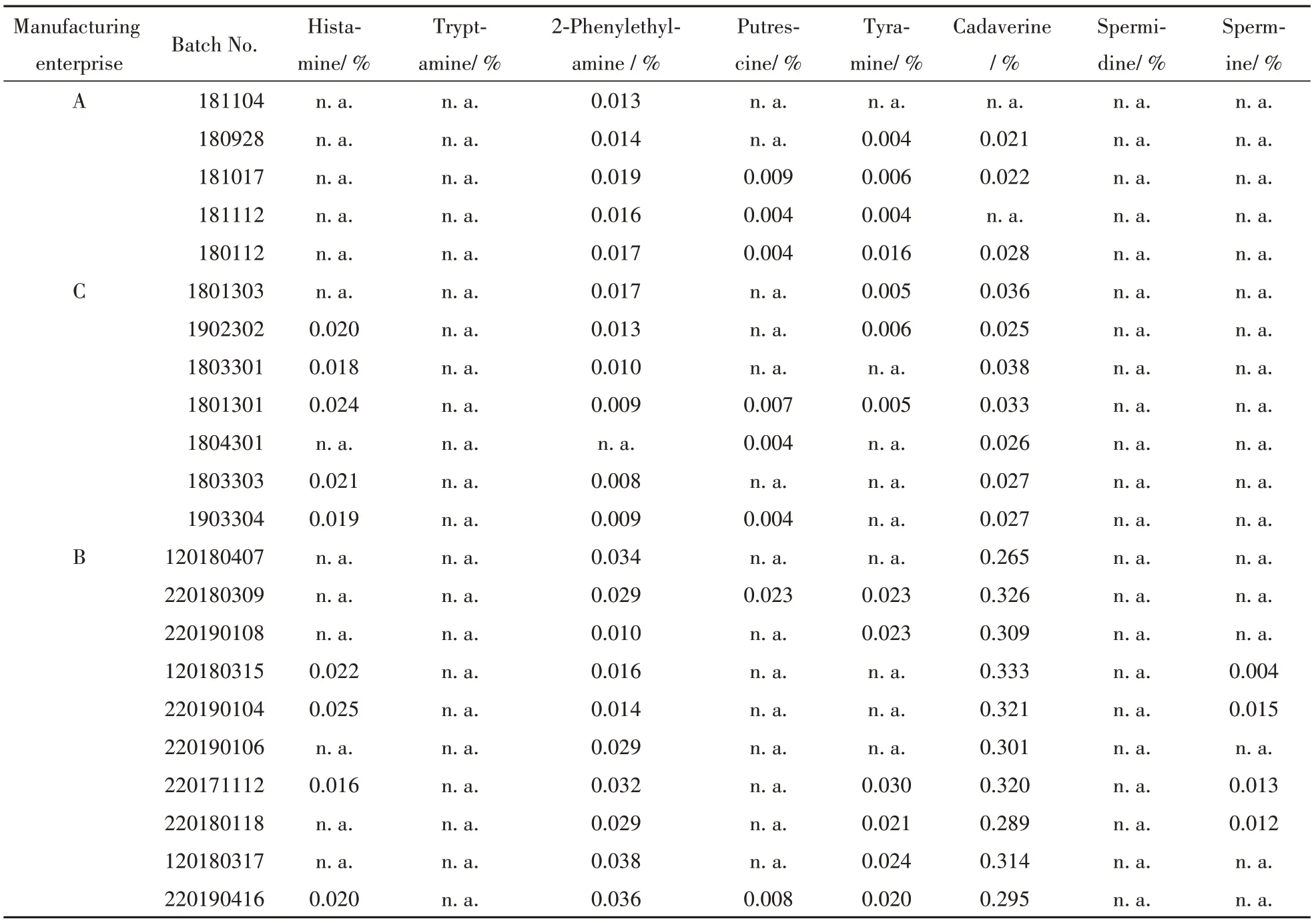
Table 2 Concentration of biogenic amines in 22 batches samples of Cervus and Cucumis polypeptide injection
3.2 黄曲霉毒素的测定
选取3 个企业共30 批鹿瓜多肽注射剂和8 批甜瓜子提取液进行了黄曲霉毒素的测定,结果上述38 批样品均未检出黄曲霉毒素B1、B2、G1和G2(黄曲霉毒素B1、B2、G1、G2的检测限分别为0.012、0.003 4、0.011、0.003 6 ng/mL)。
3.3 甜瓜子原料酸价及过氧化值的测定
通过对两个企业共8批甜瓜子原料进行测定,过氧化值测定结果在0.004~0.014 g/100 g 之间,低于国标GB 19300-2014 的限值0.40 g/100 g。而酸价结果差异较大,在1.92~7.26 mg/g 之间(以KOH 计),其中A 企业批号为20180901 的甜瓜子原料酸价为7.26 mg/g,B 企业批号为1901002和1902003 的甜瓜子原料酸价分别为3.14 和3.06 mg/g,均超过国标GB 19300-2014 的限值3.0 mg/g。
3.4 高相对分子质量物质的考察
凝胶色谱法测定高相对分子质量物质操作简便,但对于成分复杂的多组分生化药并不适用。鹿瓜多肽注射剂色谱流出峰难以有效分离,对积分和定量都造成一定困难(图2),导致测定结果不准确。
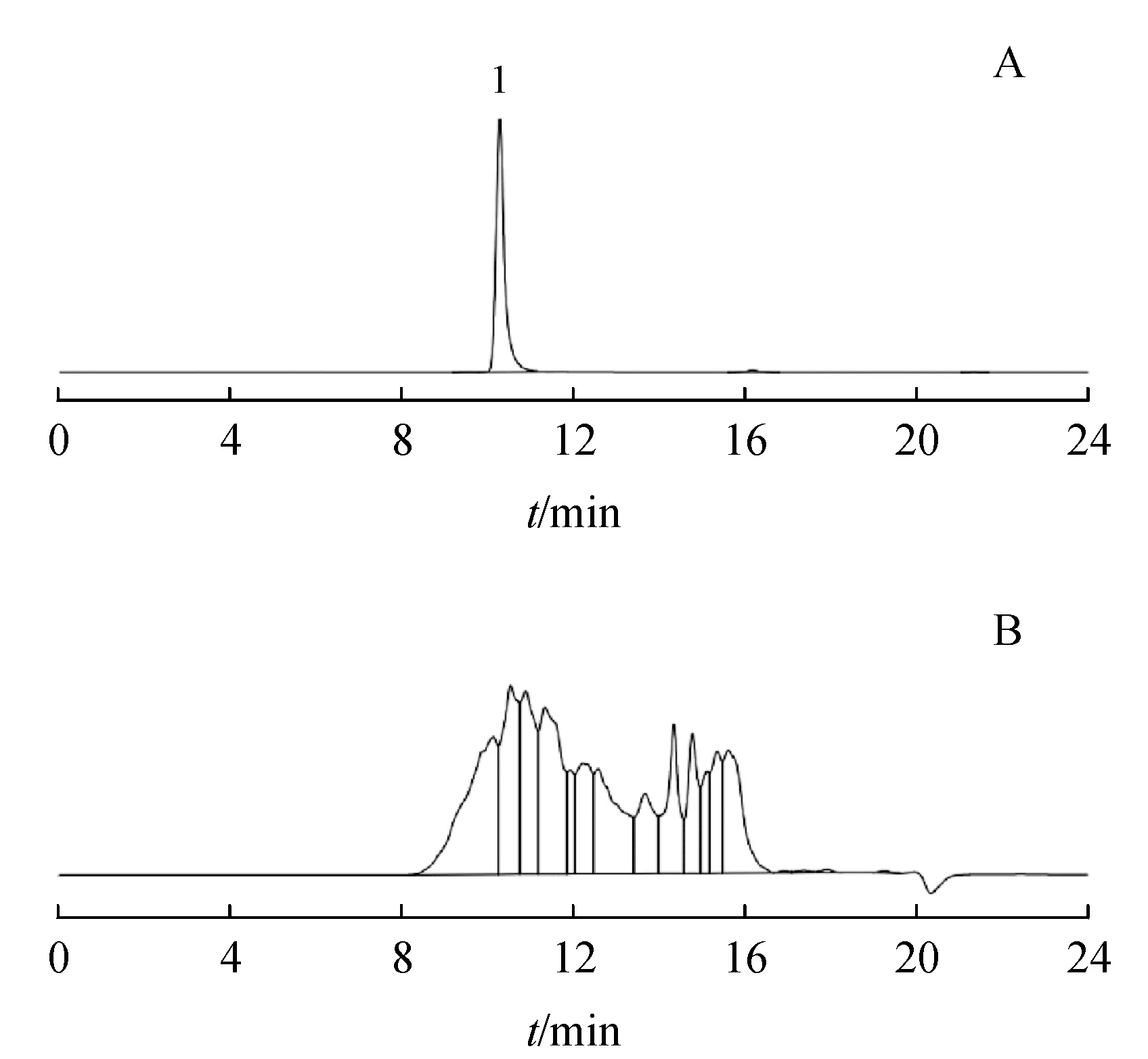
Figure 2 SEC-HPLC chromatogram of reference substance (A, relative molecular weight 5 800) and test sample (B, batch No. 181018) of Cervus and Cucumis polypeptide injection
为了寻找比凝胶色谱法更准确的测定方法,探索性研究尝试了Tricine-SDS-PAGE 电泳(图3)。因A 企业现行标准中暂无高相对分子质量物质检查项,故随机抽取A 企业的10 批样品进行高相对分子质量物质的测定,测定结果见表3。以对照品溶液1~5 的蛋白含量为横坐标,以扫描灰度值为纵坐标进行线性回归,相关系数r值均大于0.98;10 批鹿瓜多肽注射剂样品高相对分子质量物质含量平均值为16.36%。另经测定,B、C 企业的高相对分子质量物质含量均低于2.0%。综上,提示A企业应进一步改进超滤工艺,降低高相对分子质量物质的含量,从而提高产品的安全性。

Figure 3 Tricine-SDS-PAGE gel electrophotogram of high molecular weight substance of Cervus and Cucumis Polypeptide Injection (batch No. 181018)
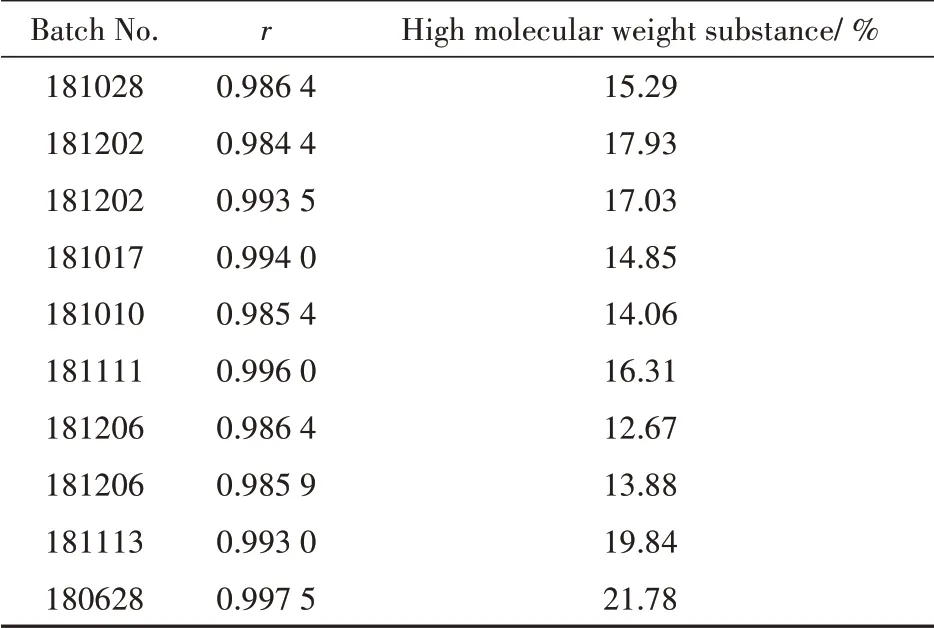
Table 3 Results of high molecular weight substance of Cervus and Cucumis polypeptide injection by Tricine-SDS-PAGE
3.5 溶血与凝聚测定
实验结果表明,所有批次供试品溶液和阴性对照管均无溶血与凝聚现象;经酶标仪测定并计算溶血率,结果所有供试品溶液溶血率均在5%以下,表明本品无体外溶血作用。
3.6 多肽含量测定
试剂盒法测定多肽含量的方法学验证结果显示,多肽在15.63~1 000 µg/mL 的质量浓度范围内与吸收度呈良好的线性关系;平均加样回收率为99.4%,RSD 为3.0%(n=9);最低检测限为15.63µg/mL。
按法定标准福林酚法检验全部69 批次样品,结果多肽含量合格率为100%。但由于现行标准只规定了含量测定值的下限而未设定上限,不符合药品质量控制要求。拟将含量限度统一修订为“含多肽以牛血清白蛋白计,应为标示量的80%~120%”。按照修订后的限度规定,用福林酚法和试剂盒法测定69 批样品的合格率分别为84.1%和81.2%,其中不合格样品均是含量超上限(图4)。
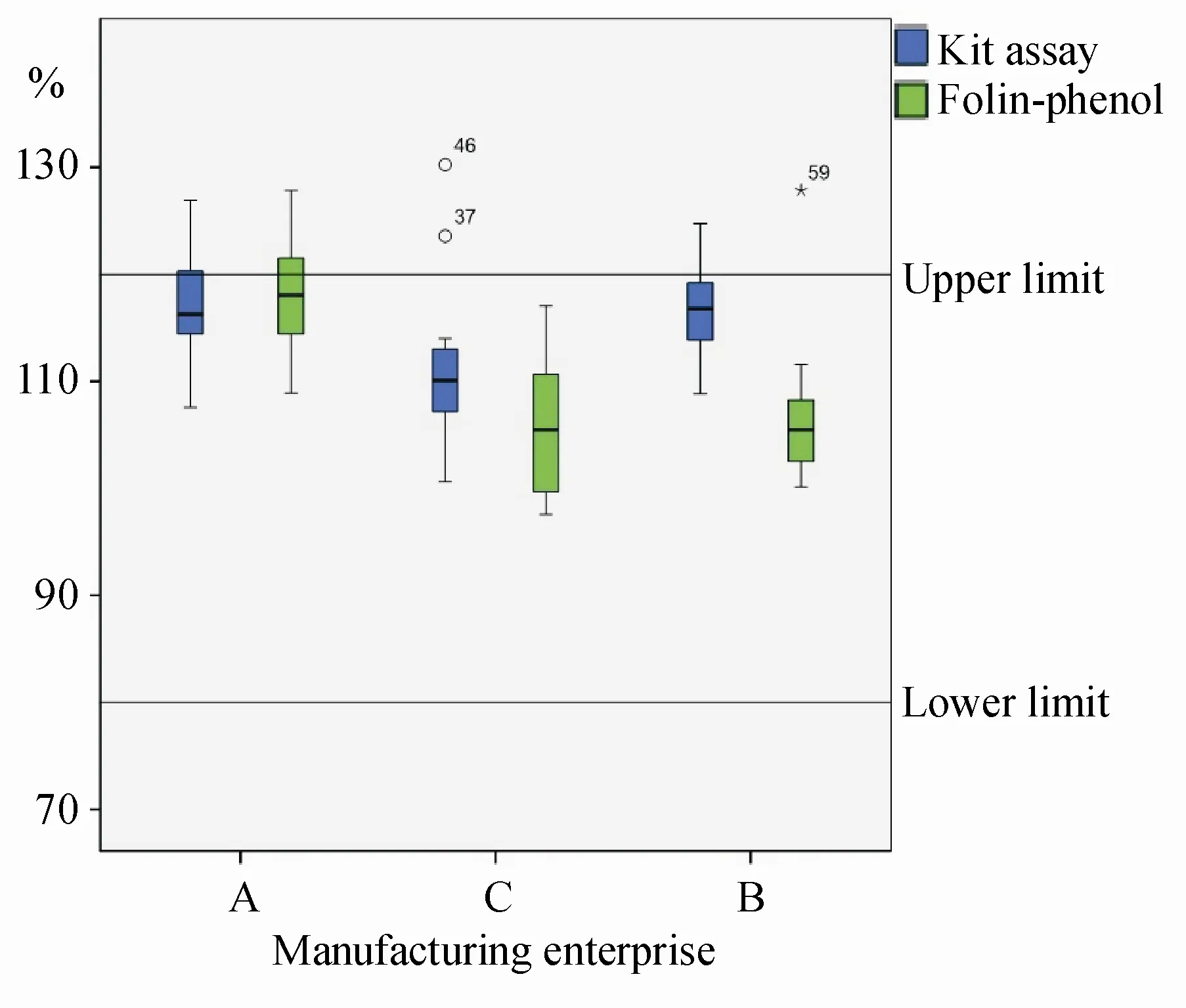
Figure 4 Results of peptide content determination of Cervus and Cucumis polypeptide injection
3.7 生物学活性测定
3.7.1 方法的建立 配制质量浓度为0.125,0.25,0.5,1,2,4 mg/mL 的鹿瓜多肽注射剂受试物溶液,与THP-1 细胞共同孵育24、48、72 h 后测定吸收度。结果显示,同浓度下受试物溶液随着作用时间的延长,对THP-1 细胞的抑制作用逐渐增大;在同一作用时间下,随着受试物溶液浓度的增加,对THP-1 细胞的抑制作用亦逐渐增大。鹿瓜多肽注射剂受试物均表现出明显的量效和时效关系,最终选用质量浓度为2 mg/mL、作用时间为72 h 对随机24 批样品的细胞增殖抑制效果进行比较。
3.7.2 样品测定结果 经探索性研究,在本实验条件下,A 企业样品的抑制指数为9.6~16.8,批次之间最大差异为4.5%;B 企业样品的抑制指数为2.4~3.4,批次之间最大差异为11.6%;C 企业样品的抑制指数为1.4~1.9,批次之间最大差异为17.7%。3 个企业样品在相同条件下,体外抗炎效果有一定的差异。A 企业鹿瓜多肽注射剂对THP-1 细胞的抑制作用明显优于B、C企业。
4 讨 论
4.1 与安全性相关的检测项目
4.1.1 生物胺 B 企业鹿瓜多肽注射剂中检出高浓度的尸胺,经查阅相关文献[9-11],尸胺具有致突变性,其致癌性证据尚不充分。参考人用药品注册技术要求国际协调会(ICH)M7 及欧洲药物管理局(EMEA)发布的《遗传毒性杂质限度指导原则》相关规定,尸胺的含量限度可以参照2类遗传毒性杂质(致癌性未知的已知致突变性物质)来控制。按照毒理学关注阈值(TTC)作为评价2 类遗传毒性杂质的限度要求,经计算得知,鹿瓜多肽注射剂中含尸胺不得过0.04%[12-13]。因此,B 企业的鹿瓜多肽注射剂中尸胺含量均超过限度,提示该类动植物来源的多组分生化药在原料及中间提取液的新鲜度方面应给予重视。
4.1.2 其他安全性相关指标 经测定,鹿瓜多肽成品制剂及中间提取液中均未检出黄曲霉毒素残留,说明终产品尚不存在黄曲霉毒素污染的风险。但现场调研时发现甜瓜子的霉变现象,可能在提取纯化工艺中黄曲霉毒素被去除,或是霉变情况可能来源于其他真菌污染,如赭曲霉、青霉、镰刀霉等,因现场调研时未能及时留样,无从考证霉变的来源,未来将继续筛查其他真菌毒素的污染情况,进一步提升本品的安全性。
3 家生产企业都有固定的甜瓜子供应商,并对甜瓜子进行自检,但其内控标准均未对酸价及过氧化值有要求。酸价和过氧化值在一定程度上可体现甜瓜子的新鲜程度[14-15],因此有必要限量控制。甜瓜子属于易虫蛀、霉变、酸败的原料,放置温度、湿度等都会对其品质有所影响。调研结果显示个别企业会一次性购入大量同一批次的甜瓜子原料以备库存,但是随着时间的延长,甜瓜子发生酸败的概率也会随之加大。因此,建议生产企业加强对甜瓜子原料的内控标准制订,增加真菌毒素、酸价和过氧化值检查项,并关注储存条件与期限是否会对甜瓜子的品质造成影响。
4.2 与有效性相关的检测项目
4.2.1 多肽含量测定 鹿瓜多肽注射剂现行标准均采用福林酚法测定多肽含量,对该法产生干扰的物质较多,辅料右旋糖酐40 和甘露醇在测定时均产生一定吸收度,导致结果不准确[16]。而经试剂盒法测定,辅料甘露醇对测定结果无影响;右旋糖酐40 会产生轻微干扰,导致测定结果偏高。因此,无论是福林酚法还是试剂盒法,在计算含量时均应扣除辅料对结果的贡献,而试剂盒法相对于福林酚法干扰物质较少,重复性、专属性更强。此外,由于试剂盒法无需配制反应试剂,且比福林酚法操作步骤少,同时采用96 孔板并通过酶标仪实现高通量检测,尤其适用于大批量样品的快速测定。
4.2.2 生物学活性 临床上,多组分生化药起作用多为若干种机制协同作用的结果。鹿瓜多肽注射剂的作用机制主要包括促骨细胞增殖和抗炎活性两方面,有研究报道了基于骨细胞株的鹿瓜多肽注射剂体外活性的测定方法,该法选用大鼠骨肉瘤UMR106细胞株,考察样品对细胞的增殖刺激作用,针对鹿瓜多肽注射剂促骨细胞增殖的作用机制来建立细胞试验模型[17]。而本研究建立的方法选用单核巨噬细胞THP-1 作为试验模型,考察样品对细胞的增殖抑制作用,针对其抗炎活性用于评价生物学活性,与其治疗类风湿关节炎的临床适应证一致,因此可以更为直观地反映出药品的效应及质量,且抑制作用明显,操作简便,为该类产品质量控制提供了实验依据。
5 总 结
本研究从生物胺的含量、黄曲霉毒素测定以及甜瓜子原料的酸价、过氧化值的考察等多角度评价了鹿瓜多肽注射剂的新鲜度,并改进了质量标准中高相对分子质量物质和多肽含量测定的方法,同时对建议增订项目溶血与凝聚、生物学活性的测定做了初步探索。通过上述工作,可以为鹿瓜多肽注射剂质量标准的完善提供理论依据,并为该类多组分生化药安全性的提升奠定基础。
