透明质酸修饰天冬酰胺酶自组装仿生纳米囊的稳定性及其体内药代动力学
2020-09-14刘煜莹李开铃张景勍
刘煜莹,李 瑶,杨 强,陈 冉,李开铃,张景勍*
(1重庆医科大学重庆药物高校工程研究中心,重庆400016;2重庆市公共卫生医疗救治中心,重庆400036)
天冬酰胺酶(asparaginase,Asp)是临床用于治疗淋巴细胞白血病的一线化疗药物[1]。Asp 能将细胞内的门冬酰胺分解为门冬氨酸和氨,使肿瘤细胞因缺少生长所必要的门冬酰胺而引起蛋白质合成障碍,最终导致肿瘤细胞凋亡[2]。大量的临床研究显示,Asp 能显著改善急性淋巴细胞白血病的预后,对提高急性淋巴细胞白血病的完全缓解率及长期无事件生存率等方面有显著贡献[3]。但是,Asp 存在蛋白质类药物固有缺陷如活性低、半衰期短和易产生耐药性[4],且有研究表明Asp 在体内有一定的不良反应[5],直接限制了其在临床上的广泛应用。
为了延长Asp在大鼠体内的滞留时间,研究人员采用葡聚糖/聚精氨酸层的CaCO3纳米粒装载Asp[6],田明达等[7]用壳聚糖和油酸钠修饰的超顺磁性四氧化三铁纳米粒子装载Asp,Ashrafi 等[8]用一种新型脂肪酸与Asp 进行生物接合,Chien 等[9]对Asp 进行PEG 化修饰等,这些针对Asp 剂型的改造在一定程度上阻断了蛋白酶对Asp 分解以及温度对Asp 活性的影响,但是仍未解决Asp 免疫原性高、生物相容性低和体内循环时间短等不足。因此构建一个既能提高Asp体内稳定性,同时又能提高其生物相容性及生物利用度的递送系统十分必要。透明质酸具有靶向性,可以和肿瘤细胞中的CD44 受体结合[10]。自组装纳米系统载药量大,制备简单[11]。
为了提高Asp体内活性和生物利用度,本研究首次制备了透明质酸(HA)修饰Asp 自组装仿生纳米囊(hyaluronic acid-modified asparaginase self-assembled bionic nanocapsules,ASNCs)。首 先 将PEG2000 与HA 分子偶联形成两亲性的HA-g-PEG,该两亲性HA-g-PEG 与羟丙基-β-环糊精能自组装形成仿生膜,同时将Asp 固定在仿生膜中,然后再一起包封于脂质纳米囊中。本实验对ASNCs的体外抗胰蛋白酶水解稳定性和体内药代动力学行为进行了考察,以期为大分子药物的临床研究提供依据。
1 材 料
1.1 试 剂
天冬酰胺酶(Asp,纯度:96%,批号:312PLASP 1,以色列Prospec 公司);天冬酰胺、胆固醇(美国Sigma 公司);磷脂(纯度:100%,德国Lipoid 公司);羟丙基-β-环糊精(HPCD,纯度:98%,南京都莱生物技术有限公司);三羟甲基氨基甲烷(Tris)、考马斯亮蓝G-250(国药集团化学试剂有限公司);HAg-PEG(实验室自制[12]);其他试剂均为市售分析纯。
1.2 仪 器
85-2 型恒温磁力搅拌器(上海司乐仪器有限公司);RE-52AA 旋转蒸发器(上海亚荣生化仪器厂);pH 计(上海精密科学仪器有限公司);UV-7504 PC 紫外分光光度计(上海欣茂仪器有限公司)。
1.3 动 物
雄性SPF 级SD 大鼠,体重(200±20)g。由重庆医科大学实验动物中心提供,许可证号为SYXK(渝)2016-0001,所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 ASNCs的制备及形态考察
按照处方量精确称取胆固醇和磷脂(物质的量比为1∶3)放置于圆底烧瓶中,加入二氯甲烷15 mL 使之溶解,于黑暗处放置30 min。将圆底烧瓶放置于旋转蒸发仪上,30 ℃减压旋蒸至形成均匀的薄膜,加入乙醚15 mL 摇晃脱膜。将HA-g-PEG 溶液(质量分数为1.0%)2 mL 缓慢加入至HPCD 饱和溶液(质量分数为6%)6 mL 中形成的HA-g-PEG/HPCD 溶液,精密称取处方量Asp 1 mg溶解于HA-g-PEG/HPCD 溶液中,然后加入到上述圆底烧瓶中,使用水浴型超声仪超声,直至形成均匀带乳光的分散体系。将圆底烧瓶转移至旋蒸仪,30 ℃减压蒸发,至形成凝胶状塌陷为均匀液体,取出液体加入至10 mL 量瓶用pH 7.3 的Tris-HCl 缓冲液定容,即得ASNCs。用pH 7.3 的Tris-HCl 缓冲液将ASNCs 稀释10 倍后,于透射电镜下观察ASNCs 的外观形态,马尔文激光粒度仪测定ASNCs的粒径和电位。
2.2 活性测定
Asp 的活性采用奈斯试剂法[13]进行测定。实验前,将底物天冬酰胺溶液预热2 min,在底物天冬酰胺溶液中加入Asp 溶液0.1 mL,置于37 ℃水浴锅中反应10 min,即刻加入三氯醋酸溶液0.1 mL以终止反应,离心后取出上清液,取奈斯勒指示剂和适量蒸馏水加至上清液中,放置10 min 后,于480 nm处测定吸收度。
2.3 抗胰蛋白酶水解稳定性
将Asp 和ASNCs 溶液分别与等量胰蛋白酶溶液混合,在37 ℃条件下孵育,于一系列时间点0,10,20,30,40,50,60 min时分别取出,按照“2.2”项下方法测定游离Asp和ASNCs中Asp的活性。
2.4 药代动力学考察
取12只雄性SD大鼠,随机分成2组,禁食24 h后,尾静脉分别注射游离Asp 和ASNCs(给药剂量以Asp 计为2 U/g)。在给药后0.08,0.17,0.25,0.50,0.75,1,1.5,2,3,4,6,8,10,12,24,48 h眼静脉取血。采血(约0.3 mL)注入肝素化的试管,4 000 r/min 离心10 min 后分离血浆样品,于-20 ℃保存待测定。DAS软件分析处理数据,比较Asp和ASNCs 之间药代动力学行为和生物利用度的差异。
2.5 统计学处理方法
游离Asp 和ASNCs 稳定性数据通过SPSS 软件进行双向单侧t检验,P<0.05 认为差异有统计学意义。
3 结 果
3.1 ASNCs的微观形态
如图1所示,透射电镜下观察到的ASNCs呈均匀分布的圆形或椭圆形。
3.2 粒径和Zeta电位
经测定,ASNCs 粒径为(99.17±0.21)nm,Zeta 电位为-(13.13± 0.60)mV,表明ASNCs 的粒径适中且性质稳定(n=3)。
3.3 抗胰蛋白酶水解稳定性
如图2 所示,Asp 和ASNCs 在与胰蛋白酶接触后,活性均受到较大影响,但与ASNCs 相比,游离Asp 受胰蛋白酶水解影响更大。在胰蛋白酶存在的外环境中,游离Asp 活性下降迅速,降至仅存50%活性所需时间约为15 min,而ASNCs 活性降至50%所需时间大约为35 min,40 min时已无法检测到Asp 活性,但此时ASNCs 仍保持着34%的活性。这表明,ASNCs 较游离Asp 有更好地抗胰蛋白酶水解的能力,更高的稳定性。

Figure 1 Transmission electron microscopy image of hyaluronic acidmodified asparaginase self-assembled bionic nanocapsules(ASNCs)
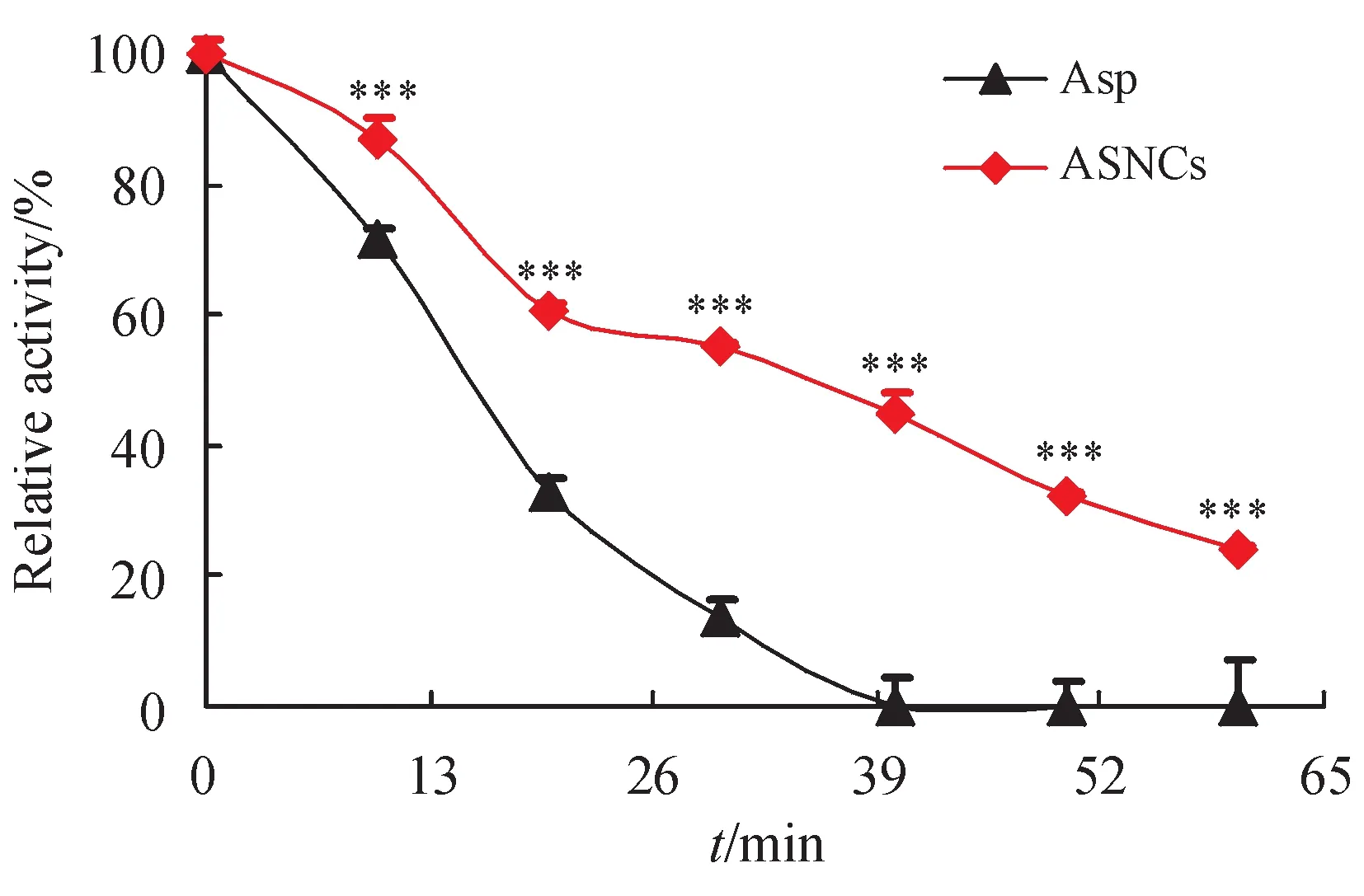
Figure 2 Proteolytic stabilities of remaining activity of free asparaginase(Asp)and ASNCs(-x ± s,n = 3)
3.4 ASNCs药代动力学行为
静脉注射游离Asp 和ASNCs 后,大鼠体内药物活性-时间曲线关系图见图3。在静脉注射后,游离Asp和ASNCs活性整体呈下降趋势,且ASNCs活性始终高于游离Asp。在12 h 时,游离Asp 活性几乎为零,而此时ASNCs 活性为(1.46±0.375)U/mL,ASNCs 持续到48 h 才完全失活。这些结果证实了ASNCs能延长Asp在体内的循环时间。
经过DAS 软件计算得到,游离Asp 和ASNCs主要的药代动力学参数见表1(非房室模型)和表2(房室模型)。分析非房室模型主要药代动力学参数 可 看 出,ASNCs 与 游 离Asp 相 比,AUC0-48h和AUC0-∞分别增加了44.72.32 和47.82 U·h/mL,表明静注后吸收增加;MRT0-48h和MRT0-∞分别增加了2.32 和2.71 h,同时ASNCs 的CL 降低为游离Asp的40%,表明ASNCs 体内的滞留时间增加。并且ASNCs 的cmax为Asp 的1.3 倍,说明ASNCs 的活性更强。各项参数均表明ASNCs 在体内的药代动力学行为优于Asp。
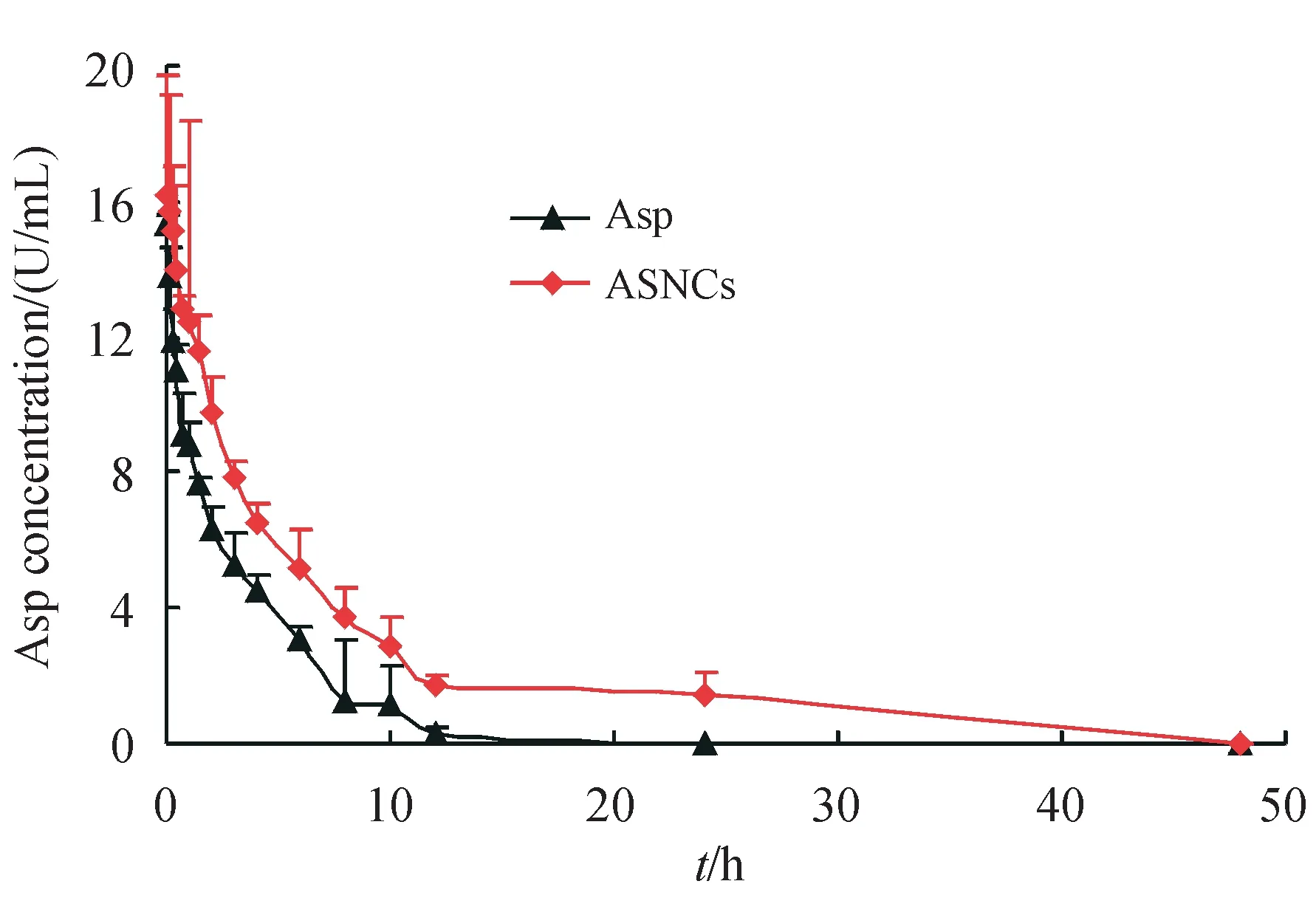
Figure 3 Activity-time curves of free Asp and ASNCs(-x ± s,n = 6)
Table 1 Non-compartment model pharmacokinetic parameters of Asp and ASNCs( ± s,n=3)
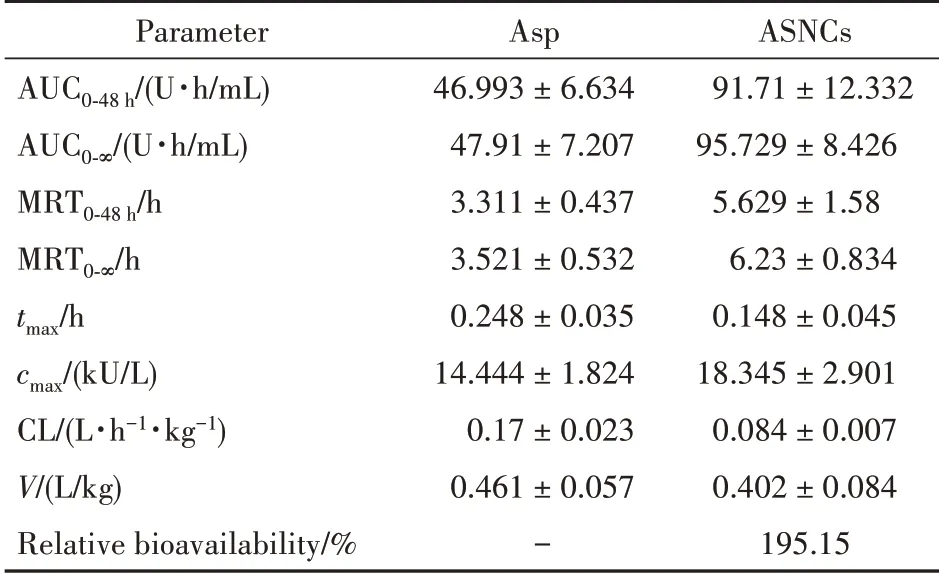
Table 1 Non-compartment model pharmacokinetic parameters of Asp and ASNCs( ± s,n=3)
Parameter AUC0-48 h/(U·h/mL)AUC0-∞/(U·h/mL)MRT0-48 h/h MRT0-∞/h tmax/h cmax/(kU/L)CL/(L·h-1·kg-1)V/(L/kg)Relative bioavailability/%Asp 46.993±6.634 47.91±7.207 3.311±0.437 3.521±0.532 0.248±0.035 14.444±1.824 0.17±0.023 0.461±0.057-ASNCs 91.71±12.332 95.729±8.426 5.629±1.58 6.23±0.834 0.148±0.045 18.345±2.901 0.084±0.007 0.402±0.084 195.15
室模型参数见表2,分析其主要药代动力学参数 可 看 出,游 离Asp 和ASNCs 相 比,AUC0-48h和AUC0-∞分别增加了53.62.87 和U·h/mL,表明静注后吸收增加;t1/2增加了2.31 h,ASNCs的CL降低为游离Asp 的49%,表明药物在体内停留时间增加。各项参数均表明ASNCs 在体内的药代动力学行为优于Asp。
分析非房室模型和房室模型主要药代动力学参数可看出,游离Asp 和ASNCs 相比,AUC0-48h和AUC0-∞均有明显增加,CL 均大幅降低,从AUC0-48h的比较看出,与Asp 相比,ASNCs 的相对生物利用度约为195.15%(非房室模型)或213.54%(房室模型)。非房室模型和房室模型得出的结果一致。用两种模型分析得到的结果可知,ASNCs 提高了Asp 的体内活性,降低了清除率,延长了滞留时间,从而提高了Asp的生物利用度。
Table 2 Compartment model pharmacokinetic parameters of Asp and ASNCs( ± s,n=6)
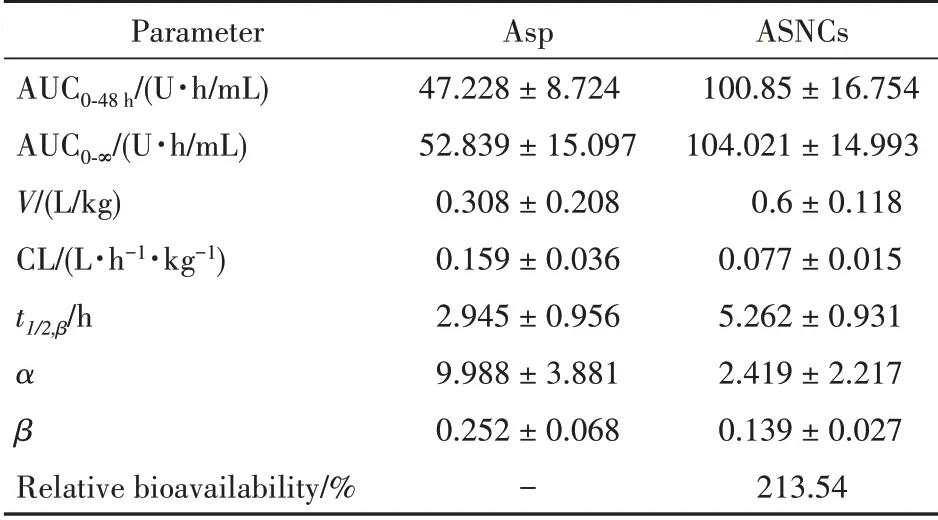
Table 2 Compartment model pharmacokinetic parameters of Asp and ASNCs( ± s,n=6)
Parameter AUC0-48 h/(U·h/mL)AUC0-∞/(U·h/mL)V/(L/kg)CL/(L·h-1·kg-1)t1/2,β/h α β Relative bioavailability/%Asp 47.228±8.724 52.839±15.097 0.308±0.208 0.159±0.036 2.945±0.956 9.988±3.881 0.252±0.068-ASNCs 100.85±16.754 104.021±14.993 0.6±0.118 0.077±0.015 5.262±0.931 2.419±2.217 0.139±0.027 213.54
4 讨 论
自组装纳米系统载药量大,制备简单[11],是大分子药物的理想载体。本研究首先将抗肿瘤酶Asp 包封于自组装仿生脂质纳米囊中,并考察了ASNCs 的微观形态、体外抗胰蛋白酶水解稳定性和体内药代动力学。从抗胰蛋白酶水解稳定性结果上看,ASNCs 具有比Asp 更高的活性,分析可能原因与包封于脂质纳米粒中的尿酸酶稳定性提高原因类似:蛋白质类药物稳定性改变与空间结构如螺旋结构和三级结构变化有关[14],自组装仿生脂质纳米囊能保护Asp的空间结构,使其构象不会因为外界条件变化而改变[15]。大鼠体内药代动力学行为显示,ASNCs相对生物利用度为游离Asp的2 倍左右,ASNCs 在大鼠体内的AUC0-48h和cmax均较Asp 高,说明将Asp 制备成ASNCs 后确实可以提高酶在大鼠体内的相对生物利用度,缓释效果明显。同时,与黄永佳等[2]制备的Asp 核壳型纳米粒相比(AUC0-48h为86.06 U·h/mL),ASNCs 的AUC0-48h提高了5.65 U·h/mL,说明ASNCs 具有更高的生物利用度。分析该纳米粒能提高Asp 生物利用度的可能原因一是经过透明质酸修饰后的纳米囊生物相容性更高,避免了Asp在体内由于免疫原性高失活的问题;二是纳米囊能有效封装Asp,在进入血液后,外界血液中的代谢酶对Asp 的影响减小,从而达到长效和高效的目的;再者纳米囊能维持Asp的构象,提高其稳定性和活性。
综上,本研究制备的透明质酸修饰的自组装仿生纳米囊,提高了Asp 的稳定性和生物利用度,缓释效果明显,同时透明质酸具有靶向肿瘤细胞表面受体CD44 的优点,磷脂和胆固醇作为内源性物质具有良好的生物相容性。因此,本实验为构建生物相容性、靶向肿瘤细胞的Asp递送系统提供了思路与方法,为Asp递送系统的进一步研究与应用奠定了理论基础。
