钛酸锂废料回收制备电池级碳酸锂的工艺研究①
2020-09-14刘雯雯文小强郭春平周有池陈燕飞肖颖奕
刘雯雯, 文小强, 郭春平, 周有池, 陈燕飞, 张 帆, 肖颖奕
(赣州有色冶金研究所,江西 赣州341000)
2010 年新能源汽车开始兴起,直到2014 年电动汽车行业迎来井喷式发展[1]。 锂电池被广泛应用于电动车行业[2-3],目前电动汽车用锂电池的平均使用寿命只有3~5 年[4],随着新能源汽车产销量猛增,动力电池退役高峰亦随之而来。 废旧锂电池电解液中含有的氟化物被人体吸收后可能致癌[5-6]。 废旧锂电池在高温下分解可能引发爆炸,并且对环境产生极大危害。 从环保角度出发,回收废弃锂离子电池中的贵重金属,消除有害物质十分有必要。 目前回收废旧锂离子电池的研究主要集中在磷酸铁锂、镍钴锰三元材料、钴酸锂等锂离子电池正极材料,对回收钛酸锂电池的研究还鲜见报道[7-13]。 本文以钛酸锂废料为原料,对有价金属锂和钛分离回收,制备高附加值的碳酸锂和二氧化钛产品,工艺流程简单,回收率高。
1 实 验
1.1 实验原料及试剂
实验原料为购买的某公司回收的钛酸锂废料。 其具体成分见表1。
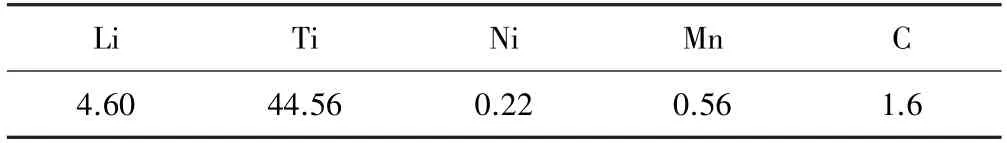
表1 钛酸锂废料成分(质量分数)/%
实验所用试剂包括硫酸、氢氧化钠、碳酸钠、氢氧化钙、磷酸三钠等,均为分析纯试剂。
1.2 实验仪器及方法
实验仪器:LEAD-1 型蠕动泵、HH-S 型水浴加热锅、JJ 型精密电动搅拌器、DZ-1BCII 型真空干燥箱、ES-6KCC 型电子天平等。
实验方法:采用硫酸体系综合回收钛酸锂废料中的有价金属锂和钛,钛酸锂废料经过预处理后采用稀硫酸进行酸浸提锂,浸出液经除杂后得到净化液,再用精制Na2CO3溶液沉Li2CO3,浸出渣通过固相烧结法制备TiO2,沉锂尾液用精制的Na3PO4溶液收集剩余金属锂得到Li3PO4副产物。 实验流程见图1。

图1 实验流程
2 实验结果与讨论
2.1 酸浸过程
2.1.1 硫酸浓度对锂浸出率的影响
取100 g 原料进行酸浸实验,控制反应温度95 ℃、反应时间2 h、液固比3 ∶1,硫酸浓度对钛酸锂中锂浸出率的影响如图2 所示。

图2 硫酸浓度对锂浸出率的影响
从图2 看出,锂浸出率随着硫酸浓度增加先升高后降低,当硫酸浓度为1.5 mol/L 时,锂浸出率达到最高96.80%。 有研究表明,酸浸过程中的硫酸浓度不仅影响化学反应速率,还影响反应扩散速率。 硫酸浓度过低时,溶液中的溶解钛会发生水解反应从而形成胶状二氧化钛;硫酸浓度过高时,则会出现因酸黏度过大而降低浸出效率的现象[14]。 因为锂主要在滤液中收集,并考虑后续工序及成本,硫酸浓度选取1.5 mol/L为宜。
2.1.2 液固比对锂浸出率的影响
硫酸浓度1.5 mol/L,其他条件不变,液固比对钛酸锂中锂浸出率的影响如图3 所示。

图3 液固比对锂浸出率的影响
由图3 可知,锂浸出率随着液固比升高先增大后减小。 这是因为液固比较小时,不能完全溶解反应物,固相和液相接触不充分,转化反应不彻底,导致锂浸出率较低;同时,液固比较小时,浸出的锂易被浸出渣带走,导致浸出液中锂含量减少,从而降低锂浸出率。 当液固比为3 ∶1时,锂浸出率达到最高96.51%。 继续加大液固比,锂浸出率略有降低,同时考虑到洗水的因素,选取液固比为3 ∶1。
2.1.3 反应时间对锂浸出率的影响
液固比3 ∶1,其他条件不变,反应时间对钛酸锂中锂浸出率的影响如图4 所示。

图4 反应时间对锂浸出率的影响
从图4 看出,锂浸出率随着反应时间延长而逐渐提高。 反应时间小于2 h 时,浸出率随反应时间延长而增加;反应时间大于2 h 后,锂浸出率增速放缓,酸浸反应达到平衡。 考虑到后续工序和成本因素,选取反应时间为2 h。
2.2 除杂过程
沉锂前,先对浸出液调碱,除去其他金属杂质,浸出渣水洗后烘干,采用固相烧结法可制得二氧化钛产品。 具体工艺方法,本文暂不做分析讨论。
2.3 沉锂过程
2.3.1 锂离子浓度对碳酸锂产品的影响
量取500 mL 不同锂离子浓度的二次净化液,并分别加入到浓度为300 g/L 的精制碳酸钠溶液中搅拌反应40 min,反应温度95 ℃,考察锂离子浓度对Li2CO3产品收率及纯度的影响,结果见图5。

图5 锂离子浓度对碳酸锂产品收率及纯度的影响
由图5 可知,Li2CO3收率随着锂离子浓度增加而升高。 锂离子浓度小于27 g/L 时,Li2CO3收率随锂离子浓度增加而快速增大,但锂离子浓度大于27 g/L时,Li2CO3收率增速放缓。 这主要是Li2CO3具有一定的溶解度,锂离子浓度较低时,Li2CO3大部分溶解在水中,溶度积较小,导致沉锂效果不佳。
Li2CO3纯度随着锂离子浓度增加先升高后降低。这主要是随着溶液中锂离子浓度升高,溶度积逐渐增加,促进反应向沉锂方向进行,当超过一定锂离子浓度范围后,生成的Li2CO3产品可能与加入的钠盐形成过饱和溶液,钠盐附着在沉淀物上,使得Li2CO3产品纯度下降。
综合考虑Li2CO3纯度和收率的效果,选取锂离子浓度为27 g/L。 此时Li2CO3收率达到85.70%,纯度可达99.34%。
2.3.2 碳酸钠添加量对碳酸锂产品的影响
以精制Na2CO3溶液为底液,对其缓慢加入Li+浓度为27 g/L 的二次净化锂液,并在95 ℃下反应40 min,考察碳酸钠添加量(理论用量的倍数)对Li2CO3收率及纯度的影响,结果见图6。
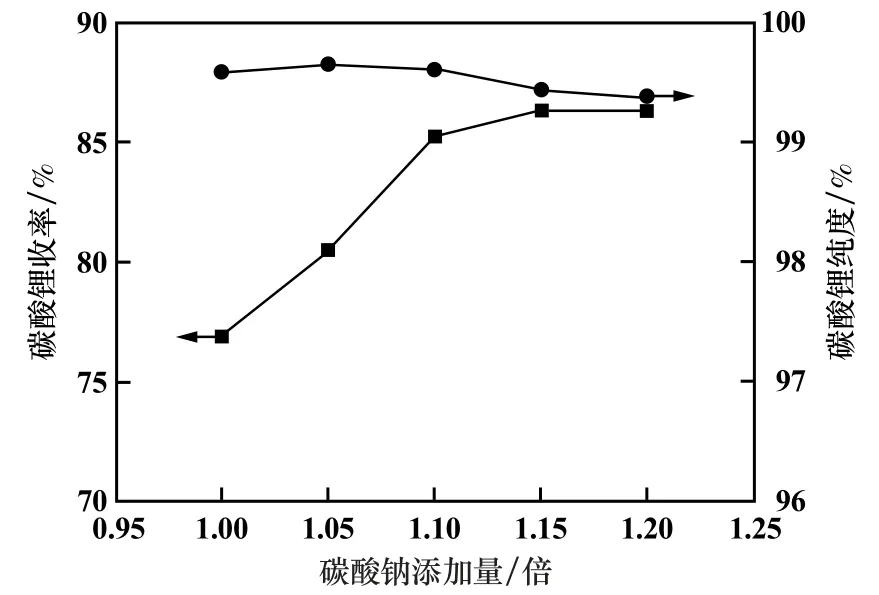
图6 碳酸钠添加量对碳酸锂产品收率及纯度的影响
由图6 可知,Li2CO3收率随着Na2CO3添加量增加而升高,Na2CO3添加量小于1.10 倍时,Li2CO3收率增幅较快,Na2CO3添加量大于1.15 倍时,Li2CO3收率增幅趋于平缓。 Li2CO3纯度随着Na2CO3添加量增加先增大后减小,当Na2CO3添加量为理论量的1.05 ~1.10 倍时,Li2CO3纯度超过99.5%,继续添加Na2CO3,Li2CO3纯度略有下降。 这主要是由于Na2CO3添加量较少时,碳酸根离子不足,使得溶液中锂离子不能反应完全,导致Li2CO3收率偏低。 当Na2CO3添加量高于理论量的1.10 倍时,继续添加Na2CO3,导致Na+浓度过高,钠盐夹杂在析出的Li2CO3内或吸附于生成的Li2CO3产品表面上,导致Li2CO3产品纯度降低。 综合考虑Li2CO3收率、纯度以及成本,选择Na2CO3添加量为理论量的1.10 倍。
2.3.3 反应温度对碳酸锂产品的影响
溶液Li+浓度27 g/L、Na2CO3用量为理论量的1.10 倍、反应时间40 min,反应温度对Li2CO3产品收率及纯度的影响如图7 所示。

图7 反应温度对碳酸锂产品收率及纯度的影响
从图7 看出,Li2CO3纯度和收率均随着反应温度升高而提高。 沉锂反应是一个吸热反应,升高温度有利于促进沉锂反应的进行;同时Li2CO3的溶解度具有负的温度系数,而其他杂质离子的溶解度具有正的温度系数,易随温度升高而溶于水溶液中,因此,高温有助于Li2CO3纯度和收率的提升。 综合考虑Li2CO3纯度、收率以及成本,选择反应温度为95 ℃,此时Li2CO3纯度和收率分别达到99.61%和85.23%。
2.3.4 反应时间对碳酸锂产品的影响
溶液Li+浓度27 g/L、Na2CO3用量为理论量的1.10 倍、反应温度95 ℃,反应时间对Li2CO3产品收率及纯度的影响见图8。
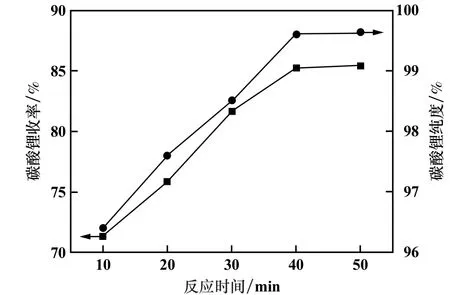
图8 反应时间对碳酸锂产品收率及纯度的影响
从图8 看出,Li2CO3纯度和收率均随着反应时间升高而提高。 反应时间反应为40 min 时,Li2CO3纯度和收率较高,分别达到99.61%和85.23%;再增加反应时间,Li2CO3纯度和收率变化不大。 综合考虑Li2CO3纯度和收率,选择最佳反应时间为40 min。
2.4 优化实验及产品质量
根据上述实验,确定了优化条件参数,即采用浓度1.5 mol/L、液固比3 ∶1的硫酸溶液在95 ℃下酸浸钛酸锂废料2 h,得到酸浸液,再经过调碱除杂得到净化液;在净化液Li+浓度27 g/L、碳酸钠添加量为理论值的1.10 倍、沉锂温度95 ℃、反应时间40 min 的条件下沉锂,获得碳酸锂产品。 检测其Li2CO3主含量和各杂质含量,并与行业电池级碳酸锂标准对比,结果列于表2。
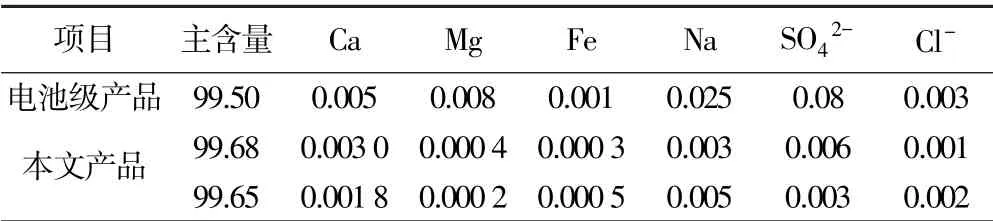
表2 碳酸锂产品质量对比(质量分数)/%
由表2 可知,本工艺制备的碳酸锂产品,其主含量大于99.65%,高于行业电池级碳酸锂的要求,同时各杂质元素指标均符合要求。
3 结 论
1) 采用硫酸体系对钛酸锂废料选择性提锂,优化的酸浸工艺为:硫酸浓度1.5 mol/L、液固比3 ∶1、95 ℃下反应2 h,此时锂浸出率为96.80%。
2) 优化的沉锂工艺为:在净化液Li+浓度27 g/L、碳酸钠添加量为理论值的1.10 倍、沉锂温度95 ℃、反应时间40 min,此条件下得到的碳酸锂产品主含量大于99.65%,达到行业电池级碳酸锂要求。
3) 本工艺钛酸锂废料中锂浸出率高,工艺中无废液产生,工艺流程短,操作简单,成本较低,可为钛酸锂废料的综合回收提供借鉴。
