沙棘源多酚的提取及其抗肿瘤活性测定
2020-09-14崔米米武海丽李汉卿李卓玉
崔米米,武海丽,李汉卿,李卓玉,3*
(1.山西大学 生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006;3.特色植物资源研究与利用 山西省重点实验室,山西 太原 030006)
0 引言
恶性肿瘤作为全球居民死亡的主要原因,大大降低了居民的预期寿命。在2015年我国新增429.2万病例,死亡人数也有上升趋势[1]。根据2018全球癌症报告,癌症发病率和致死率仍呈现上升的趋势,中国癌症发病率和致死率都位居前列[2]。虽然化疗技术进步,但耐药性使得癌症的预后效果仍然较差[3]。因此,寻找有效的治疗方案来对抗癌症仍是至关重要的方面。近年来,从药食同源植物中寻找低毒、有效的治疗药物或功能分子已成为趋势。
沙棘(Hippophaerhamnoides)属胡颓子科沙棘属,主要分布于我国华北、西北、西南等地,是一种非常珍贵的药食同源植物[4]。研究表明,沙棘的不同部位含有丰富的营养成分,包括蛋白质、脂肪、维生素、氨基酸、糖类物质、多酚及微量元素等[5-7]。沙棘中富含的多酚类物质具有抗氧化、抗炎等多种生物学功效[8-9]。
多酚类物质指广泛存在于植物中的包含多个酚基团的一类化合物的总称,根据结合方式可分为自由态多酚(Free Polyphenols,FP)和结合态多酚(Bound Polyphenols,BP)。自由态多酚指的是能够溶于水或极性溶剂的酚类;而结合态多酚多指与纤维素、蛋白、木质素等以酯键、糖苷键、醚苷键相结合的不可溶的酚类,需采用碱、酸或酶降解的方式提取[10-11]。目前关于沙棘多酚的研究实际是指游离酚,而对结合酚的研究较少。研究表明相对于游离酚,结合态酚类物质经肠道微生物菌群发酵作用后可能具有更强的生物活性[12]。
本研究分别从沙棘果、沙棘叶和沙棘籽中提取了自由态和结合态6种多酚物质,对其抗肿瘤活性进行了比较,并对其提取条件进行初步优化,以期为将其开发成为小分子抗癌药物提供理论基础。
1 材料与方法
1.1 实验材料
新鲜沙棘果、沙棘叶和沙棘籽的产地山西吕梁。甲醇、乙醇、丙酮、乙酸乙酯购于天津市风船化学试剂科技有限公司。RPMI-1640培养基、DMEM/F-12培养基、新生牛血清购自BI公司。MTT(噻唑蓝)、青霉素-链霉素-庆大霉素混合溶液、DMSO(二甲基亚砜)购自北京索莱宝生物科技有限公司。
1.2 实验仪器
SP-752型的紫外可见分光光度计、GL-5250A磁力搅拌器、YRE2000B旋转蒸发仪、HFsafe-1200生物安全柜、赛洛捷克混匀仪(MX-M)、Galaxy 170S细胞培养箱、SC-3612低速离心机、5810R台式高速大容量冷冻离心机、infinite F50酶标仪。
1.3 沙棘源多酚的提取
称取沙棘叶、沙棘果和沙棘籽10 g粉碎或榨汁,按1∶10(m∶V)分别加入预冷的体积分数80%的乙醇室温搅拌30 min后离心取上清。沉淀的残渣再重复上述过程1次,合并两次上清液,在70 ℃下旋转蒸发。过滤所得旋转蒸发液体至清澈,随后冷冻干燥获得粉末状提取物,放至4℃备用。使用时,用超纯水溶解酚类提取物。
上述离心得到的残渣用碱溶液(2mol/L NaOH)100 mL 室温消化2 h后,分别用盐酸调节pH至7,紧接着离心7 min取上清;上清液中加入等体积的乙酸乙酯搅拌均匀后静置离心,取下层水相即得水溶性结合态多酚,重复此过程至少3次。 最后70 ℃下旋转蒸发去除有机试剂并浓缩。冷冻干燥得结合态多酚提取物,放至4℃备用。使用时,用超纯水溶解。
1.4 沙棘果多酚提取方法的优化
沙棘果10 g榨汁后,采用80%甲醇,80%乙醇,80%丙酮,80%乙酸乙酯(V/V)以及超纯水等不同溶剂提取游离态酚类物质,操作步骤同1.3。以上纯度均为体积百公数。
上述离心得到的残渣分别用碱溶液(2 mol/L NaOH)或酸溶液(甲醇∶浓硫酸(V/V)=9∶1)100 mL室温消化2 h,分别用盐酸和NaOH溶液调节pH至7,后续步骤与1.3一致。
1.5 沙棘多酚含量的测定
福林酚法:没食子酸作为标准品,配制成1 mg/mL和0.1 mg/mL的母液,最后用超纯水稀释成0、20、60、100、150、200、300、400、500 和 600 μg/mL的浓度梯度,离心取上清,加入标准溶液100 μL和400 μL超纯水以组成500 μL的体系,随后加入福林酚试剂100 μL,混匀静置6 min。再加入1 mL的质量体积百分数为7% Na2CO3溶液和800 μL的超纯水,混匀静置1 h。在760 nm波长下测定吸光值。最后以OD值为横坐标,没食子酸的含量为纵坐标,绘制标准曲线(y=22.156x-0.805 7(R2=0.999))。
1.6 沙棘果黄酮含量的测定
硝酸铝显色法:将母液浓度0.2 mg/mL的芦丁液配制为终浓度0、0.03、0.06、0.1、0.13、0.17、0.2 mg/mL的0.6 mL标准液。随后加入5% NaNO2(m∶V)溶液0.1 mL,摇匀,静置6 min。再向其中加入0.1 mL的10% AlCl3·6H2O(m∶V)溶液,摇匀,静置6 min。反应完后再向其中加入1 mL的4% NaOH(m∶V)和0.55 mL的超纯水,摇匀,静置15 min,在510 nm波长下测定吸光值。以OD值作为横坐标,芦丁含量(mg)作为纵坐标绘制标准曲线(y=0.300 9x-0.000 7(R2=0.999 5))。
1.7 沙棘果单宁含量的测定
香草醛法:将0.4 mg/mL的儿茶素配制终浓度为0、0.08、0.16、0.24、0.32、0.4 mg/mL的0.25 mL甲醇-儿茶素标准溶液,随后加入1.5 mL体积百分数为4%的香草醛溶液和0.75 mL的浓盐酸,混匀后室温避光静置15 min,最后在500 nm波长处测定OD值以儿茶素含量(mg)为纵坐标并绘制标准曲线。(y=0.424 9x-0.002 7(R2=0.994 3))
1.8 细胞培养
人结肠癌细胞HCT116、正常的人结直肠黏膜细胞FHC用含10 %胎牛血清的DMEM/F-12培养基培养。人宫颈癌细胞HeLa用含体积百分数为10%胎牛血清的RPMI-1640培养基培养。将冻存的细胞在37℃水浴中融解,于低速离心机中以1 000 r/min的转速离心5 min后,弃掉冻存液,随后加入新鲜培养基悬浮移至细胞瓶中,放于37℃细胞培养箱中培养,用于后续实验。
1.9 细胞活力检测
用0.25%胰酶消化后,每孔5 000细胞铺于96孔板中。过夜贴壁之后,加入含不同浓度多酚提取物的新鲜培养基,待处理24 h后弃掉旧培养基,每孔加入新鲜培养基100 μL和5 mg/mL 的MTT 20 μL,CO2培养箱反应4 h。最后弃掉含MTT的培养液,加入150 μL的DMSO,于混合器上震荡摇匀。在酶标仪570 nm波长下测定吸光值并以未加药处理的空白组做对照,计算细胞活力。细胞存活率(%)=(OD570处理组/OD570空白组)×100%。
1.10 统计分析方法
所有实验重复3次以上,数据以平均值±标准差(Mean±SD)表示。数据图中用误差棒表示标准差,数据经SPSS 22统计分析,组间差异分析采用t检验,*P<0.05表示具有显著性差异,**P<0.01表示差异极显著。
2 结果
2.1 沙棘源酚类提取物含量比较
采用福林酚法对提取的沙棘不同部位的自由态多酚和结合态多酚含量进行了测定。由表1可知,沙棘叶中的多酚含量要高于沙棘籽和沙棘果中的,沙棘果中的多酚含量最低。且自由态多酚的含量约为结合态多酚的10倍。
2.2 沙棘源酚类提取物的抗肿瘤活性比较
采用结肠癌细胞HCT116和宫颈癌细胞HeLa两种细胞对上述提取的沙棘源多酚进行了抗肿瘤活性测定。图1A所示,SBBBP对HCT116细胞的抑制作用最显著。在浓度10 μg/mL时,SBBBP就表现出较强的活性,而其他5种多酚则没有明显的抗癌活性。由图1B可知,在处理HeLa细胞的6种多酚,SBLBP和SBSFP 2种多酚类物质在40 μg/mL浓度下表现出较强的抑制活性。根据以上结果,SBBBP具有显著的抗癌活性,因此,我们进一步对其提取进行优化。
2.3 不同提取溶剂对沙棘果自由态多酚及抗肿瘤活性的影响
采用5种不同溶剂对沙棘果中的自由态多酚进行提取,测定了多酚、单宁和黄酮类化合物的含量。由表2可知,多酚、黄酮的含量从高到低依次是80%丙酮、80%乙醇、80%甲醇、超纯水和80%乙酸乙酯,而单宁提取的含量从高到低依次是80%乙醇、80%丙酮、80%甲醇、超纯水和80%乙酸乙酯。其中,80%丙酮提取的多酚类物质最高((50.50±14.99) mg/10 g),其次是醇提取物,乙酸乙酯提取的含量最低((14.85±5.20) mg/10 g)。
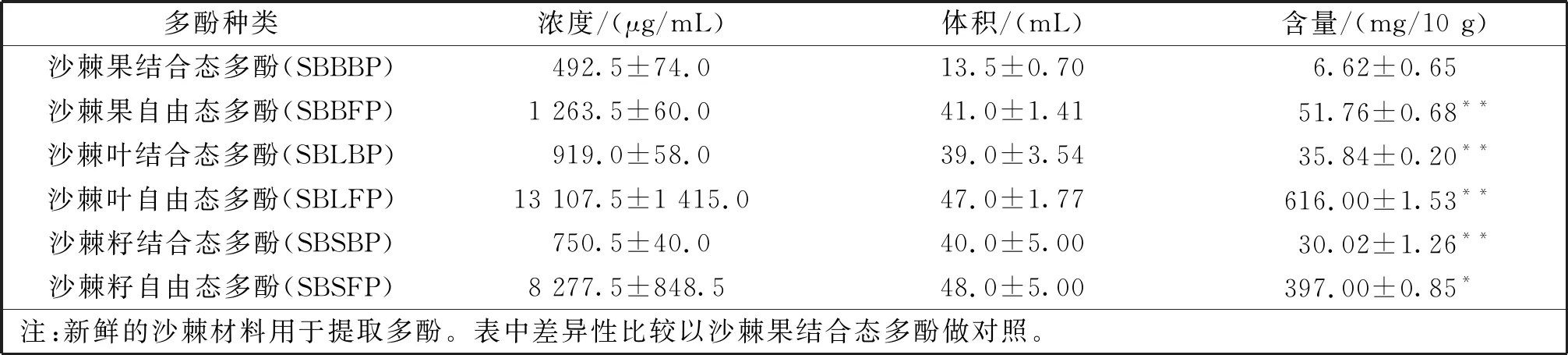
表1 沙棘源酚类提取物含量比较
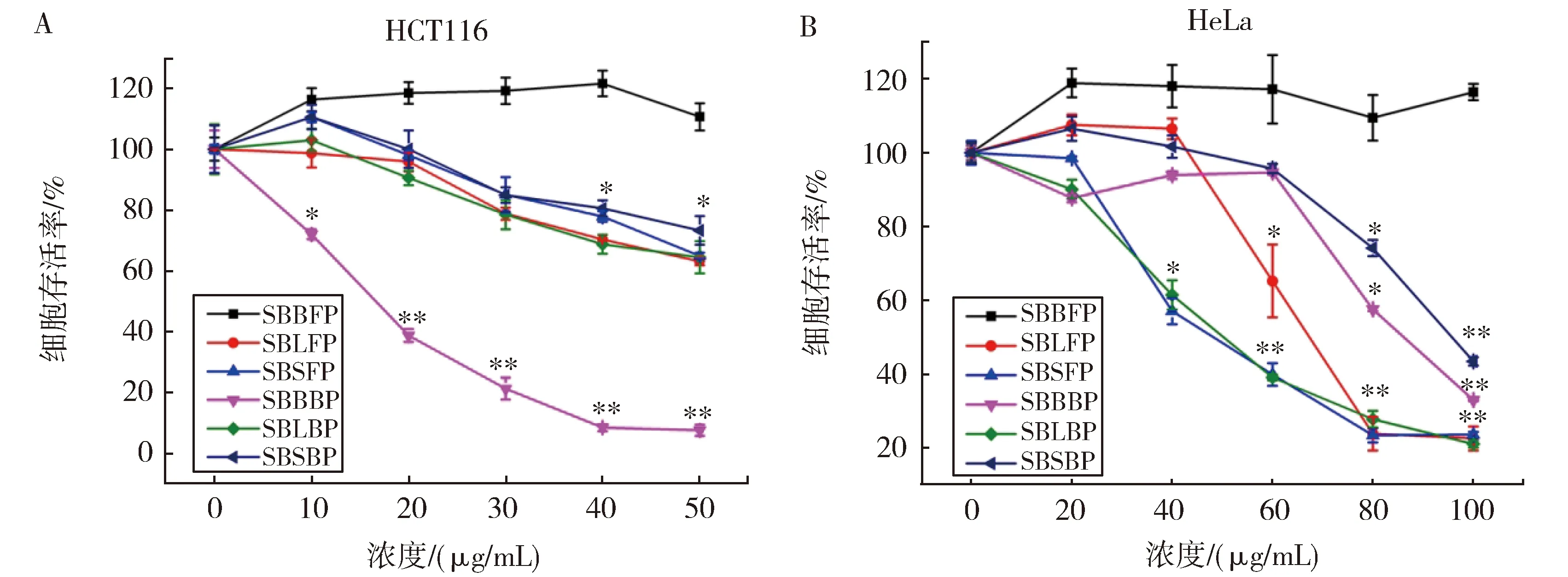
A.6种多酚处理HCT116后细胞存活情况;B.6种多酚处理HeLa后细胞存活情况图1 沙棘源多酚提取物抗肿瘤活性比较A.Cell viability of HCT116 after treatment with six Polyphenols;B.Cell viability of HeLa after treatment with six PolyphenolsFig.1 Anti-tumor effect of polyphenols from seabuckthorn in vitro
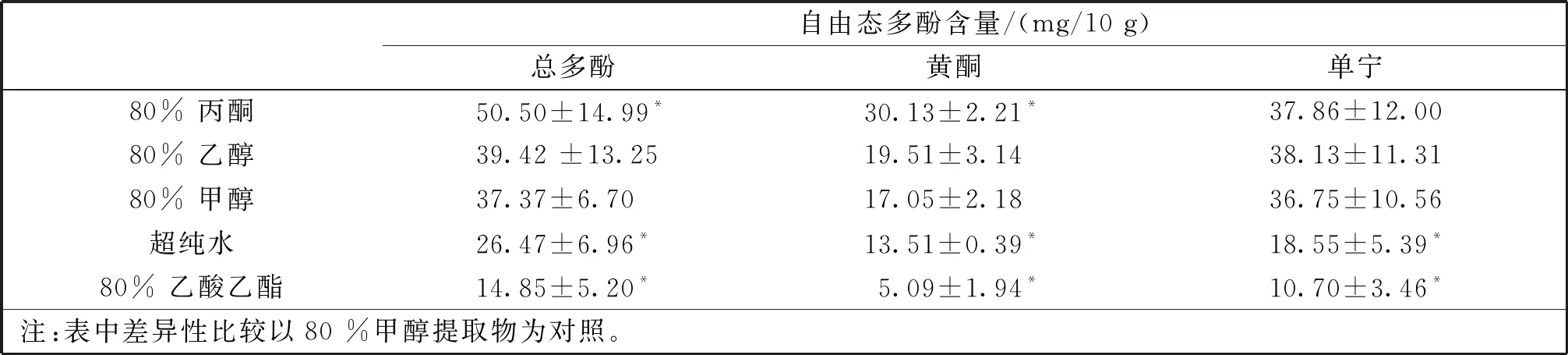
表2 不同提取溶剂对沙棘果自由态酚类物质含量的影响
采用MTT法进一步检测其抗癌活性,结果表明,丙酮和醇提取的游离多酚类化合物的抗癌活性居前两位(图2A)。综合考虑乙醇试剂的安全性和易得性,加之提取含量和抗癌活性的结果,最后选择80%乙醇作为提取自由态多酚的试剂。
2.4 不同消化方法对沙棘果结合态多酚提取及抗肿瘤活性的影响
为进一步探索碱消化法和酸消化法哪种更适合用于提取沙棘果结合态多酚,分别检测了两种方法对多酚含量及抗肿瘤活性的影响。表3所示,碱消化法提取的多酚含量高于酸消化所提取的多酚含量,尤其是单宁和黄酮。此外,还分析了两者对HCT116细胞活性的抑制效果,结果显示,两者都对细胞有明显的抑制作用,并有浓度依赖性(图2B)。综合考虑,选择碱消化法对沙棘果渣中的结合态多酚进行提取。
2.5 沙棘果结合态多酚对不同癌细胞生长抑制的活性比较
以正常的人结直肠黏膜细胞FHC作为对照,比较了SBBBP对4种不同的癌细胞HCT116、He-La、HepG2和MCF-7的抗肿瘤活性。由图3A和B可知SBBBP对4种癌细胞的生长均具有抑制作用,尤其HCT116细胞,在10 μg/mL浓度下,抑制率达到了33%。以上结果表明,SBBBP具有广泛的抑癌作用,其中对结肠癌的抑制尤为显著。
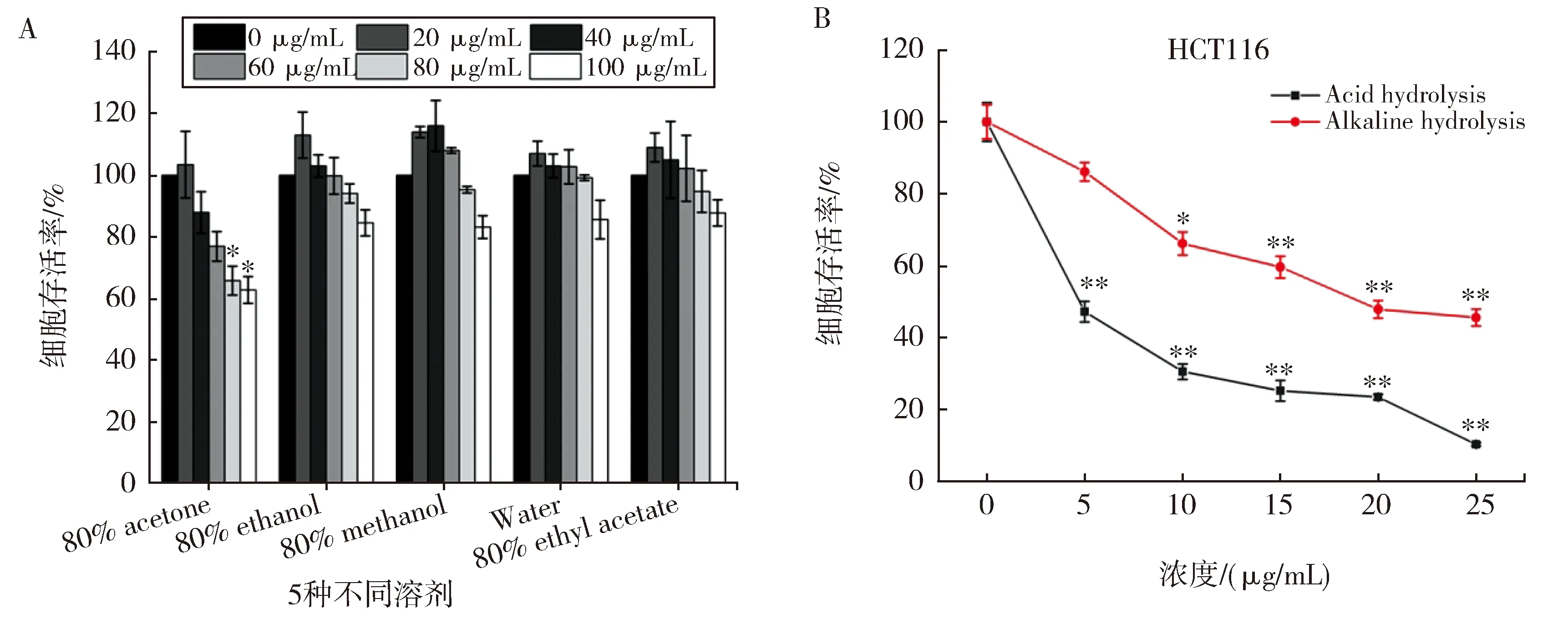
A.不同溶剂提取的自由态多酚对HCT116细胞存活的影响;B.不同消化方法提取的沙棘果结合态多酚抗肿瘤活性图2 多酚物质的抗肿瘤活性评价A.Effects of free polyphenols extracted by different solvents on HCT116 cells;B.Anti-tumor activity of SBBBP extracted by different hydrolysis methodsFig.2 Evaluation of anti-tumor effect of polyphenols

表3 不同消化方法对沙棘果结合态多酚提取含量的影响
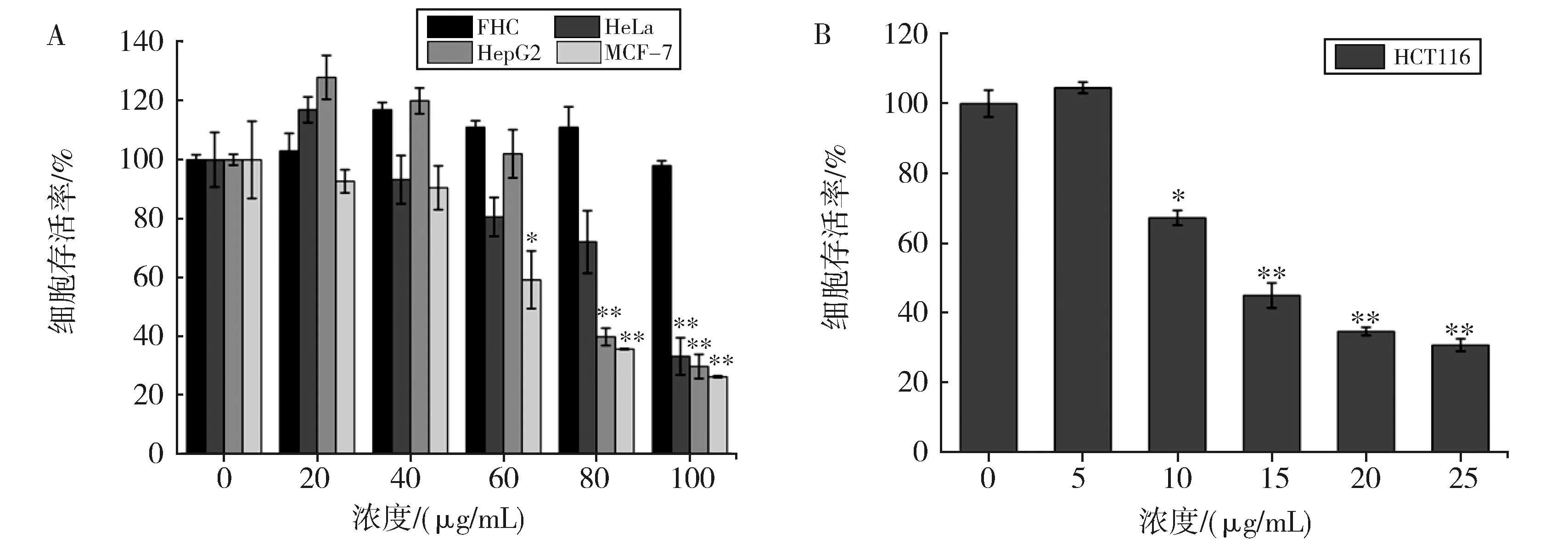
A.沙棘果结合态多酚对4种细胞的抑制作用;B.沙棘果结合态多酚对HCT116细胞存活的影响图3 沙棘果结合态多酚对不同肿瘤细胞生长抑制的比较A.Inhibitory effects of SBBBP on four kinds of cells;B.Cell viability of HCT116 Cells after treatment with SBBBPFig.3 Comparison of antitumor activity of SBBBP in vitro
3 讨论
本研究从沙棘的不同部位提取了多酚并比较抗肿瘤活性,发现沙棘果结合态多酚的抗肿瘤活性显著。与Guo等研究不同,他们评估了乙酸乙酯相中结合多酚的抗氧化和抗增殖活性[13],而我们检测了沙棘果提取物水相中结合多酚的抗肿瘤活性。结果表明,得到的水相结合多酚的含量是乙酸乙酯相的4倍左右,且其抗肿瘤活性更为显著。水相中结合多酚对HeLa、HepG2、MCF-7细胞的半抑制浓度IC50值均约为(70.00±2.46) μg/mL,对HCT116细胞的半抑制浓度IC50值为(18.50±1.28) μg/mL(图3)。而乙酸乙酯相中结合多酚对HepG2、MCF-7、结肠癌细胞Caco-2的半抑制浓度分别为(0.85±0.07)~(3.31±0.22) mg/mL、(0.58±0.03)~(2.05±0.16) mg/mL、(10.57±0.55)~(14.97±0.59) mg/mL,不难看出,乙酸乙酯相中结合多酚的IC50值远远高于水相结合多酚的。以上结果表明,水相中含有更多的生物活性成分,且作用效果更好。
浆果中一般含有大量的植物酚酸类物质,多以结合态形式存在。研究表明沙棘果实中的结合态多酚占总酚酸成分的80%,主要有没食子酸、原儿茶酸、对羟基苯甲酸、绿原酸、香草酸、丁香酸、肉桂酸、p-香豆酸、阿魏酸及咖啡酸等[14]。本研究发现水溶性结合多酚具有显著功效,然而关于其发挥功能的具体活性分子尚不清楚。我们将通过高效液相色谱、液质联用等技术对其活性成分进行鉴定。
近年来,从天然植物中探究其抗肿瘤活性成分及发挥功效的分子机制成了趋势。从红豆杉树皮中分离得到的天然活性成分紫杉醇,因其较好的治癌效果,已经在临床上得到广泛应用[15]。最初发现具有抗疟疾功效的青蒿素及其衍生物在癌症治疗方面也具有显著的效果[16]。茶多酚对于前列腺癌、宫颈癌、消化系统癌症和乳腺癌的抑制作用显著[17]。本研究获得的SBBBP对多种癌细胞的生长具有抑制作用,而且对结肠癌细胞的抑制作用最强,因此,将为其开发成为天然抗癌药物提供一定的理论支持。
4 结论
本研究对沙棘果、叶和籽中的游离态多酚和自由态多酚进行提取和抗肿瘤活性测定。结果显示,碱水解法更适合用于提取沙棘果中的结合态多酚。沙棘果中水溶性结合态多酚含量少,但对多种癌细胞均具有显著的抑制作用,尤其是结肠癌细胞HCT116。
