模板质量对RT-PCR结果的影响及分析
2020-09-11郭佳琦解宇浩张嘉琪狄文慧徐连秀聂文营吉林医药学院临床生物化学检验教研室吉林吉林132013
郭佳琦,丁 旭,解宇浩,张嘉琪,狄文慧,徐连秀,聂文营,郝 峰 (吉林医药学院临床生物化学检验教研室,吉林 吉林 132013)
基因表达分析是探索目的基因生物活性的首要环节,其常用分析方法有蛋白水平和mRNA水平分析等。蛋白水平分析是目前公认的金标准,但该法不仅需要高特异性抗体,且操作相对繁琐。为此常先选用更为敏感的RT-PCR证实目的基因的mRNA表达情况,然后应用蛋白分析方法进一步确认目的基因的表达情况[1-2]。为确保RT-PCR结果的准确性,选取确定表达的管家基因ACTB作为模板[3]。当原料充足的情况下,理论上,模板量越多,RT-PCR产物量越高,所以做RT-PCR时为了得到阳性结果更倾向于多加一些模板。但在提取RNA时可能存在一些杂质,常见的污染物有蛋白质、醇类、胍盐、糖类、酚和氯仿等,会影响逆转录后形成cDNA的质量,进而影响PCR结果。为解决这一问题,本研究做RT-PCR时,选取不同浓度模板证实模板的质量对RT-PCR的影响,并进一步研究其影响因素,为RT-PCR结果的准确性提供了理论基础。
1 材料和方法
1.1 主要试剂与仪器
NanoDrop 2000(美国Thermo);PCR仪(美国ABI);电泳仪(北京君意);凝胶成像系统(美国BIO-RAD)。
大鼠甲状腺滤泡上皮(fischer rat epithelial,FRT)细胞由中国科学院应用化学研究所关新刚教授馈赠;引物由金唯智公司合成;RT-PCR试剂盒购自南京诺唯赞公司;PCR试剂盒、DNA Marker购自全式金公司;牛血清白蛋白(bovine serum albumin,BSA)购自BIOSHAR公司;琼脂糖购自OXOID公司。
1.2 模板浓度的测定
利用核酸蛋白测定仪NanoDrop 2000检测PCR前模板中A260/A230,A260/A280;蛋白含量A280、A260/A280和蛋白浓度。
1.3 PCR反应
引物为自己设计:ACTB(Forward)5′-GTC GTC GAC AAC GGC TCC-3′,ACTB(Reverse)5′-AGG TCT CAA ACA TGA TCT GGG T-3′。
向PCR反应管中加入上、下游引物各1 μL(10 μmol/L),25 μL 2×EasyTaq PCR SuperMIx,1 μL模板(浓度分别为5、1、0.2、0.04、0.008 mg/L),22 μL Nuclease-free Water补齐,反应总体系50 μL。PCR扩增3轮。反应条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环,72 ℃再延伸5 min,反应体系温度最终降至4 ℃;94℃ 预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72℃ 延伸2 min,30个循环,72 ℃再延伸5 min,反应体系温度最终降至4 ℃;94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环,72 ℃再延伸5min,反应体系温度最终降至4 ℃。
1.4 电泳检测
5 μL PCR产物上样1.5%琼脂糖/EB凝胶电泳检测,凝胶成像系统进行摄影记录。
2 结 果
2.1 NanoDrop 2000检测模板的浓度和纯度
mRNA浓度为1971.7 mg/L,A260/A280为1.75,A260/A230为1.74;纯化PCR产物为模板浓度为763.2 mg/L,A260/A280为1.85,A260/A230为2.05。RNA纯品的A260/A280比值在1.9~2.0,A260/A230的比值应>2.0[4];DNA纯品A260/A280比值应接近1.8~2.0,A260/A230比值应在2~2.5之间。
2.2 PCR 50 μL体系中蛋白含量的测定
为探究RT-PCR结果影响因素,在高质量的模板中混入不同浓度的蛋白质:15.827、13.454、12.212、11.078、2.451 g/L,A260/A280分别为0.89、1.04、1.13、1.22、1.52。
2.3 电泳检测结果
不同浓度的逆转录产物PCR电泳检测结果如图1:5倍比稀释模板,在260 bp附近均出现特异性条带,但模板浓度越高,PCR条带越暗且出现非特异性条带。应用软件Image J及GraphPad Prism 5对PCR产物进行定量分析表明模板质量低时,模板量越高,RT-PCR产物量越低。
不同浓度纯化的PCR产物PCR电泳检测结果如图2:5倍比稀释,在260 bp附近均出现特异性条带,模板浓度越高,PCR条带越亮且未出现非特异性条带。应用软件Image J及GraphPad Prism 5对PCR产物进行定量分析表明模板质量高时,模板量越高,PCR产物量越高。
相同浓度纯化的PCR产物并加入不同浓度蛋白质的PCR电泳检测结果如图3:在高质量的模板中混入不同浓度的蛋白质,在260 bp附近均出现特异性条带,蛋白质含量越低,PCR条带越亮,且仅含有最低浓度蛋白质的PCR未出现非特异性条带。应用软件Image J及GraphPad Prism 5对PCR产物进行定量分析显示模板量相同情况下,蛋白浓度越高,PCR产物的量越低。
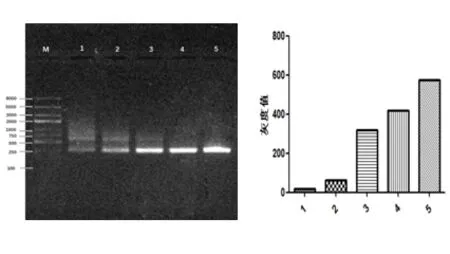
M:Marker;1~5模板浓度:5、1、0.2、0.04、0.008 mg/L

M:Marker;1~5模板浓度:5、1、0.2、0.04、0.008 mg/L

M:Marker;1~5模板浓度:5、1、0.2、0.04、0.008 mg/L
3 讨 论
PCR是分子生物学中常用的实验技术手段,灵敏度高,在揭示生命现象规律方面发挥了至关重要的作用。理论上,在原料充足的情况下,模板量越多,PCR产物的越高。但实际中模板会存在蛋白质、胍盐等杂质,对PCR产物的质和量有严重影响。本研究结果证实当提取的RNA质量不佳时,会影响逆转录后形成cDNA的质量,这时选取过多低质量的模板,不仅PCR产物量越低,且出现非特异性条带。在纯化PCR产物获得高质量的模板后,再次进行PCR,得出的结果与之前相反,上述结果表明模板质量对RT-PCR结果有显著性影响。为获得准确的PCR结果应提高模板质量,当模板质量不佳时,应稀释模板,而非想当然的增加模板量。当模板质量不佳获得假阴性结果或者出现非特异性条带时,并不是通过增加模板的量或者降低退火温度获得阳性结果和去除非特异性条带。本研究推断模板质量影响PCR产物量。为进一步探究其影响因素,在高质量的模板中混入不同浓度的蛋白质,探究蛋白质对PCR产物量影响。发现在模板量相同情况下,蛋白浓度越高,PCR产物的量越低,并出现非特异性条带,因此可以推断模板中混入的蛋白质会影响RT-PCR结果。因此在提取RNA或DNA过程中,保证完整性的同时,一定要提高模板纯度,而模板的浓度对RT-PCR结果影响不大。
