二十六面体氧化亚铜-金异质结构型催化剂的制备及其催化降解性能研究*
2020-09-11肖雪红
肖雪红,徐 凯,潘 哲**
(1.宝鸡职业技术学院 生物与建筑工程学院,陕西 宝鸡 721013;2.宝鸡石油钢管有限公司,陕西 宝鸡 721008)
前 言
氧化亚铜是一种P-型半导体,在能源转化、催化、传感等领域具有重要作用,近年来成为了研究最为广泛的二元过渡金属氧化物晶体之一[1~7]。除具有成本低、无毒、来源丰富、易于合成等优点,其物理化学性质可使其实现多功能化,因而氧化亚铜结构的调控已成为研究热点[8~11]。对氧化亚铜晶体进行功能化修饰,将氧化亚铜与其他物质组合,构筑具有特定异质结构的复合功能材料,按照需求调控其性能,可用于开发新型高性能催化材料。
金属-氧化亚铜杂化型光催化剂的界面上可形成肖特基势垒,其可有效阻止光催化过程中电子和空穴的结合,显著提高氧化亚铜的光催化效率。
Au、Ag、Pb等贵金属纳米颗粒可被用作构造Cu2O基异质结构光催化剂的优秀电子介质,能够避免逆反应,使光催化剂恢复变得容易[12~14]。刘等[15]在截角八面体Cu2O晶面上制备Au纳米颗粒,并对其形貌和性能进行了详细研究,研究发现负载Au纳米颗粒后,八面体Cu2O对H2O2的电化学催化还原活性提高了10倍以上。李等[16]在立方八面体和立方体Cu2O晶面上负载Pd纳米颗粒,研究了肖特基势垒和电荷空间分布对表面电子-空穴分离和电荷聚集的影响,结果表明通过合理设计Pd纳米颗粒在Cu2O晶面上的分布,可通过肖特基势垒有效调控空穴的迁移,提升光催化效率。王等[17]在八面体Cu2O上制备了Ag纳米颗粒,并研究了其对染料吡啰红B的催化降解效果,发现Ag/Cu2O的催化性能较Cu2O有了很大提高。
本研究利用水热法合成具有二十六面体结构的Cu2O,然后通过Cu2O与AuCl3的氧化还原反应制备Au纳米颗粒,并使其负载在Cu2O晶面上,构建Cu2O-Au异质结构型光催化剂,并进一步分析测试其物相组成、形貌和催化降解性能。
1 实验部分
1.1 实验材料与仪器
乙酸铜(Cu(Ac)2,分析纯)、氢氧化钠(NaOH,分析纯),乙醇(C2H5OH,分析纯),甲基橙(C14H14N3SO3Na,分析纯)上述试剂均购于国药集团化学试剂有限公司;葡萄糖(C6H12O6·H2O,98%)、三氯化金(AuCl3,分析纯),上述试剂均购于上海阿拉丁生化科技股份有限公司。
DMAX UITIMA IV型X-射线衍射仪(XRD,日本理学公司);HITACHI SU8000型场发射扫描电子显微镜(SEM,日本日立公司);UV-3900型紫外-可见分光光度计(UV-Vis,日本日立公司),光化学反应器(XPA系列,南京胥江机电厂)。
1.2 实验方法
1.2.1二十六面体Cu2O的制备
将1.5gCu(Ac)2加入25mL超纯水中混合均匀,然后将1.8gNaOH溶于15mL超纯水中混合均匀后加入到上述Cu(Ac)2溶液中,搅拌均匀后,加入0.4g葡萄糖,调节水浴温度为70℃,采用磁力搅拌保证溶液的均匀性,反应10min后,利用离心机分离产物中的杂质和副产物,接着用去离子水清洗样品三次,再用乙醇清洗三次,确保洗涤干净后,将样品放入真空干燥箱中,在适当的温度和压力下,干燥12h。
1.2.2 Cu2O-Au异质结构材料的制备
将60μL 0.01mol/L的AuCl3加入30mL超纯水中混合均匀,记为A溶液;以水为溶剂,20mg上述制得的Cu2O为溶质,将两者混合均匀后的溶液记为B溶液;然后,将B溶液加入到A溶液中,混合均匀后,在25℃反应10min,随后利用离心机分离产物中的杂质和副产物,接着用去离子水清洗样品三次,再用乙醇清洗三次,确保洗涤干净后,将样品放入真空干燥箱中,在适当的温度和压力下,干燥12h。
1.2.3 利用光催化作用实现甲基橙的降解
以石英试管为容器,10mL水为溶剂,溶解10mg上述制得的催化材料,为确保溶解效果,利用超声作用进行分散,将所得溶液记为C;然后,配制浓度为26.7mg/L的甲基橙溶液,取30mL加入C溶液中;随后将试管置于光化学反应器内,确保内部为暗室环境,采用磁力搅拌器搅拌30min,使样品对甲基橙的吸附达到平衡状态;接着,选用氙灯为可见光源(功率:350W),在光的作用下,发挥催化剂的性能,实现甲基橙的降解;期间,设定固定的时间间隔取样(2mL/次),以紫外-可见分光光度计为工具,对所取溶液的吸光度进行测试(波长区间:220~800nm),监测其变化规律,按照甲基橙理论峰位和测试结果,选择曲线中峰位置为460nm处的吸光度,并结合其随时间变化的情况绘制曲线图。
2 结果与讨论
2.1 样品物相分析
图1为二十六面体氧化亚铜(Cu2O)和Cu2O与Au组成的异质结构材料(Cu2O-Au)的XRD谱图。将图1a中曲线的出峰位置与Cu2O标准卡片(JCPDS No.35-0821)中的出峰位置进行比对,发现两者峰位一致,说明所得材料为Cu2O,无其他杂质;进一步对比Cu2O与Cu2O-Au的谱图(图1b)可知,Cu2O-Au谱图中的衍射峰不仅包括Cu2O的特征峰,而且出现了新的特征峰(2θ=38.2°),与 Au的标准卡片(JCPDS No.46-1195)进行比对,两者吻合,结果说明所得材料是Cu2O与Au的复合物。
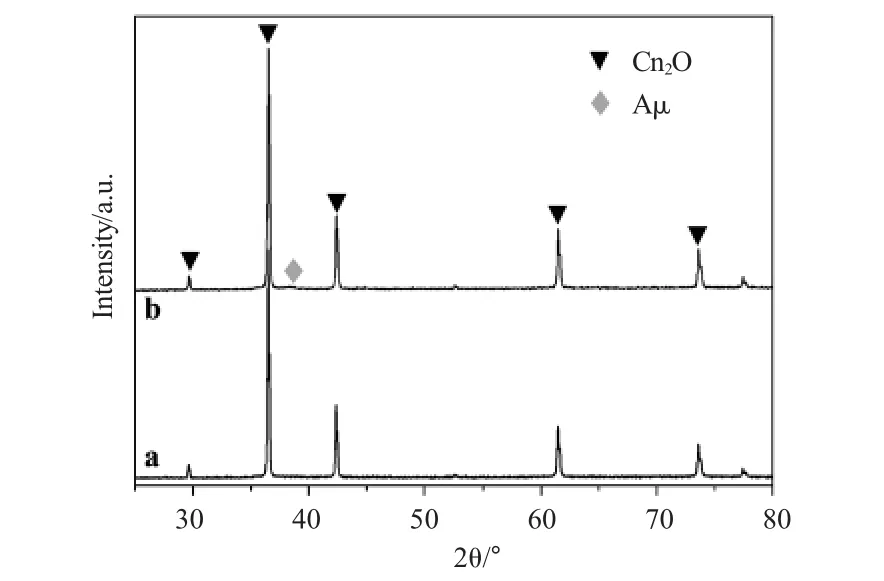
图1 Cu2O(a)与Cu2O-Au(b)样品的XRD图谱Fig.1 The XRD patterns of the(a)Cu2O and(b)Cu2O-Au samples
2.2 样品表面形貌
图2是二十六面体Cu2O和Cu2O-Au异质结构材料的SEM图像。从图2a可见,所得Cu2O样品的形状均为规则的二十六面体球,且球的尺寸均一性较好,图2a中的插图为放大后的图像,可观察到其表面平整度好且较光滑;图2b中,二十六面体Cu2O-Au的表面粗糙度相较于图2a明显增加,由放大图像(图2b中插图)可知,每个晶面上均有一些Au纳米颗粒附着,利用标尺工具可测得颗粒的尺寸为10~20nm。SEM与XRD结果表明成功地在Cu2O表面制备了均匀分布的Au纳米颗粒层。

图2 Cu2O(a)与Cu2O-Au(b)样品的SEM 图像Fig.2 The SEM images of the Cu2O(a)and Cu2O-Au(b)samples
2.3 样品表面元素分布及含量
图3为二十六面体Cu2O-Au异质结构样品的SEM-EDS面扫描图。图中出现了明显的Cu、O和Au元素分布图,观察Au元素的分布可知Au颗粒在二十六面体Cu2O表面分布均匀,与上述SEM图像所观察到的结果相一致。

图3 Cu2O-Au样品的SEM-EDS面扫描图Fig.3 The SEM-EDS mapping images of Cu2O-Au sample
表1为对应Cu、O和Au元素的含量,由表可知,二十六面体Cu2O-Au异质结构样品表面Au的原子百分含量为0.688%。
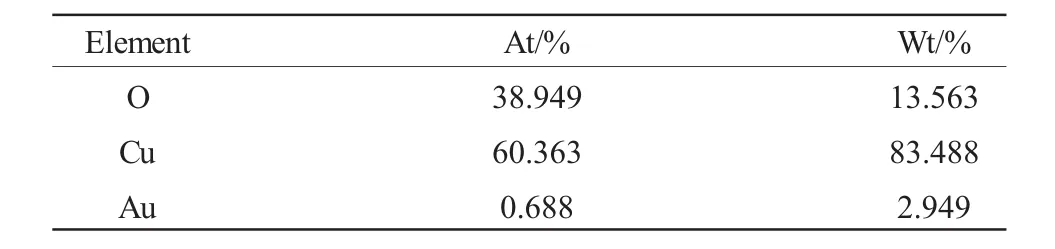
表1 Cu2O-Au样品中各元素含量Table 1 The contents of elements in the Cu2O-Au samples
2.4 催化性能
图4是以甲基橙为目标物,二十六面体Cu2O和Cu2O-Au异质结构型材料分别为催化剂,测定甲基橙在降解过程中,不同时刻特征吸收峰的强度变化规律。由图4a可知,利用二十六面体Cu2O催化降解甲基橙,时间达到390min时,甲基橙残余量仍有84.5%;由图4b可知,利用Cu2O-Au异质结构材料催化降解甲基橙,时间为390min时,催化降解甲基橙的残余量为37.6%;尤其是在120min开始紫外光辐照时,Cu2O-Au异质结构材料催化降解甲基橙的速率明显增大。结果表明通过表面负载Au纳米颗粒可有效提升二十六面体Cu2O的催化降解甲基橙的能力。这是因为Cu2O半导体材料的禁带宽度约为1.9~2.38eV[18],在光照作用下,光生电子-空穴对容易发生复合,从而导致光催化性能降低;而在Cu2O晶面上负载Au纳米颗粒后,Au作为一种优良导体,能够迅速传导光生电子,并且负载的Au纳米颗粒数量多,粒径小,为光催化反应提供了大量的活性位点,使材料的光催化降解能力极大增强[19]。
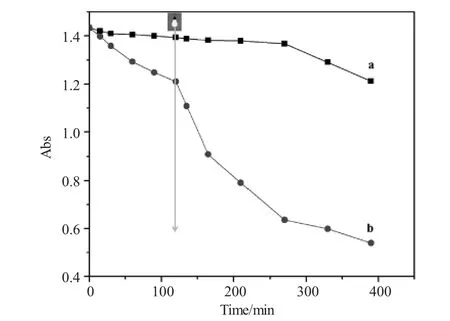
图4 Cu2O(a)与Cu2O-Au(b)样品对甲基橙的催化降解性能图Fig.4 The catalytic degradation performance of(a)Cu2O and(b)Cu2O-Au samples for degrading methyl orange
3 结论
采用水热法制备了粒径约4μm二十六面体结构Cu2O,利用Cu2O和AuCl3的氧化还原作用,在二十六面体Cu2O表面制得了一层Au纳米颗粒层,且Au颗粒在每个晶面上分布均一;该Cu2O-Au纳米复合材料具有异质结构特点,在催化降解甲基橙方面,其催化性能和效果明显优于二十六面体Cu2O相;催化降解390min,Cu2O-Au可使甲基橙的降解率达到62.4%,说明通过Au的负载,不仅能有效减少催化过程中空穴和电子的复合,而且可提供有效的活性位点,促进材料光催化性能的充分发挥。
