大黄素聚乳酸微球的制备及体外释药行为研究*
2020-09-11李鸣粤赵志伟罗斌华
李鸣粤,赵志伟,罗斌华**
(1.湖北科技学院药学院,湖北 咸宁 437100;2.咸宁市中心医院/湖北科技学院第一附属医院影像科)
大黄素(1,3,8-三羟基-6-甲基蒽醌)为大黄众多生物活性成分中的蒽醌类单体化合物,多存在于大黄、何首乌等蓼科植物中,来源分布广泛。大黄素药理学活性多样,临床应用价值较高,目前对其药理作用机制研究较多,发现其具有抗炎、抗肿瘤、治疗糖尿病并发症等生物药理活性[1-4]。聚乳酸(polylactic acid,PLA)是一种具有广泛应用前景的脂肪族聚酯类高分子材料,由于其优良的生物相容性、生物降解性、力学性能等特性,吸引众多研究者对其进行各方面的深入研究[5-6]。由于PLA中存在α-甲基,使其机械性质和理化性质更为多样[7]。相关研究证实PLA及其共聚物构建的微球,其粒径、形态、结构和分子量等物理化学特性较好,是理想的药物载体[8-10]。
本文以PLA为药物载体材料,大黄素为模型药物,采用复乳溶剂挥发法制备包裹大黄素的PLA微球(以下简称大黄素微球),并对微球的形态、粒径、载药量与包封率进行评价,通过透析袋法考察微球的体外释药行为,该研究将为大黄素缓释制剂提供前期理论基础。
1 材料与方法
1.1 药品与试剂
大黄素(Aladdin,批号C1823172,含量 90%,HPLC);十二烷基硫酸钠(SDS,国药集团化学试剂有限公司,批号20181210,含量 86%,化学纯);二氯甲烷(国药集团集团化学试剂有限公司,批号20160118,含量 99.5%,分析纯);司盘80(天津市大茂化学试剂厂,批号20160113,分析纯);PLA(实验室自制,分子量10000);透析袋(Bio sharp 36mmMW,14000)。
1.2 仪器与设备
FA2004分析电子天平(上海良平仪器仪表有限公司),ZNCL-TS50ML恒温磁力搅拌器(上海越众仪器设备有限公司),LDZ4-0.8低速自动平衡离心机(北京医用离心机厂),SA3000生物显微镜(北京泰克仪器有限公司),ZD-85恒温振荡器(国华企业),VARIAN CARY 50 Conc紫外分光光度计(德国贺利氏)。
1.3 大黄素微球的制备
称取大黄素0.0200g置于西林瓶A,加入0.5mL NaOH溶液(0.5%),震荡充分溶解;PLA 0.1000g,二氯甲烷1.5mL,司盘80适量,加入西林瓶B内,充分混匀;将A瓶药液转移至B瓶内,移液枪充分吹打均匀,镜下观察形成初乳。0.5%SDS溶液加入西林瓶C,将初乳加入西林瓶C内,45rpm/min的速度搅拌1h,镜下观察形成微球,40℃下真空干燥。
1.4 大黄素微球体外分析方法的建立
1.4.1 检测条件
采用紫外分光光度法测定大黄素的浓度,溶解介质为3%SDS的PBS缓冲液,室温条件下,紫外分光光度计的检测波长为257nm。
1.4.2 大黄素标准曲线的制备
精密称取大黄素0.0117g于25mL容量瓶中,用3%SDS的PBS缓冲液作为溶剂溶解(pH 7.4)并定容,作为储备液。然后分别从储备液中取0.5、0.8、1.0、1.2、1.4、1.6mL,定容至25mL,作为标准溶液。在紫外257nm处测定样品吸光度,以标准溶液浓度和吸光度进行线性回归,得大黄素浓度的吸光度标准曲线。
1.5 大黄素微球中大黄素的载药量和包封率测定
1.5.1 大黄素微球中大黄素载药量测定
微球中的包载药物量采用间接法测定。将制备的大黄素微球溶液在4000rpm的条件下离心10min,收集滤液和微球,微球真空干燥。滤液采用紫外分光光度法测定未包载的大黄素药物浓度,计算大黄素量,微球中包载的大黄素质量等于投药量减去溶液中游离药物,并通过以下公式求算载药量(DL%):DL%=微球中所含大黄素的重量/微球的总重量×100%。
1.5.2 大黄素微球中大黄素包封率测定
通过1.5.1方法,得到包载的药物量,通过以下公式求算包封率(EE%):EE%=W1/W(W1即已包裹的大黄素重量,W即大黄素的总重量)。
1.6 大黄素微球体外释放实验
取适当长度透析袋,去离子水煮沸30min备用。采用3%SDS的PBS缓冲液(pH7.4)作为透析液,将干燥的微球转移至透析袋内,浸入装有50mL释放介质的带塞锥形瓶,恒温箱温度设置为37℃,100rpm的速度震荡,分别于0.5、1、2、4、6、8、10、12、24、48、72、96、108、120、132、144、156、168、180、192、204、216、228、240取样3mL,取相同体积新的空白释放介质补足。采用紫外分光光度法,测定释放介质中大黄素的浓度,通过大黄素浓度的吸光度标准曲线,计算大黄素含量,最后求算累积释放百分率。
2 结 果
2.1 大黄素微球制备
用生物显微镜对制备的大黄素微球进行观察分析,其平均粒径为(4.87±0.1)μm。放置1、2、4、6和8d后的大黄素微球的水合粒径变化如图1所示。由图可知,随着时间的延长,微粒的粒径基本没有变化。实验结果表明大黄素微球具有较好的稳定性。

图1 大黄素微球放置不同时间粒径变化图(n=3)
2.2 大黄素体外分析方法的建立
采用1.4.1的检测条件进样分析,测定不同浓度大黄素的吸光度。对吸光度和大黄素的浓度(μg/mL)进行线性回归分析,得回归方程:y=0.032x+0.0003(R2=0.999),说明大黄素在9.36~29.95μg/mL范围内线性关系良好。
2.3 微球载药量与包封率
在大黄素和PLA不同比例(1∶1,1∶2,1∶3)制备的微球中,其中大黄素和PLA的比值为1∶2时,通过紫外分光光度计法计算大黄素的负载量为(31.37±1.41)%,包封率为(92.18±0.39)%,为最优比例。
2.4 体外释放度
如图2所示,240h内,大黄素微球中的大黄素的累积释放量为(86.93±3.78)%。
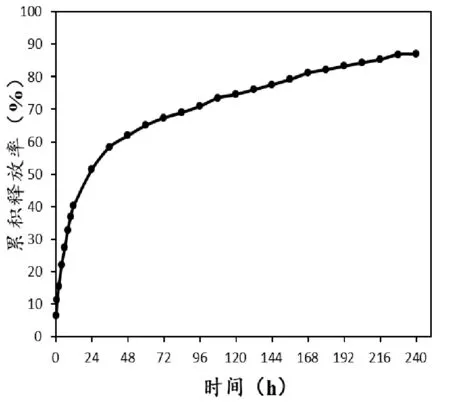
图2 大黄素微球中大黄素释放曲线(n=3)
为了进一步阐明大黄素微球的体外释药特性,在上述结果的基础上对其体外释药曲线进行拟合。分别采用Higuchi方程、Ritger-Peppas方程进行模型拟合,计算R2作为模型拟合相似度的判据,结果如表1所示。R2越接近1,药物释放曲线与对应方程的拟合效果越佳。从相关系数可知,大黄素微球释药曲线与Ritger-Peppas方程拟合度最好,其拟合方程为lnQ=0.3759lnt-2.0691(R2=0.959)。在Ritger-Peppas方程中,释放指数N是表征释放机制的特征参数,当N>0.89时,为骨架溶蚀机制;当0.45 表1 大黄素微球体外释放性能拟合方程 本文以PLA为药物载体材料,大黄素为模型药物,采用复乳溶剂挥发法,构建大黄素微球的给药系统。最终制得的大黄素微球外形完整光滑,粒径较均匀,微球药物负载量可达(31.37±1.41)%,包封率为(92.18±0.39)%,目标药物负载量较高,并具有较好的稳定性。微球制备过程中,影响微球粒径的因素有搅拌速度、乳化剂浓度、初乳的粒径大小等。为了制备符合要求的粒径,在实验的过程中,本实验控制了初乳的粒径和后期的搅拌速度。初乳的粒径主要控制内水相和油相的体积,使其形成的初乳粒径大小合适。后期复乳制备过程,通过调节搅拌速度,控制制备的复乳的粒径,固化后,就形成粒径适宜的微球。 大黄素通过紫外分光光度法测定其浓度,仪器灵敏度较高,线性关系和精密度良好,符合要求。通过透析袋法测定大黄素微球体外释放度,释放介质选择对大黄素有较好溶解的溶剂,发现载药微球在漏槽条件下,0.5h释药量没有超过30%,无明显突释效应,240h内累积释放量为(86.93±3.78)%,结果表明大黄素微球能缓慢释放药物。进一步通过对其体外释药曲线进行拟合,从Ritger-Peppas方程拟合的结果来看,药物的释放符合Fick扩散,证实其缓释的效果较好。 本文只是研究了制备的大黄素微球的体外释药行为,后期可深入研究大黄素微球对于细胞的毒性以及动物体内的释药行为,并研究其生物体内药动学,观察将其制备成微球,能否提高大黄素的生物利用度,进而评价大黄素微球的药效学。
3 讨 论
