Radil在肝癌组织中的表达及对肝癌发展的影响
2020-09-11孙海香史颖弘杨柳晓
孙海香, 史颖弘, 樊 嘉,, 杨柳晓*
1. 复旦大学附属中山医院肝癌研究所,上海 200032 2. 复旦大学附属中山医院肝外科,上海 200032
肝癌是最常见的恶性肿瘤之一,在我国肝癌发病率列恶性肿瘤第4位,死亡率占据第2位,对人类的健康造成严重威胁,因此深入探索分析肝癌的发病、发展机制对于肝癌治疗具有非常重要的指导意义[1]。Radil(Ras association and DIL domains)是小G分子Rap的效应分子,研究发现其对细胞的黏附、运动起着重要的作用,但对其在肝癌组织中的表达及其意义研究较少。本研究旨在通过免疫组化及蛋白质印迹(Western blot,WB)方法分析肝癌组织标本中Radil的表达水平,通过过表达或敲低Radil表达水平分析其对肝癌细胞生长及运动的影响,探讨其对肝癌发展的影响。
1 材料与方法
1.1 细胞系 肝癌细胞Hep3B、Huh7购自中科院上海生化细胞所, MHCC97L、MHCC97H和HCCLM3细胞株由复旦大学附属中山医院肝癌研究所提供。所有肝癌细胞系均用含10%胎牛血清的高糖DMEM培养液于5% CO2,37℃下进行培养。细胞生长至90%融合度用0.25%的胰蛋白酶进行消化传代。Radil过表达和敲低病毒购自上海吉凯基因化学技术有限公司。
1.2 临床标本 选取复旦大学附属中山医院肝外科手术切除的肝癌标本,癌旁标本作为对照,并经液氮速冻后立即置入-80℃冰箱中保存。组织标本经10%甲醛固定,常规石蜡包埋,连续切片,切片厚度4 μm,备染。
1.3 免疫组化 石蜡切片经二甲苯脱蜡,梯度乙醇脱水,微波修复抗原,漂洗后置于磷酸盐缓冲液(PBS)中。5% H2O2室温孵育30 min,血清封闭后加入Radil抗体4℃孵育过夜,PBS漂洗后加二抗室温孵育,最后加入氧化二氨基联苯胺(DAB)常温显色,蒸馏水漂洗,逐级脱水,最后复染及封片,光镜观察。
1.4 实时荧光定量PCR(RT-PCR) 取对数生长期细胞,每T25培养瓶加入1 mL TRIzol试剂进行裂解,氯仿乙醇法进行抽提。所有RT-PCR反应所需要的试剂均购自TaKaRa公司。
1.5 蛋白质印迹法 取对数生长期细胞约1×106个,PBS洗后加入放射免疫沉淀法缓冲液(RIPA)裂解液,冰上裂解30 min。利用BCA法检测蛋白质浓度,应用酶标仪检测562 nm波长的光密度,根据标准曲线计算样品的蛋白浓度。按照说明书配制分离胶和浓缩胶,上样量为80 μg。Radil、actin、 E-cadherin、fibronectin,抗体购自英国Abcam公司。
1.6 细胞增殖实验 取实验组和对照组的对数生长期的细胞,调整成3×104个/mL密度,96孔板每孔接种100 μL,接种后每隔24 h加入10 μL 细胞计数盒8(CCK8)检测液,用酶标仪进行吸光值检测。
1.7 细胞迁移实验 用DMEM将实验组和对照组的细胞稀释成1×106/mL单细胞悬液,取100 μL细胞悬液加入上室,下室加入300 μL悬液,并在DMEM培养液加10%胎牛血清;72 h后经4%多聚甲醛固定、Giemsa染液染色,显微镜下计数并拍照。
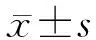
2 结 果
2.1 Radil在肝癌及癌旁组织中的表达情况 免疫组化染色发现,Radil主要表达在细胞质中,少量分布于细胞膜上(图1A)。该蛋白在肝癌和癌旁组织中均有表达,其中肝癌组织中的表达量显著高于癌旁组织;WB结果也表明不同患者的Radil表达量不同,癌旁组织中的表达量显著低于癌组织(图1B)。这些数据表明,Radil可能对肝癌的发展具有促进作用。
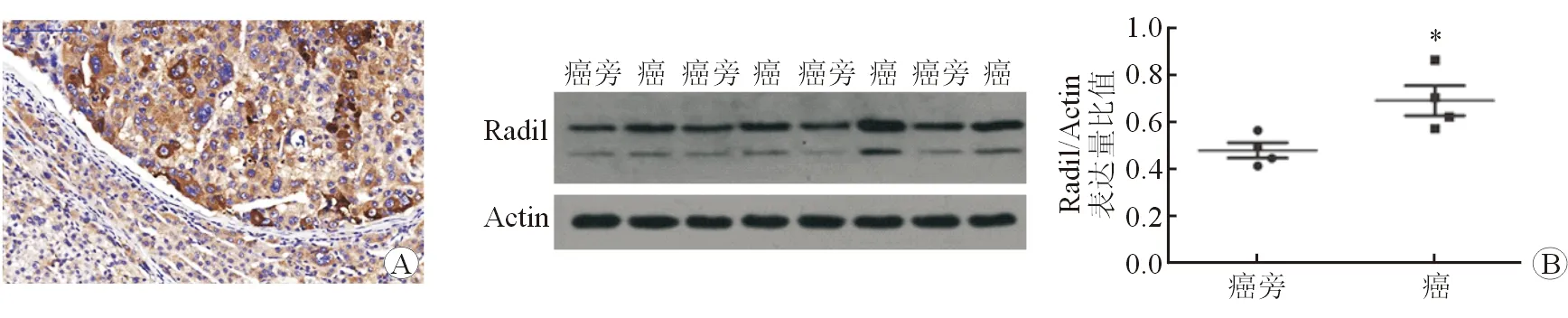
图1 Radil在肝癌组织中的表达
2.2 Radil 在肝癌细胞中的表达 通过RT-PCR和WB检测分析肝癌细胞系中Radil的表达水平,结果发现具有转移潜能的MHCC97L、MHCC97H和HCCLM3细胞系中Radil的RNA和蛋白水平均显著较高(图2A、2B)。构建高表达Radil载体,转染Huh7细胞,WB 验证得到高表达Radil的Huh7细胞系(图2C);转染shRNA至LM3细胞中,筛选得到低表达水平的LM3细胞系(图2D)。
2.3 Radil对肝癌细胞增殖的影响 细胞增殖实验结果发现,高表达Radil的Huh7细胞生长速度显著高于对照组,而敲低Radil的表达则导致LM3细胞的生长速度显著降低(图3)。
2.4 Radil对肝癌细胞运动的影响 对照组和实验组细胞的运动实验表明,高表达Radil导致Huh7细胞的运动能力显著增加(图4A、4B);降低Radil的表达显著降低LM3细胞的运动能力(图4C、4D)。
2.5 Radil促进肝癌发展可能的机制 进一步研究分析发现,Radil表达促进fibronectin的表达,E-cadherin的表达量降低,凋亡分子Bax的表达量减少。Radil低表达的细胞则高表达E-cadherin和 Bax(图5)。这些数据表明,Radil可能通过促进细胞上皮细胞-间充质转分化(EMT),降低细胞凋亡来促进肝癌细胞的增殖和迁移,促进肝癌的发展。

图2 Radil 在肝癌细胞中的表达
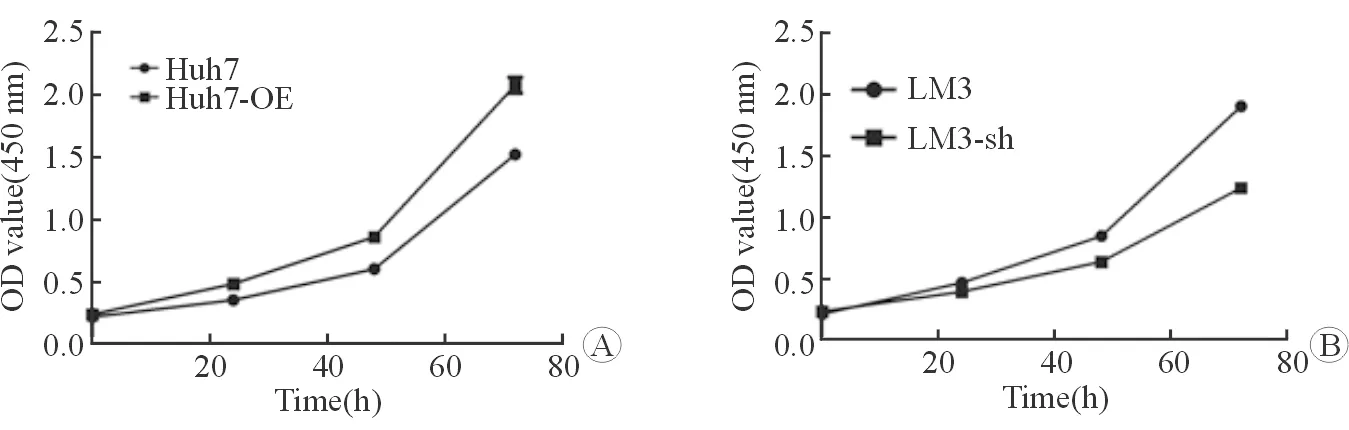
图3 Radil对肝癌细胞增殖的影响
图4 Radil对肝癌细胞运动的影响
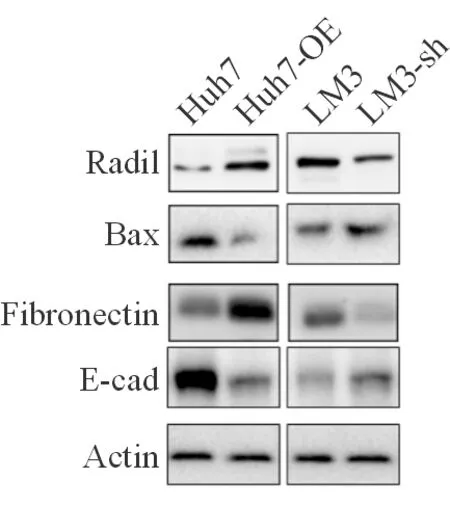
图5 WB检测EMT和凋亡分子的表达水平
3 讨 论
肝癌是全球发病率和死亡率均较高的恶性肿瘤之一,虽然诊断和治疗技术的进步使肝癌患者的生存率有了较大的提高,但是术后的转移与复发比例仍居高不下,探索肝癌转移、复发的机制对于肝癌的治疗具有重要的理论和临床意义[1]。
肿瘤转移是复杂的过程,需要多个步骤:肿瘤细胞间的黏附连接被破坏,肿瘤与胞外基质的黏附增加,金属蛋白酶分泌增多,肿瘤细胞穿过基底膜进入血管,之后随着血液流动进入其他组织形成新的转移灶。可见,肿瘤细胞间连接和细胞与基质间的黏附连接对于肿瘤的转移具有重要的意义。研究发现,Rap1通过结合下游效应分子Radil影响整合素激活、聚集,进而影响细胞延展、黏附和迁移过程,对肿瘤转移有着重要的作用。敲低Radil可以有效降低乳腺癌细胞的迁移、侵袭能力,并阻断乳腺癌的发展。过表达Radil可以促进乳腺癌细胞的增殖,并促进乳腺癌到肺脏的转移[2],本研究发现Radil在肝癌组织中高表达,其高表达可促进肝癌细胞增殖,增加肝癌细胞的运动能力,对肝癌发展具有促进作用。
Rap1是小分子G蛋白Ras家族中的一员,研究发现其活化后构象发生改变,与下游效应分子结合将信号转导到细胞核中,参与激活多种信号通路,促进黏附连接的形成,影响细胞的增殖、极性、运动等多种生物学功能。Radil是新发现的Rap1分子下游效应分子之一,首次在神经鞘前体细胞中发现,低表达时可以显著降低细胞的黏附能力,是神经鞘前体细胞黏附、运动的必需分子[3]。Radil可与Rap1、Gβγ亚基结合形成复合物,并使其从胞质转移到细胞与基质黏附处, 促进细胞与基质的黏附连接。Radil过表达可以激活整合素,通过与胞外基质的黏附影响中性粒细胞的趋化作用。并激活局部黏着斑激酶(FAK)信号通路,促进间质细胞对纤连蛋白的黏附。敲低Radil可以减弱fMLP受体对细胞黏附的影响[4]。Rap1有多个效应分子,其他常见的效应分子有以下3种。(1)B-Raf,可以与Rap1结合,并被激活,但其具体的生物学功能与细胞类型、生长条件有关;(2)Ra-1,其可以与Rap1结合,但不被激活,与Rap1的结合导致了其不能与Ras结合,从而阻断了Ras信号的转导;(3)AF-6,其与Rap1结合后促进Rap1从核膜转而定位到细胞膜,进而通过整合素调节细胞的黏附作用。研究发现,这些效应分子中只有Radil对细胞延伸有作用,但不同效应分子间功能是否有交叉和不同,仍需要更多的研究。
综上所述,Radil通过影响细胞延伸、黏附连接影响肿瘤细胞的运动能力,进而影响肿瘤的转移、复发,通过对Radil水平的检测,将有助于了解肿瘤的恶性程度和转移能力。
