IL-6/CTRP3对急性脑梗死出血性转化的预测价值
2020-09-11张丽梅李曙光
沈 茹, 张丽梅, 李曙光
安徽省亳州市人民医院神经内科,亳州 236800
脑梗死出血性转化(hemorrhagic transfor-mation, HT)是指急性脑梗死患者的梗死病灶及其周围区域出现继发出血。缺血性脑卒中患者中,HT是一种常见并发症,其发生率为10%~40%[1-4],HT发生后会进一步加重神经功能缺损,严重影响脑梗死患者预后,造成严重的家庭及社会负担。
有研究表明,缺血性脑卒中发生后会出现炎症反应,众多炎症因子会对血脑屏障(blood-brain barrier, BBB)造成损伤,是导致HT发生的重要因素。近年来越来越多的研究表明缺血性脑卒中引起的炎症反应对临床预后及预测HT的发生有重要价值[5-8]。而目前尚无预测HT的可靠指标。本研究通过检测患者血清中炎症因子的变化,探讨血清炎症因子在HT过程中的作用,进而为HT的预测及治疗提供理论基础。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月至2020年1月我院神经内科收治的急性脑梗死患者相关临床资料,脑梗死的诊断依据为中国急性脑梗死后出血转化诊治共识2019[9],出血转化是指急性脑梗死后缺血区血管重新恢复血流灌注导致的出血,包括自然发生的出血(自发性出血转化)和采取干预措施后(包括溶栓、取栓和抗凝等)的出血(继发性/治疗性出血转化),定义为:脑梗死后首次头颅CT/MRI未发现出血,而再次头颅CT/MRI检查时发现有颅内出血。病例纳入标准:(1)急性脑梗死患者,神经定位体征明确;(2)年龄18~75岁;(3)患者发病24 h内入院,并且患者为首次发病;(4)患者或家属知情同意。排除标准:(1)首次头颅影像学检查证实为单纯出血患者;(2)有凝血因子缺乏或功能异常病变者;(3)有传染性疾病史或现症感染;(4)合并严重的心肝肾功能衰竭及肿瘤等。所有诊治均获得本院伦理学委员会许可,并获得患者知情同意。
1.2 研究方案 发病24 h内行头颅CT或MRI,根据是否发生脑梗死出血转化将患者分为HT组和非HT组。收集两组患者详细资料,包括年龄、性别、BMI、吸烟史、高血压病史、糖尿病史、神经功能缺损程度(NHISS评分)及影像学检查结果,包括梗死部位及梗死面积。患者入院后即采集肘静脉血,检测炎症因子,包括IL-1β、IL-6、TNF-α、CTRP3。比较两组患者临床资料、炎症因子差异,将各项资料纳入至脑梗死出血转化发生的危险因素进行logistic回归分析,得出脑梗死出血转化的独立性危险因素。
1.3 炎症因子检测 血清IL-1β、IL-6、TNF-α、CTRP3的检测方法:所有患者入院后即接受血清炎症因子水平检测。空腹、静息、卧位状态下抽取外周静脉血,共3 mL置于真空抗凝管中,ELISA法检测血液标本中IL-1β、IL-6、TNF-α、CTRP3水平,方法如下:血液标本3 mL,3 000 r/min离心10 min,分离血清,4℃保存备用,利用美国贝克曼库尔特有限公司生产的AU5800型全自动生化分析仪对血清炎症因子进行检测。测定试剂盒均购自北京艾媚丽生物科技有限公司。
1.4 梗死灶分型标准 根据Adama分型标准,大梗死灶定义为:梗死面积>3 cm2或累及2个及以上大动脉供血区;小梗死灶定义为:梗死面积≤3.0 cm2且累及1个小动脉分支供血区[10-11]。
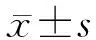
2 结 果
2.1 两组患者基本资料分析 最终纳入HT组患者31例,纳入非HT组患者71例,两组性别、年龄、BMI、吸烟史、高血压病史、糖尿病史、梗死部位,脑梗死发病到采血时间间隔无明显差异。HT组中NIHSS评分(21.7±11.2)分,非HT组中NIHSS评分(13.4±5.2)分,HT组中NIHSS评分明显高于非NIHSS评分(P<0.05)。HT组中大面积梗死灶有22例(71.0%),明显高于非HT组(17例,23.9%,P<0.05),见表1。
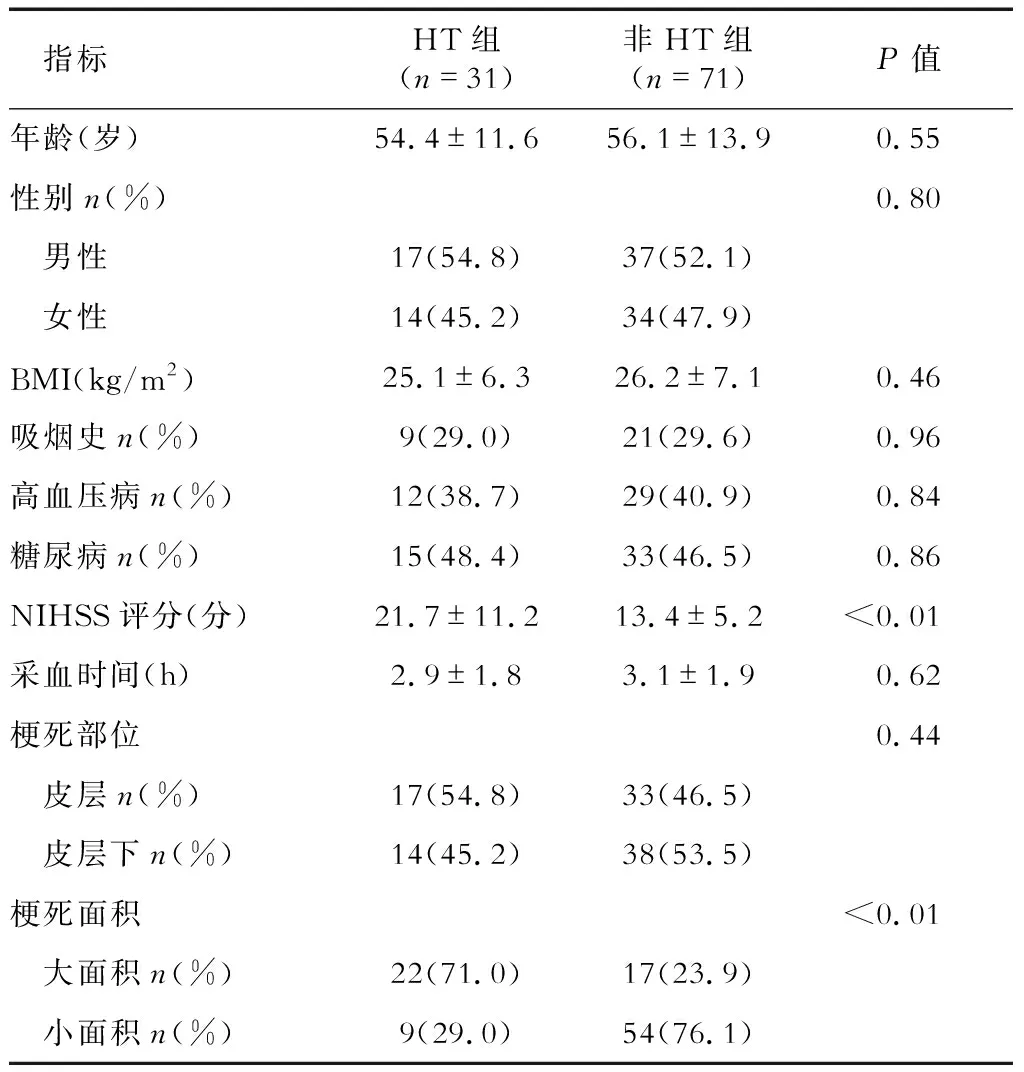
表1 患者基本临床资料比较
2.2 两组血清炎症因子水平比较 HT组中IL-1β、IL-6、TNF-α、CTRP3浓度水平分别为(78.9±10.9)pg/mL、(45.6±11.2)ng/mL、(71.9±12.1)ng/mL、(213.5±61.8)ng/mL。非HT组中IL-1β、IL-6、TNF-α、CTRP3浓度水平分别为(21.2±8.9)pg/mL、(11.3±7.8)ng/mL、(19.6±8.9)ng/mL、(411.2±75.8)ng/mL。HT组中IL-1β、IL-6、TNF-α水平明显高于非HT组,而CTRP3水平明显低于非HT组(P<0.01),见表2。
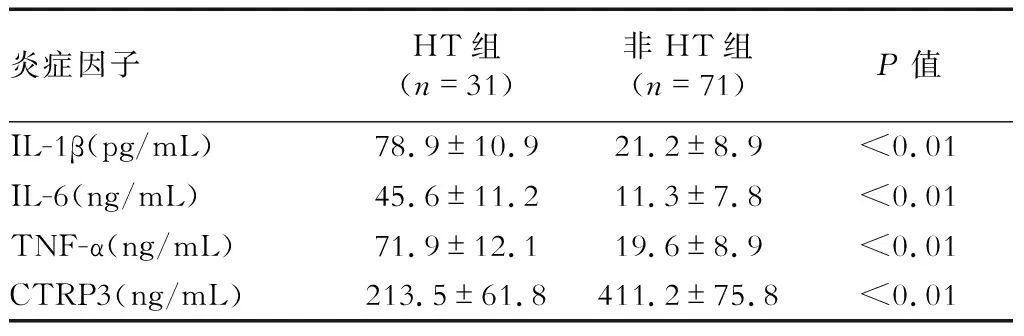
表2 两组患者血清炎症因子水平比较
进一步分析以上炎症因子与NIHSS评分的相关性,IL-1β、IL-6及TNF-α与NIHSS评分正相关,CTRP3与NIHSS评分负相关(图1)。

图1 炎症因子与NIHSS评分的相关性
2.3 关于HT的logistic回归 两组中炎症因子及梗死面积均有明显差异,将以上因素纳入logistic回归,发现IL-6(OR=1.63,P<0.01),TNF-α(OR=1.30,P<0.01)及梗死面积(OR=1.05,P=0.015)均为HT的危险因素,而CTRP3(OR=0.09,P=0.022)为保护因素(表3)。
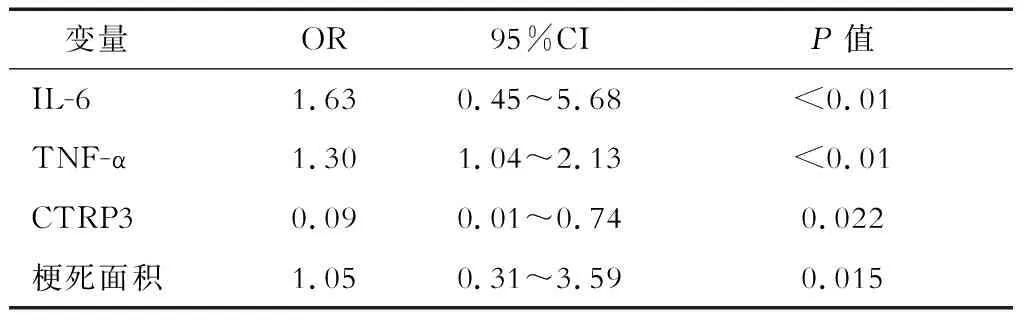
表3 脑梗死出血性转化的独立危险因子多因素logistic回归分析
分别计算以上变量及IL-6/CTRP3、TNF-α/CTRP3的ROC曲线下面积、特异度、敏感度。计算发现以上变量均可有效预测HT的发生(表4),其中IL-6/CTRP3的AUC、特异性及敏感性分别为0.91、0.89、0.96,其预测HT的可靠性明显高于其他变量(图2)。
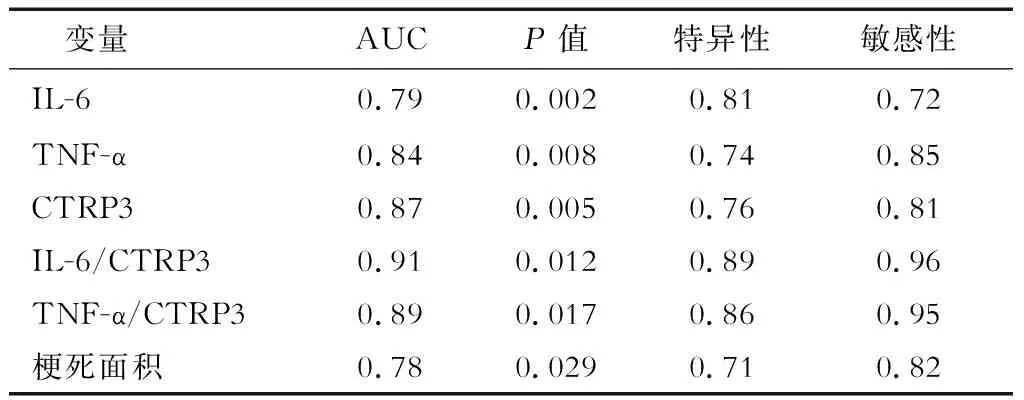
表4 不同预测指标的ROC曲线
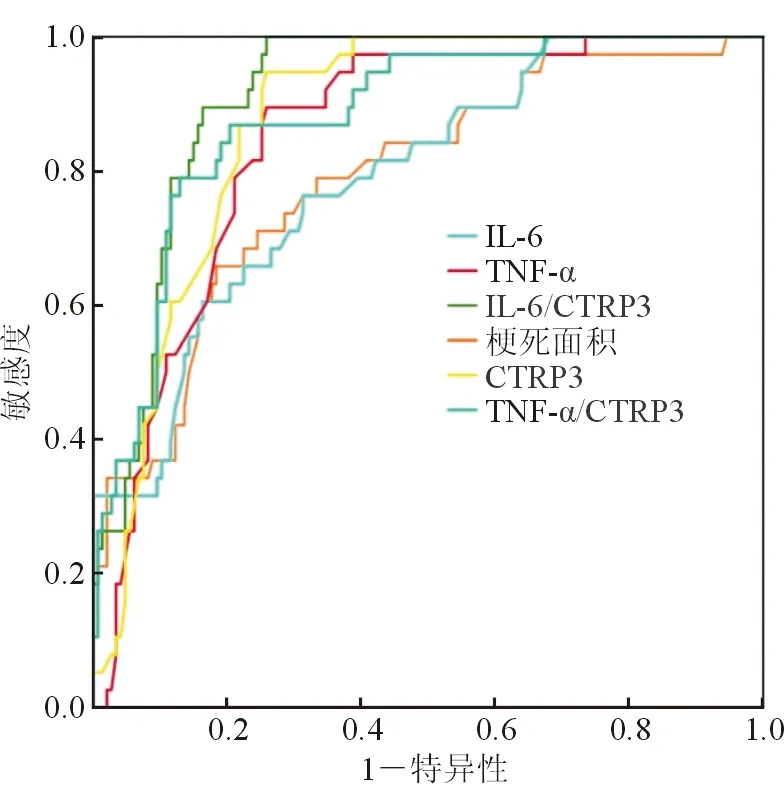
图2 各变量的ROC曲线
3 讨 论
当前,炎症反应在急性脑梗死生理、病理中的作用越来越受到重视。HT过程中,脑血管梗阻导致大脑组织缺血、缺氧,从而诱发级联炎症反应,并加重脑损伤。由于大量炎症因子陆续释放,导致血管功能的过度活化,炎症反应使血管通透性增加,最终导致破裂出血[12-17]。HT是缺血性脑卒中的一种常见并发症,出血既可在梗死区内,也可在远隔梗死区的部位发生,根据神经功能恶化的表现,HT可分为症状性与非症状性颅内出血。临床中发现即使是无症状性HT,也会严重影响患者的预后,对患者及家庭造成难以估量的打击,而有效地预防HT可以明显改善患者的预后,明显减轻家庭及社会的负担。然而,临床上仅仅根据有无症状对HT进行分型并不能有效地反映HT的病理生理学及发病机制。而目前仍缺少早期预测HT的指标。因此对HT的早期防治及治疗造成了很大困难,对后期的治疗也形成了障碍。
已有研究证实氧化应激及炎症反应在HT的发生起重要作用。脑梗死发作后的缺血期及缺血再灌注期均可以促进炎症因子的产生和聚集,而炎症因子可明显降低谷胱甘肽的水平,进一步加剧氧化应激反应,从而形成正反馈,造成局部的炎症瀑布。进一步的研究表明氧化应激产生活性氧(reactive oxygen species, ROS)或炎症因子等均可以破坏血脑屏障,造成其通透性增加,从而在HT发生扮演重要角色。有关分子机制研究表明氧化应激可以激活NFκB、AP-1等信号通路,从而增加MMP9的表达及影响DNA修复酶,触发凋亡通路活化,促进内皮细胞凋亡,增加血脑屏障通透性[12,18-19]。TNF-α、IL-1和IL-6等炎症因子可以通过一系列炎症信号途径促进MMPs分泌,而MMPs可以加速溶解细胞外基质,损伤血脑屏障,从而促使炎症细胞及炎症因子的外渗,使局部产生更多炎性介质,形成的正反馈会对血脑屏障造成严重破坏,从而形成了HT的结构基础[20-22]。本研究分析了炎症因子与HT发生的相关性,发现IL-1β、IL-6及TNF-α与NIHSS评分呈正相关,logistic回归发现IL-6,TNF-α及梗死面积均为HT的危险因素,且可有效预测HT的发生。
有研究[23]表明CTRPs在免疫调控、心血管、内分泌等疾病发生中有重要的作用。众多CTRPs中,受到关注最多的是CTRP3,急性冠脉综合征患者血清中CTRP3浓度较健康对照组明显降低,表明CTRP3在急性冠脉综合症发病过程中发挥重要作用,提示CTRP3水平可作为急性冠脉综合症的潜在预测因子。同时有研究表明CTRP3可以通过减少巨噬细胞中多种促炎细胞因子达到改善动脉粥样硬化的目的[24-25]。综合以上论述,CTRP3可以通过对抗炎症反应,对心脑血管起调节与保护作用。本研究发现CTRP3与NIHSS评分呈负相关,logistic回归发现CTRP3为HT的保护因素。进一步分析了IL-6/CTRP3、TNF-α/CTRP3对HT的预测作用,发现IL-6/CTRP3的AUC、特异性及敏感性明显优于其他变量,是预测HT的可靠性指标。
综上所述,本研究发现炎症因子在HT发生中发挥重要作用,而众多危险因素中,IL-6/CTRP3预测HT的可靠性明显高于其他变量。
