稳定期慢阻肺患者合并肌少症时对其生活质量的影响
2020-09-10石劢吕春健赵凤梅李海燕李玉梅任晓霞
石劢 吕春健 赵凤梅 李海燕 李玉梅 任晓霞
摘 要:目的:调查稳定期慢阻肺患者肌少症的发生情况,分析造成其生活质量下降的影响因素。方法:对220例稳定期慢阻肺患者开展肺功能、体成分、握力、6min步行速度及生活质量问卷(SF-36)等调查,按照亚洲肌肉衰减综合征工作组肌少症的定义诊断出合并肌少症的患者,分析肌少症对患者生活质量各方面的影响。结果:稳定期慢阻肺患者的生活质量下降,生理领域的影响因素包括年龄、性别、家庭成员是否关注、是否开展康复训练、病程、呼吸困难分级(mMRC)、GOLD分级、是否多重用药、低体重、营养素摄入不足、肌少症;心理领域的影响因素包括年龄、性别、家庭收入、家庭成员是否关注、是否开展康复训练、病程、mMRC分级、GOLD分级、是否多重用药、低體重、营养素摄入不足、肌少症。稳定期慢阻肺患者肌少症的发生率为23.18%(51/220),男女性患者的发生率分别为18.32%(24/131)和30.34%(27/89),存在统计学差异(χ2=4.297,P=0.038)。肌少症是患者生活质量的重要影响因素,体现在SF-36各领域评分均存在统计学差异(P均<0.001)。结论:肌少症严重影响慢阻肺患者的生活质量,应重视对患者的骨骼肌质量及功能的评估,营养支持是康复治疗的基础。
关键词:慢性阻塞性肺疾病;肌少症;四肢骨骼肌质量指数;生活质量;营养支持
慢性呼吸系统疾病的危害不仅在于肺功能的受损,还表现为全身各组织器官的伴发症状出现并加重,其中营养失衡在全身表现中更加突出[1]。近年来,越来越多的学者呼吁,慢性呼吸系统疾病患者出现营养失衡且进一步加重时,应进行人体测量,评估身体成分的变化[2]。呼吸系统疾病的营养失衡通常包括肌肉质量的丧失,这是肌肉功能障碍发生的重要因素,与肌肉力量和耐力有关,对患者的生活质量和预后产生负面影响[3-5]。亚洲肌肉衰减综合征工作组(AWGS)综合考虑了骨骼肌质量指数、握力、6 min步行速度三项指标,给出肌少症的诊断[6]。本研究旨在发现稳定期慢阻肺患者中肌少症的发生情况,分析慢阻肺合并肌少症对患者生活质量的影响程度,为慢阻肺营养评估方法提供科学依据。
1 对象与方法
1.1 研究对象
选择2018年7月—2019年12月随访的200例稳定期慢性阻塞性肺疾病(COPD)患者。COPD的诊断符合中华医学会《慢性阻塞性肺疾病诊治指南》(2013年修订版)[7]诊断标准。患者的年龄为44~88岁,平均年龄68.03±6.67岁。200例患者均进行一般资料、人体成分分析、肺功能检查、6 min步行速度(6MWT)、mMRC及SF-36的调查。
1.1.1 纳入标准 第一诊断为 COPD 稳定期的患者,符合第1秒用力呼气容积占预计值百分比(FEV1%)<70%;不论患者年龄大小、病程长短。所有纳入的 COPD 患者必须是经调查者讲解后,能够理解并独立完成肺功能、人体成分、握力、6MWT、mMRC、SF-36问卷的患者。
1.1.2 排除标准 COPD急性加重期,合并有急性心肌梗死,脑梗死,充血性心力衰竭,严重肝、肾慢性疾病和肿瘤;严重的肌肉骨骼疾病导致身体活动能力受限;老年痴呆,意识不清晰,有精神障碍或神经病史;填写问卷有困难、无法正常交流者。
1.2 方法
1.2.1 社会学资料、疾病情况、生活习惯问卷调查 患者自行填写,内容包括年龄、婚姻状况、文化程度、职业性质、家庭收入、家庭成员是否关注、病程、合并症、联合用药、健康教育、康复训练、运动习惯、睡眠质量、吸烟、饮酒、膳食摄入情况等。
1.2.2 肌少症诊断 按照AWGS[6]对肌少症的定义,分别对每位患者进行人体成分、6MWT的测定。判定标准:四肢骨骼肌质量指数(ASMI)采用BIA法,男性<7.00 kg/m2、女性<5.70 kg/m2;握力:男性<26 kg、女性<18 kg;6MWT<0.8 m/s。(1)采用韩国杰文IOI353人体成分分析仪测量人体成分,取体质量指数(BMI,kg/m2)、ASMI(kg/m2)。(2)采用Camry电子握力计测量患者主力手的最大握力,嘱其站立位,用最大力度握柄,测量2次,取最大值,单位kg。(3)6MWT:要求测试区域地面坚硬、笔直平坦、折返长度为30 m,测试时无干扰。试验时,按下计时器计时的同时,患者自起点开始根据自身情况按日常活动步速行走,在30 m终点处转身折返,每次患者回到起点均应记录往返的周期数。试验过程中,如果患者出现疲乏、头晕、胸痛、不能耐受的呼吸困难、下肢抽搐、出冷汗、面色苍白等,应立即停止试验。试验结束时,喊“停”并让患者停止不动,在患者停下的位置做标记。试验结束后,计算患者的6MWT。
1.2.3 肺功能检查 选用德国耶格公司生产的 Master Screen 肺功能仪,支气管舒张剂选用葛兰素史克公司生产的硫酸沙丁胺醇气雾剂。在吸入支气管舒张剂后FEV1/FVC<70%表明存在气流受限。根据GOLD分级标准将200例患者分为Ⅰ~Ⅳ共四级,对应气流受限程度为轻度、中度、重度、极重度。
1.2.4 呼吸困难分级 采用英国医学研究委员会呼吸困难量表评价患者的呼吸困难严重程度。分为0~4共五个分级,由患者根据自身状况自行选择分级。mMRC分级≥2表明症状较重。
1.2.5 生活质量调查[8] SF-36从生理机能(PF)、生理职能(RP)、躯体疼痛(BP)、一般健康状况(GH)、精力(VT)、社会功能(SF)、情感职能(RE)、精神健康(MH)等8个方面全面概括了被调查者的QOL。其中,PF、RP、BP、GH属于生理(PCS)领域;VT、SF、RE、MH属于心理(MCS)领域。问卷的计分是先计算原始分数,再用标准化公式计算转化分数。每一方面、各个领域最大可能评分为100分,最小可能评分为0分。得分越高,所代表的生命质量越好。
1.3 统计学方法
数据采用SPSS 17.0软件包进行统计学分析。计量资料以±s表示,计数资料以计数或率表示,考察各组间观察指标是否存在统计学差异时,正态分布资料用t检验或单因素方差分析,非正态分布资料用非参数检验。所有统计资料均采用双侧检验,P<0.05认为差异存在统计学意义。
2 结果与分析
2.1 人口学资料
调查期间共220例患者符合纳入标准,年龄为44~88岁,平均年龄68.03±6.67岁;其中男性患者131人,占59.55%,女性患者89人,占40.45%。男女患者在年龄、婚况、文化程度、职业性质、GOLD分级、mMRC方面未见统计学差异。
2.2 稳定期慢阻肺患者的肌少症发生情况
按照AWGS的肌少症定义,本次研究对象的肌少症发生率为23.18%(51/220)。男性患者的发生率为18.32%(24/131),女性患者的发生率为30.34%(27/89),男女患者发生肌少症存在统计学差异(χ2=4.297,P=0.038)。
2.3 稳定期慢阻肺患者生活质量的受损情况
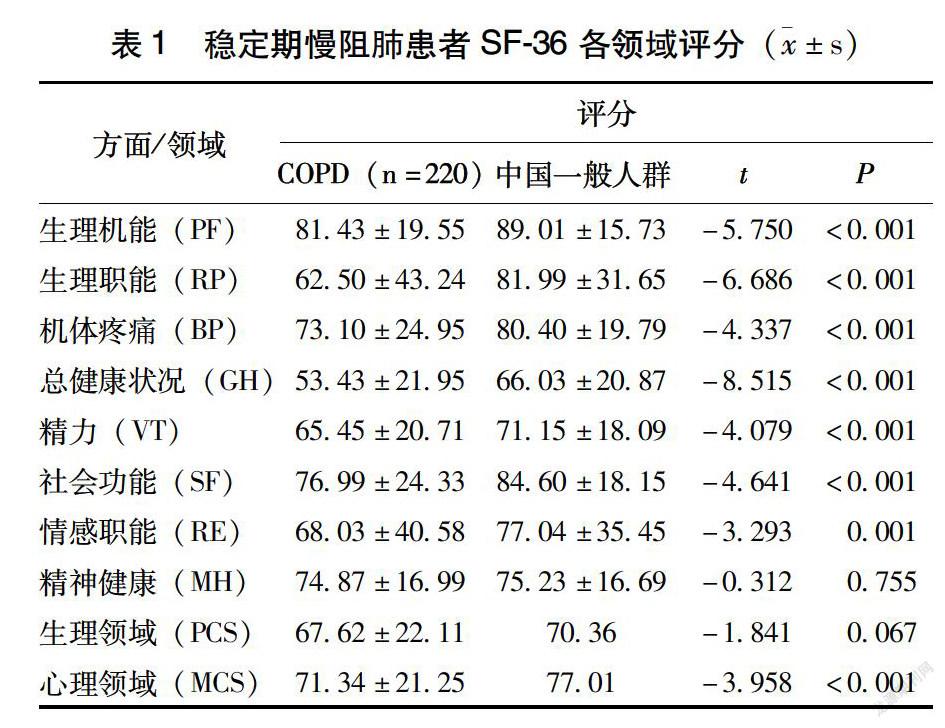
与中国一般人群常模比较,除MH、PCS外,慢阻肺患者的PF、RP、BP、GH、VT、RE 6个方面以及MCS领域评分均较低,具有统计学差异(P<0.01)(表1)。
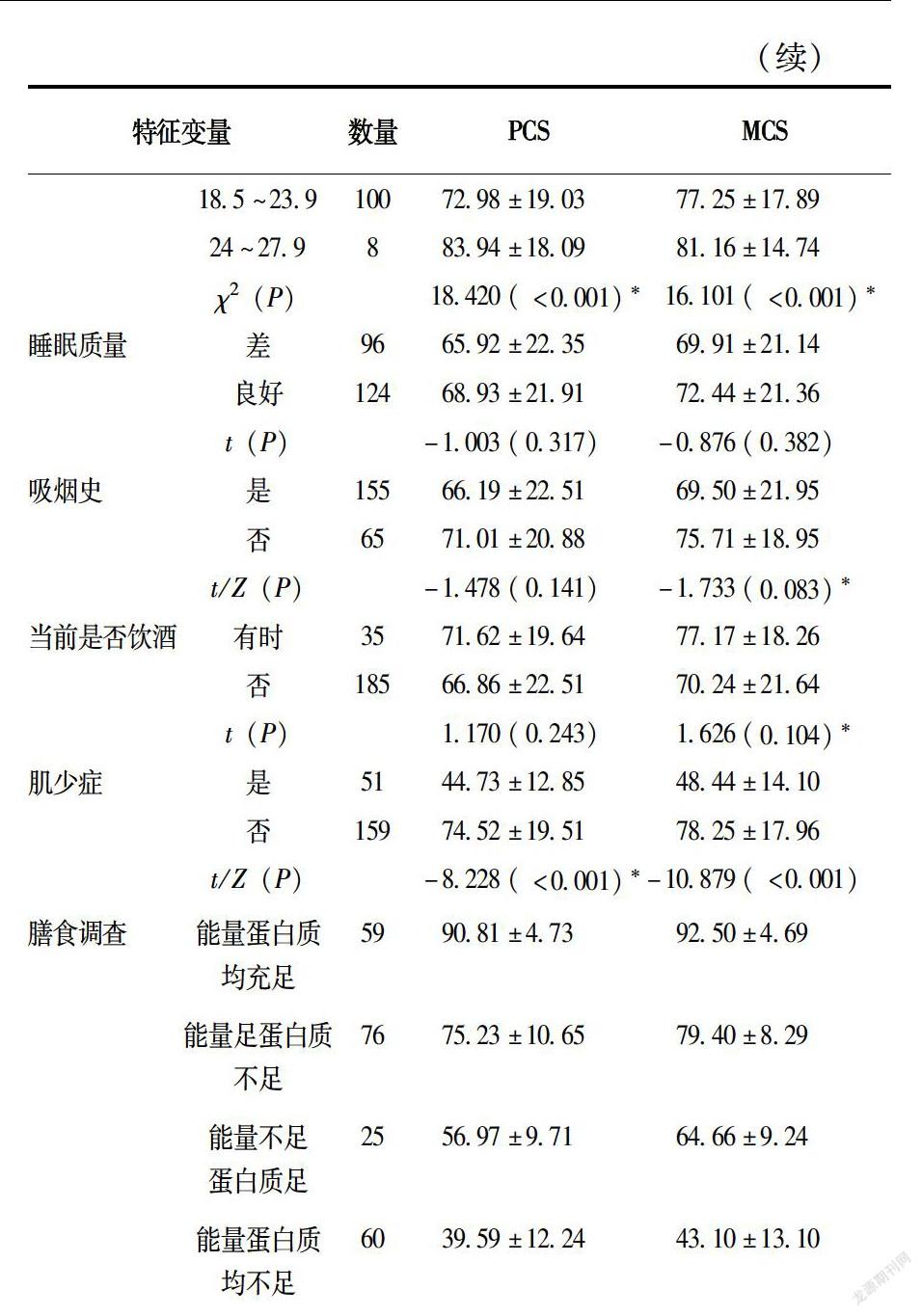
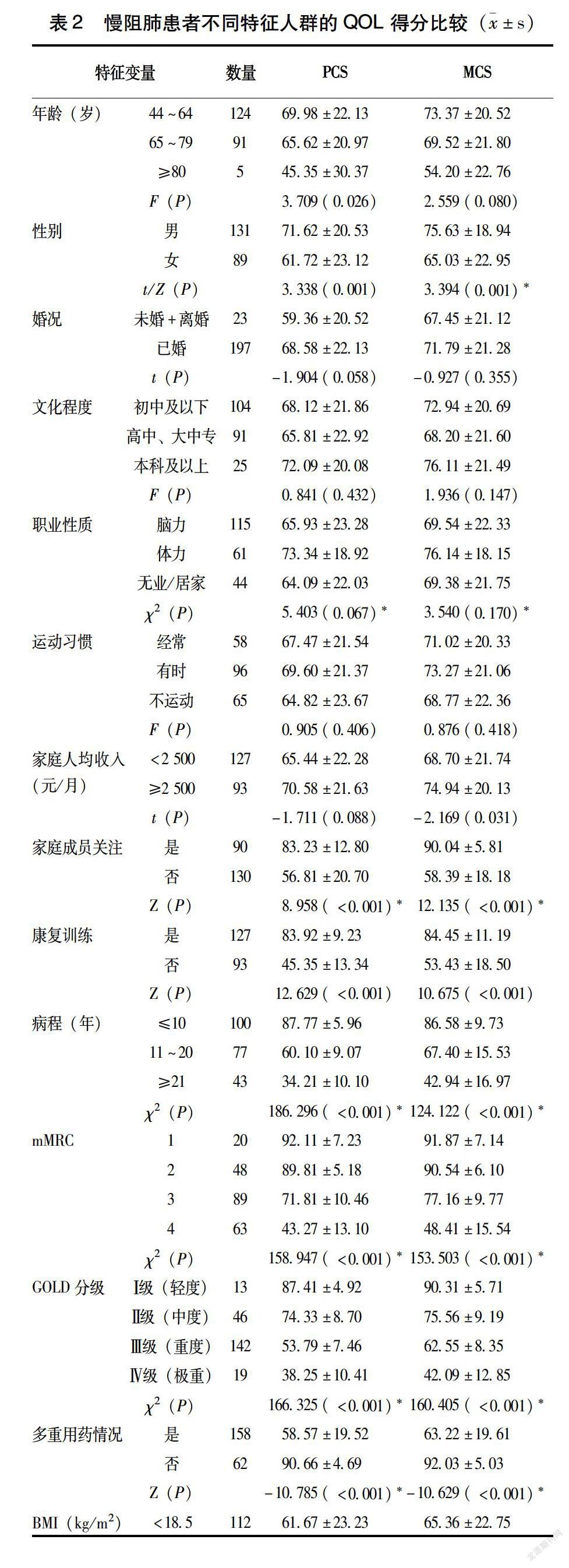
2.4 稳定期慢阻肺患者生活质量的单因素分析
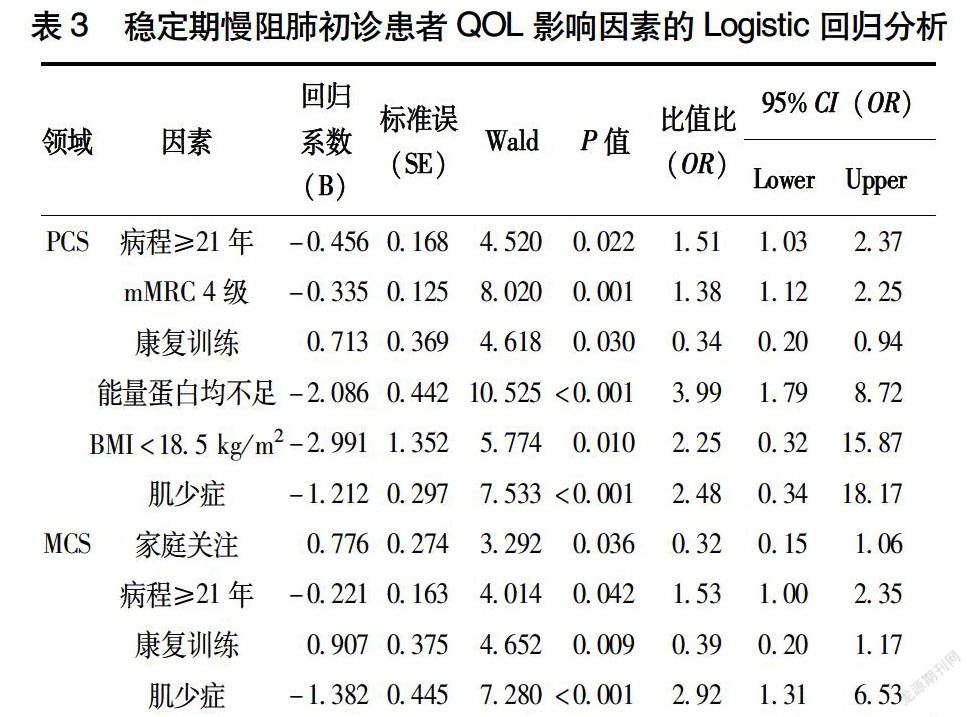
2.5 稳定期慢阻肺患者生活质量的多因素分析
将单因素分析中P<0.05的变量纳入多因素Logistic回归模型分析。稳定期患者PCS的正向影响因素包括康复训练,负向影响因素包括病程长、mMRC分级、营养摄入不足、低体重和合并肌少症。MCS的正向影响因素包括家庭关注和康复训练,负向影响因素包括病程长和合并肌少症(表3)。
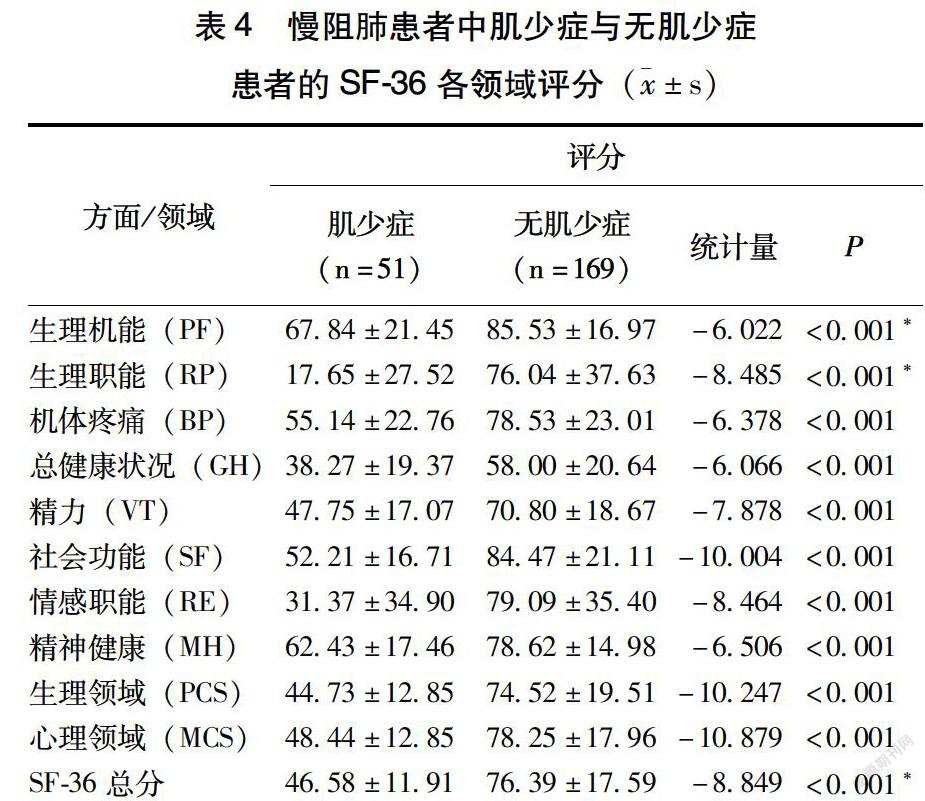
2.6 肌少症对稳定期慢阻肺患者生活质量的影响
由表4可見,51例合并肌少症的稳定期慢阻肺患者的生活质量受损较严重,表现在与未合并肌少症的患者相比,PF、RP、BP、GH、VT、SF、RE、MH 8个方面差异均具有统计学意义(P<0.001)。
3 讨论
刘爱玲等[9]研究发现,慢阻肺患者的生活质量较我国正常人显著下降,在生理领域表现更为明显,其中年龄、教育程度、肺功能和BMI是影响患者生活质量的因素,建议将SF-36纳入慢阻肺的评估体系中。刘欣欣等[8]研究发现,肺功能各项指标与SF-36量表中3个方面存在相关性,而呼吸困难严重程度则与7个方面存在相关性,因此得出mMRC分级比肺功能指标在慢阻肺生活质量评价中更具预测价值。
营养不良是慢性阻塞性肺病最常见的并发症,且在全身症状中最为直观,表现为能量和营养素摄入不足[10]。一方面,来自北美和中欧北部的慢阻肺患者营养不良发生率为15%~50%[11],而地中海地区的发生率较低,只有3%~20%[12],这一差距除了被解释为营养不良的诊断标准不同外,不同的生活方式也是重要的因素[4,13]。值得注意的是,营养缺乏与慢阻肺的肌肉功能障碍密切相关,慢阻肺四肢肌肉障碍患病率为20%~30%,呼吸肌功能障碍患病率为20%~45%[14-15]。营养评估应重视营养状况与机体功能的关系,肌肉质量和力量,以及运动能力的综合评估成为研究热点[16-17]。
2016年,亚洲肌少症工作组明确了肌少症的诊断标准,涉及四肢骨骼肌质量、握力、步速三方面,分别代表了肌肉的质量、力量和功能[18]。除了增龄造成的生理性肌肉减少外,慢阻肺的慢性炎症反应、缺氧、高分解代谢等加重了肌少症的发生,达到15%~40%[17]。慢阻肺急性发作常伴有体重的大幅度下降,进入稳定期的慢阻肺患者同样面临着体重及骨骼肌进一步丢失的风险,本研究发现,稳定期慢阻肺患者肌少症的发生率为23.18%,男女间存在较大的差异,肌少症对患者的生活质量造成了很大的损伤,量表的8个方面(2个领域)均受到累及。肌少症可以作为预测慢阻肺生活质量的指标应用于临床观察。
肌少症与慢阻肺之间存在相关性,对慢阻肺患者开展肌少症筛查,身体成分测定比单纯测量体重更为全面,肌肉功能障碍则需要包括肌肉力量和耐力的测定[19]。慢阻肺的综合治疗应涵盖改善生活习惯、饮食补充剂以及在某些特殊情况下使用促进合成代谢的药物等,营养支持与康复训练有效结合,是延缓疾病进展的关键点,值得重视。
参考文献
[1]Vogelmeier CF,Criner GJ,Martinez FJ,et al.Global strategy for the diagnosis,management and prevention of chronic obstructive lung disease 2017 report:GOLD executive summary[J].Arch Bronconeumol,2017,53(3):128-149.
[2]Gea J,Barreiro E.Nutritional abnormalities and chronic obstructive pulmonary disease[J].Int J Tuberc Lung Dis,2019,23(5):531-532.
[3]Troosters T,Langer D,Vrijsen B,et al.Skeletal muscle weakness,exercise tolerance and physical activity in adults with cystic fibrosis[J].Eur Respir,2009,33(1):99-106.
[4]Matkovic Z,et al.Nutritional status of patients with chronic obstructive pulmonary disease in relation to their physical performance[J].COPD,2017,14(6):626-634.
[5]Gea J,Casadevall C,Pascual S,et al.Clinical management of chronic obstructive pulmonary disease patients with muscle dysfunction[J].J Thorac Dis,2016,8(11):3379-3400.
[6]Chen LK,Liu LK,Woo J,et al.Sarcopenia in Asia:consensus report of the Asian Working Group for Sarcopenia[J].J Am Med Dir Assoc,2014,15(2):95-101.
[7]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
[8]刘欣欣,王浩彦,徐秋芬,等.SF-36在我国COPD患者中应用的评价[J].中国医师进修杂志,2006,29(12):28-30.
[9]刘爱玲,陶晓南,辛建保,等.SF-36量表在COPD患者生存质量评估中的应用[J].中国康复医学杂志,2008,23(11):1017-1021.
[10]Vermeeren MA,et al. Prevalence of nutritional depletion in a large out-patient population of patients with COPD[J].Respir Med,2006,100(8):1349-1355.
[11]Wan ES,et al.Genome-wide association analysis of body mass in chronic obstructive pulmonary disease[J].Am J Respir Cell Mol Biol,2011,45(2):304-310.
[12]Balcells E,Antó JM,Gea J,et al.Characteristics of patients admitted for the first time for COPD exacerbation[J].Respir Med,2009,103(9):1293-1302.
[13]Ausín P,et al.Sex differences in function and structure of the quadriceps muscle in COPD patients[J].Chron Respir Dis,2017,14(2):127-139.
[14]Celli BR,Cote CG,Marin JM,et al.The body-mass index,airflow obstruction,dyspnea,and exercise capacity index in chronic obstructive pulmonary disease[J].N Engl J Med,2004,350(10):1005-1012.
[15]Clark CJ,et al.Skeletal muscle strength and endurance in patients with mild COPD and the effects of weight training[J].Eur Respir J,2000,15(1):92-97.
[16]Jones SE,Maddocks M,Kon SS,et al.Sarcopenia in COPD:prevalence,clinical correlates and response to pulmonary rehabilitation[J].Thorax,2015,70(3):213-218.
[17]Vilaró J,et al.Global muscle dysfunction as a risk factor of readmission to hospital due to COPD exacerbations[J].Respir Med,2010,104(12):1896-1902.
[18]Chen LK,Lee WJ,Peng LN,et al.Recent advances in sarcopenia research in Asia:2016 update from the Asian Working Group for Sarcopenia[J].J Am Med Dir Assoc,2016,17(8):767e1-767e7.
[19]楊光照,汪宇.老年慢性阻塞性肺疾病与肌少症[J].实用老年医学,2020,34(3):209-211.
