含离子交换膜电池的应用
2020-09-10王晓波


摘 要:结合高考题对含离子交换膜电池的应用进行了分析.
关键词:交换膜;离子;电池;高中化学
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2020)10-0092-03
收稿日期:2020-01-05
作者简介:王晓波(1981.4-),男,内蒙古赤峰市人,硕士,中学一级教师,从事高中化学教学研究.
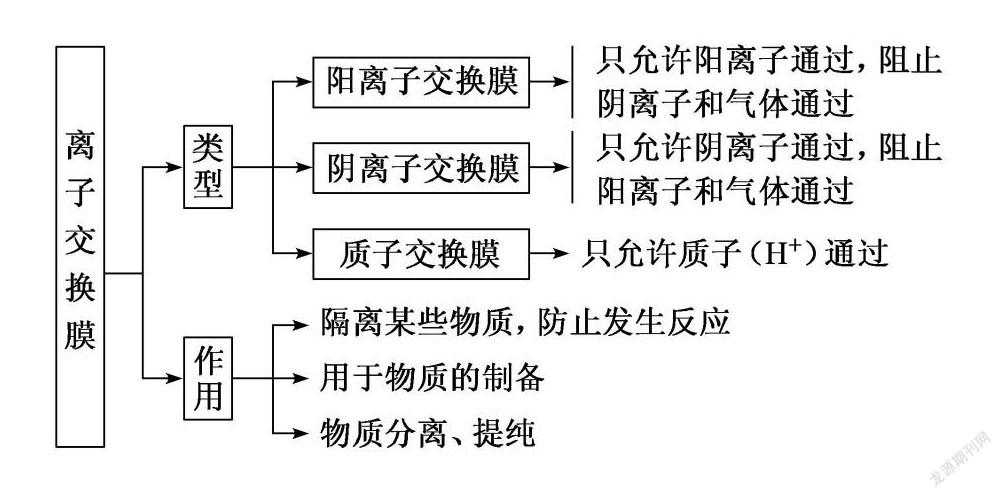
近几年全国卷的高考中,涉及离子交换膜的试题较多,且常考常新.离子交换膜是一种含有离子基团的、对溶液中离子具有选择性透過的高分子膜.根据透过的微粒类型,离子交换膜可以分为多种,在高考试题中,主要出现的是阳离子交换膜(如2018·全国卷ⅠT27、2018·全国卷ⅢT27)、阴离子交换膜和质子交换膜(2018·全国卷ⅠT13、)三种,其功能是在于选择性通过某些离子和阻断某些离子或隔离某些物质,从而制备、分离或提纯某些物质.
一、重难点拨
1.离子交换膜的类型和作用
2.多室电解池
多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的.
(1)两室电解池
①制备原理:工业上利用如图两室电解装置制备烧碱
阳极室中电极反应:2Cl--2e-Cl2↑,阴极室中的电极反应:2H2O+2e-H2↑+2OH-,阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液.利用这种方法制备物质,纯度较高,基本没有杂质.
②阳离子交换膜的作用
它只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过.这样既防止了两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量.
(2)三室电解池
利用三室电解装置制备NH4NO3,其工作原理如图所示.
阴极的NO被还原为NH+4:NO+5e-+6H+NH+4+H2O,NH+4通过阳离子交换膜进入中间室;阳极的NO被氧化为NO-3:NO-3e-+2H2ONO-3+4H+,NO-3通过阴离子交换膜进入中间室.根据电路中转移电子数相等可得电解总反应:8NO+7H2O通电3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,补充适量NH3可以使电解产生的HNO3转化为NH4NO3.
(3)多室电解池
利用“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示.
电解稀硫酸的阳极反应:2H2O-4e-O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO-2穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应:4H2O+4e-2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室.
二、考法精析
应用一 用于物质的分离和提纯
典例1 一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法不正确的是( ).
A.Cl-由中间室移向左室
B.X气体为CO2
C.处理后的含NO-3废水的pH降低
D.电路中每通过4 mol电子,产生标准状况下X气体的体积为22.4 L
解析 该电池中,NO-3得电子发生还原反应,则装置中右边电极是正极,电极反应为2NO-3+10e-+12H+N2↑+6H2O,装置左边电极是负极,负极上有机物失电子发生氧化反应生成X,电极反应C6H10O5-24e-+7H2O6CO2↑+24H+.放电时,电解质溶液中阴离子Cl-移向负极室(左室),A项正确;X气体为CO2,B项正确;正极反应为2NO-3+10e-+12H+N2↑+6H2O,H+参加反应导致溶液酸性减弱,溶液的pH增大,C项错误;根据负极电极反应C6H10O5-24e-+7H2O6CO2↑+24H+知,电路中每通过4 mol电子,产生标准状况下CO2气体的体积为4 mol24×6×22.4 L·mol-1=22.4 L,D项正确.答案:C
备考方略 含离子交换膜电化学装置题的解题步骤(如图所示).
应用二 用于物质的制备
类型一 判断离子的迁移方向
典例2 (1)(2018·全国卷Ⅲ节选)KIO3可采用“电解法”制备,装置如图所示.
①写出电解时阴极的电极反应式
.
②电解过程中通过阳离子交换膜的离子主要为,其迁移方向是
.
(2)(2018·全国卷Ⅰ节选)制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3.阳极的电极反应式为.电解后,室的NaHSO3浓度增加.将该室溶液进行结晶脱水,可得到Na2S2O5.
解析 (1)①该装置为电解池,电解时阴极电解质为KOH,水中氢离子放电,故电极反应式为2H2O+2e-2OH-+H2↑;②电解过程中通过阳离子交换膜的离子主要为K+,在电解池中离子移动方向为阳离子移向阴极,故K+由a到b.(2)根据题中的图示,左侧为电解池的阳极,右侧为电解池的阴极,离子交换膜均为阳离子交换膜,只允许阳离子通过,阳极的电解质溶液为硫酸,所以阳极的电极反应式为2H2O-4e-4H++O2↑,则阳极的氢离子会透过阳离子交换膜进入a室,与a室中的SO2碱吸收液中含有的Na2SO3发生反应生成NaHSO3,所以a室中的NaHSO3浓度增加.
答案:(1)①2H2O+2e-2OH-+H2↑ ②K+ a到b (2)2H2O-4e-4H++O2↑ a
备考方略 有“膜”条件下离子定向移动方向的判断方法(如图所示).
类型二 判断离子交换膜的类型
典例3 四室式电渗析法制备盐酸和NaOH的装置如图所示.a、b、c为阴、阳离子交换膜.已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过.下列叙述正确的是( ).
A.b、c分别依次为阳离子交换膜、阴离子交换膜
B.通电后Ⅲ室中的Cl-透过c迁移至阳极区
C.Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D.电池总反应为4NaCl+6H2O通电4NaOH+4HCl+2H2↑+O2↑
解析 由图中信息可知,左边电极与负极相连为阴极,右边电极为阳极,所以通电后,阴离子向右定向移动,阳离子向左定向移动,阳极上H2O放电生成O2和H+,阴极上H2O放电生成H2和OH-;H+透过c,Cl-透过b,二者在b、c之間的Ⅲ室形成盐酸,盐酸浓度变大,所以b、c分别为阴离子交换膜和阳离子交换膜;Na+透过a,NaOH的浓度变大,所以a也是阳离子交换膜,故A、B两项均错误;电解一段时间后,Ⅰ中的溶液的c(OH-)升高,pH升高,Ⅱ中为NaCl溶液,pH不变,Ⅲ中有HCl生成,故c(H+)增大,pH减小,Ⅳ中H+移向Ⅲ,H2O放电生成O2,使水的量减小,c(H+)增大,pH减小,C不正确.答案:D
备考方略 离子交换膜类型的判断方法:
根据电解质溶液呈中性的原则,判断膜的类型,判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型,如电解饱和食盐水时,阴极反应式为2H++2e-H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,与OH-结合生成NaOH,故电解食盐水中的离子交换膜是阳离子交换膜.
参考文献:
[1]王晓波.化学反应原理综合应用[J].数理化解题研究,2019(25):86-87.
[责任编辑:季春阳]
