基于碳纳米管信号放大的卡那霉素高灵敏分析方法的建立
2020-09-10韦达理康启鑫张旭芸
韦达理, 曾 昆*, 康启鑫, 黄 哲, 张旭芸
(1. 农业农村部 农产品质量安全环境因子控制重点实验室,天津300191;2. 江苏大学 环境与安全工程学院,江苏 镇江212013)
氨基糖苷类抗生素主要包括卡那霉素、 链霉素、庆大霉素等[1],其中卡那霉素具有良好的抗菌性[2],被广泛应用于农业,畜牧业,水产业以及医药行业[3]。 然而卡那霉素对耳、肾等比较敏感和脆弱的部位有明显的毒性,易引起过敏反应,还会导致耐药菌的出现,加大治疗难度[4]。 欧盟规定牛奶中卡那霉素最高残留限量(Maximum Residue Limit,MRL)为150 ng/mL[5],因此检测食品中卡那霉素的残留很有必要。
目前, 在抗生素和卡那霉素的检测方法方面,主要集中为高效液相色谱法 (High-Performance liquid Chromatography,HPLC)[6-7]、液相色谱法(Liquid Chromatography,LC)[8-10]、 毛细管电泳法(Capillary Electrophoresis,CE)[11-13]、微生物抑制法[14-16]和 免疫 分析方法[17-18]等。 然而这些方法存在仪器昂贵,操作复杂,灵敏度较低等不足,无法满足检测要求[19]。 而免疫分析方法因其具备快速、简便、高通量等优势被广泛应用于检测领域[20]。 目前,电化学分析方法发展迅速,已有基于电化学方法检测卡那霉素的报道[21-24]。
近年来,许多新型纳米材料以及其特性被不断发掘,并成功应用于物理、化学和材料等领域。 纳米材料因其具有尺寸较小,比表面大等优势被广泛应用于免疫分析方法中。 如胶体金、碳纳米管、磁性微球、乳胶微球等在检测领域得到了广泛应用[25-28]。 作者经过小鼠免疫,血清测定,细胞融合和杂交瘤细胞筛选等步骤成功制备得到卡那霉素单克隆抗体,并引入碳纳米管(Carbon Nanotube)多酶探针,建立了检测食品中卡那霉素残留的分析方法,并成功应用于牛奶样本的检测中,为开发简便快速、高灵敏的食品检测免疫分析方法提供了参考。
1 材料与方法
1.1 材料与试剂
硫 酸 卡 那 霉 素 (Kanamycin)、 庆 大 霉 素(Gentamicin)、链霉素(Streptomycin):购自中国药检所; 羊抗鼠酶标二抗: 购自美国Jacket 公司;EDC·HCl、明胶和3,3',5,5'-四甲基联苯胺(3,3',5,5'-Tetramethylbenzidine,TMB) 购自美国Sigma 公司;NaHCO3、KH2PO4、Na2HPO4·12H2O、NaCl、KCl、Tween-20、H2SO4、DMSO、H2O2:购自国药集团;卡那霉素单克隆抗体:作者所在实验室制备[31]。
1.2 仪器与设备
多功能酶标仪Infinite M1000 PRO: 奥地利Infinite 公司产品; 磁力搅拌器C-MAG HS4: 德国IKA 公司产品; 低温高速离心机5415D: 德国Eppendorf 公司产品。
1.3 实验方法
1.3.1 卡那霉素间接竞争性ELISA 方法的建立
1) 抗原和抗体的最适工作浓度的优化 首先在96 孔板中进行包被操作, 用包被液将包被原稀释 成4个 质 量 浓 度 梯 度, 分 别 为1、0.5、0.25、0.125 μg/mL,4 ℃过夜;第二天倒去酶标板中液体,用PBST 进行洗涤操作, 备用; 然后进行封闭操作(2%质量分数的明胶加入包被液中), 在37 ℃培养箱中反应1.5 h 后备用;随后加入抗体,用抗稀将抗体也稀释成4个质量浓度梯度, 分别为0.4、0.2、0.1、0.05 μg/mL 并加入酶标板中, 加入体积为50 mL,同时加入50 mL 的PBS 缓冲液,并进行两次重复实验,在37 ℃培养箱中反应1 h;去除反应液,用PBST 进行洗涤操作,备用;随后用抗稀将酶标二抗稀释5000 倍后加入酶标板中, 体积为100 mL,在37 ℃培养箱中反应30 min; 随后倒去反应后的二抗溶液,用PBST 洗涤备用;然后加入TMB 显色液,在37 ℃培养箱中反应10~15 min;最后加入体积为50 mL 的硫酸终止液进行终止,孔板中的溶液由蓝色变成黄色,同时在450 nm 处测其吸光度值。
2) 间接竞争性ELISA 标准曲线的建立 用包被液将KAN-OVA 稀释至优化后的质量浓度,100 mL 体积加入酶标板中,4 ℃过夜;随后用PBST进行洗涤操作,备用;然后进行封闭操作(2%质量分数的明胶加入包被液中), 在37 ℃培养箱中反应1.5 h,倒去封闭液后备用;加入稀释后的抗体,同时加入稀释成不同质量浓度梯度的卡那霉素标准品,进行3次重复实验, 在37 ℃培养箱中反应1 h;倒去反应液,用PBST 进行洗涤备用;随后用抗稀将酶标二抗稀释5000 倍后加入酶标板中,100 mL,在37 ℃培养箱中反应30 min;随后去掉反应后的二抗溶液,用PBST 进行洗涤备用;然后加入TMB 显色液,在37 ℃培养箱中反应10~15 min;最后加入体积为50 mL 的硫酸终止液进行终止, 孔板中的溶液由蓝色变成黄色, 同时在450 nm 处测其吸光度值; 使用Origin 绘图软件绘制卡那霉素的间接竞争抑制曲线。
1.3.2 卡那霉素单克隆抗体的纯化采用试剂盒对制备所得的抗体进行纯化,步骤如下:首先将平衡缓冲液(20 mmol/L PBS,pH 7.4)加入层析柱中,等待其自由流出,当之后的流出液和之前所加入的PBS 平衡液一致时则停止; 然后用平衡缓冲液将腹水样品按体积比1∶1 进行稀释后, 将混合溶液慢慢滴加到纯化柱中,等待上样完毕后,继续用平衡缓冲液进行洗涤, 待之后的流出液和之前所加入的PBS 平衡液一致时则停止; 用洗脱缓冲液(CH3COONa,pH 2.0)洗脱,同时收集洗脱液,并用配置好的碳酸钠溶液(1 mol/L)调节所收集到液体的pH 值,保持抗体的活性(pH 值为中性),最后测定纯化后抗体的质量浓度。
1.3.3 MWCNTs-Abs-HRP 多酶探针的合成称取羧基化后的MWCNTs 0.25 mg 至离心管中, 加入250 μL 的双蒸水, 随后使用超声波清洗器将MWCNTs 成功分散于水溶液中, 备用; 随后加入150 μL EDC,150 μL NHS,450 μL MES, 混合搅拌30 min;然后13000 r/min 离心10 min,洗去多余的EDC 和NHS;随后加入1 mL MES 溶液并超声使其重悬, 加入3.1 mg EDC,1.8 mg NHS,0.5 mg NH2-PEG-COOH,混合搅拌2 h 13000 r/min,离心10 min,洗去多余的EDC,NHS 和NH2-PEG-COOH;随后加入1 mL MES 溶液并超声使其重悬, 加入卡那霉素抗体(1 mg/mL)和HRP(1 mg/mL),4 ℃混合搅拌2 h;13000 r/min 状态下进行离心操作,去上清取沉淀, 随后将沉淀重悬于1 mL 2% 质量分数BSA的PBS 溶液,并且4 ℃保存。 并通过ELISA 方法对其进行表征。
1.3.4 基于MWCNTs-Abs-HRP 卡那霉素直接竞争性ELISA 方法的建立
1)基于MWCNTs-Abs-HRP 直接竞争性ELISA方法的检测流程 首先进行包被,4 ℃过夜;随后用PBST 洗涤备用;然后进行封闭操作(质量分数2%的明胶加入包被液中),在37 ℃培养箱中反应1.5 h,去除封闭液后备用; 随后加入稀释后的MWCNTs-Abs-HRP 多酶探针(50 μL),以及不同质量浓度的卡那霉素标准品(50 μL),每个质量浓度设置3个平行, 在37 ℃培养箱中反应1 h; 倒去反应液,用PBST 洗涤备用;每孔加入100 μL 的TMB 显色液,在37 ℃孵育10 min; 每孔加入50 μL 2 mol/L 的硫酸溶液;450 nm 吸光度条件下测其OD 值; 使用Origin 绘图软件绘制卡那霉素的间接竞争抑制曲线。
2)反应条件的优化 浓度:分别配制0、0.8、2、5 mol/L 的PBS 缓冲液, 用其稀释卡那霉素标准溶液,依照1.3.4.1 节的步骤进行重新测定,并选择出最佳离子浓度;pH 值:分别配制pH 为5.5、7.4、8.6、10.0 的PBS 缓冲液, 用其稀释卡那霉素标准溶液,依照1.3.4.1 节的步骤进行重新测定,并选择出最佳pH 值;Tween-20 的质量分数: 分别配制Tween-20质量分数为0、0.05 %、0.1 %、0.2 %的PBS 缓冲液,用其稀释卡那霉素标准溶液, 依照1.3.4 的步骤进行重新测定,并选择出最佳Tween-20 的质量分数。
蛋白质质量分数:分别配制蛋白质质量分数为0、0.1 %、0.5 %、1 %的PBS 缓冲液, 用其稀释卡那霉素标准溶液,依照1.3.4 的步骤进行重新测定,并选择出最佳蛋白质质量分数。
3)直接竞争性标准曲线 基于1.3.4 中优化后的条件,按照1.3.4 中的操作流程,卡那霉素标准品质 量 浓 度 为0、0.1、0.3、0.9、2.7、8.1、24.3 ng/mL,建立吸光度值随标准品质量浓度变化的抑制趋势,并进行曲线拟合,最终得到半数抑制浓度(IC50),最低检测限(IC90)和检测范围(IC20~IC80)。
4) 方法的特异性分析 将卡那霉素及其结构类似物用PBS 稀释成系列浓度,随后进行交叉反应率的测定。 根据测定结果测定不同物质的IC50值。根据公式 (1) 计算各结构类似物的交叉反应率(CR)。
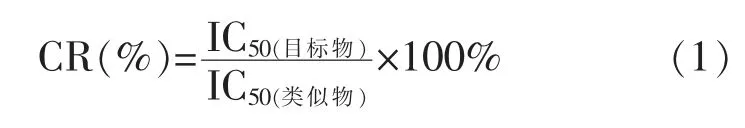
1.3.5 牛奶样品中卡那霉素残留的检测将纯牛奶样本用PBS(0.1 mol/L,pH 7.4)稀释为不同比例,按照1.3.4 构建标准曲线,评估牛奶的基质效应。 将纯牛奶样本用PBS 稀释到方法1.3.5 所测得的合适质量浓度,然后添加4 中不同质量浓度的卡那霉素标准品,分别为0、0.5、2 和10 ng/mL。用已经建立好的检测方法进行卡那霉素质量浓度的检测,计算加标回收率。 从本地选购了6种不同品牌的纯牛奶样本,并用新建立的检测方法对牛奶中的卡那霉素质量浓度进行测定。采用UPLC-MS/MS 方法对牛奶样本中卡那霉素进行测定[33]。
2 结果与讨论
2.1 卡那霉素间接竞争性ELISA 的建立
为获得最好灵敏度的检测方法,首先对抗原和抗体的最适质量浓度进行了优化。 结果如表1 所示。当OD450nm值在1.0~1.5 左右时,能够使实验具有更高的灵敏度;同时发现包被原和抗体的质量浓度较高都会对ELISA 体系的灵敏度产生影响,但是包被原对灵敏度的影响更大,所以作者选择抗体的最适质量浓度为0.2 μg/mL,KAN-OVA 的最适质量浓度为0.25 μg/mL,此时的OD450nm值为1.385。
根据以上获得的最适的工作质量浓度,绘制检测卡那霉素的ELISA 检测标准曲线,结果见图1。根据拟合的最终结果所得LOD 为0.295 ng/mL,IC50为4.826 ng/mL,IC20~IC80为0.946~24.627 ng/mL。

表1 方阵滴定法确定质量浓度Table 1 Checkerboard for the optimal concentration of antibody and antigen

图1 卡那霉素ELISA 标准曲线Fig. 1 Standard curve of ELISA for kanamycin
2.2 MWCNTs-Abs-HRP 的表征
为了表明多酶探针的成功合成, 需要对MWCNTs-Abs-HRP 多酶探针上的Ab 和HRP 进行验证。 首先用显色法验证多酶探针上的信号分子HRP, 如图2 和图3 所示, 未修饰的碳纳米管和TMB-H2O2并未发生显色反应, 而MWCNTs-Abs-HRP 多酶探针和TMB-H2O2能够发生显色反应,则表明信号分子成功偶连到碳纳米管上。 具体的操作步骤参考1.3.4.1 节中的操作流程,卡那霉素的标准品质量浓度设置4个梯度100、10、1、0 ng/mL,由于多酶探针上Ab 的存在,导致显色结果的不同,出现抑制趋势。 由此可以判定多酶探针MWCNTs-Abs-HRP 的成功合成。
在免疫分析实验中, 抗体作为结合分子,而HRP 作为信号分子,两者都与检测的灵敏度紧密联系。 为了能够得到最好的检测灵敏度,所以需要对探针上抗体和HRP 的量进行优化,寻找到最好的比例。如表3 所示。当C(Ab)∶C(HRP)=1∶4,A450nm值最高,并且此时的IC50也是最低的,具有最高的灵敏度。

图2 MWCNTs-Abs-HRP 多酶探针的验证Fig. 2 Identification of latex MWCNTs-Abs-HRP with centrifugation method

图3 最适抗体和HRP 比例的优化Fig. 3 Optimization of the ratio of antibody and HRP
2.3 基于MWCNTs-Abs-HRP 直接竞争性ELISA 方法条件优化
抗原抗体的结合容易受到溶液理化条件的影响,包括离子强度、pH 以及蛋白质含量。 同时在实验中发现,合成后MWCNTs 容易沉淀,为使其更好的悬浮于溶液中参与抗原抗体反应,需要添加一定的表面活性剂。如图4 所示,基于灵敏度高和A0/IC50高的选择要求, 最终确定的最优的缓冲液条件为0.8 mol/L PBS,pH 7.4,含有质量分数0.05% Tween-20 和1% BSA。

图4 基于MWCNTs-Abs-HRP 直接竞争性ELISA 的条件优化Fig. 4 Optimization of direct competitive ELISA based on MWCNTs-Abs-HRP
2.4 基于 MWCNTs-Abs-HRP 直接竞争性ELISA 标准曲线
为提高免疫分析方法的灵敏度,许多研究集中于探索不同的信号放大模式,其中可以纳米材料为载体构建多酶纳米颗粒作为信号分子。 借助纳米材料的高比表面积特性,结合更多的信号分子,达到信号放大进而提高方法灵敏度的效果。 江羚[31]等以纳米金颗粒为载体,合成AuNPs/HRP-Kan,建立了增强型直接竞争性ELISA 方法, 其最低检测限从0.13 ng/mL 提高到0.022 ng/mL。 Zhang[34]等采用CNTs 连 接HRP, 构 建 检 测Ataxia Telangiectasia Mutated(ATM)的免疫分析方法,检测限从1 ng/mL提高到0.2 pg/mL。
根据以上所得的最适条件,得到新检测方法的标准曲线,结果见图5。相较于之前所建立的卡那霉素ELISA 方法,灵敏度提高了约5 倍,该方法操作流程简单,缩减了反应时间,更加便捷、方便。

图5 基于碳纳米管高灵敏免疫新方法的标准曲线Fig. 5 Standard curve of high sensitivity ELISA based on carbon nanotubes
2.5 基于MWCNTs-Abs-HRP 直接竞争性新方法的重复性
为了验证此方法的重复性,进行了批内差和批间差的测定。 首先进行批内差测定,进行6个平行实验,并计算标准偏差(SD)和变异系数(CV)。 由表2 批内差数据可得, 基于碳纳米管信号放大的新方法的变异系数介于0.47%~4.69%之间,变异系数小于15%。 随后进行了批间差的测定,在不同的时间进行标准曲线的建立,并计算标准偏差(SD)和变异系数(CV)。 新方法的变异系数介于4.10%~9.98%。实验结果表明该方法的批内差和批间差都小于15%, 此方法可用于环境样本中卡那霉素的残留检测。

表2 基于MWCNTs-Abs-HRP 新方法的重复性验证Table 2 Repeatability verification of the new method based on MWCNTs-Abs-HRP
2.6 交叉反应率的测定
选择了5种氨基糖苷类抗生素, 通过ELISA 方法测定其交叉反应率。 结果如表3 所示。 从表中的计算结果可知:卡那霉素单克隆抗体能够特异性地识别卡那霉素,但是与妥布霉素具有很高的交叉反应率(82.82 %),与其他氨基糖苷类抗生素的交叉反应可忽略不计(<0.01%)。 Chen[35]等也报道了类似的结果,其中与Tob 的交叉反应率为90%。 根据Chen等的分子模型,Kan 和Tob 的结构几乎相同,包含3个环结构。 一个环中只有两个不同取代基可以区分这两种抗生素,这两个取代基分别是Kan 的羟基和Tob 的氨基和氢。 卡那霉素抗体主要与另外两个环结合, 这两个环代表了Kan 和Tob 的共同结构,因此卡那霉素单克隆抗体与妥布霉素具有很高的交叉反应率。

表3 交叉反应率测定Table 3 Determination of the cross-reactivity
2.7 牛奶的基质效应的测定
由于纯牛奶样本中蛋白质含量很高且成分较为复杂, 因此会影响抗原和抗体的特异性结合,同时也会影响整个检测方法的灵敏度。 所以在将此方法应用于牛奶检测之前,先测定其基质效应对此方法的影响。 如图6 所示, 未稀释的牛奶以及稀释2倍的牛奶样本在构建标准曲线时, 吸光度值与在PBS 缓冲液反应中的有很大差异, 所以导致灵敏度降低。 当牛奶样本稀释到4 倍或者8 倍时,吸光度值与对照组基本保持一致,同时抑制趋势也基本一致。 因此,在检测牛奶样本时用PBS 稀释4 倍以后进行测定。
测定添加回收率的目的就是为了验证作者所建立的检测方法的可行性和准确性。 由表4 的结果可得,牛奶中加标回收率为99.6%~114.8%,可见回收率在80%~120%之间,表明实验的可行性和准确性都很好。
从本地超市中购买6种不同品牌的纯牛奶,并用建立的ELISA 分析方法对卡那霉素含量进行测定,并用UPLC-MS/MS 对方法进行校正。 从表5 可以看出,采用建立的ELISA 方法检测出有两种牛奶中含有卡那霉素,最高为0.124 ng/mL,但远低于欧盟规定的MRL(150 ng/mL)。 与此同时,也采用了仪器方法(UPLC-MS/MS)对相同的样本进行测定,并比较两者的检测结果。 由表4 中的数据可得,两种分析方法(ELISA 方法和UPLC-MS/MS 法)的检测结果具有良好的相关性,可认为此方法是可行的。
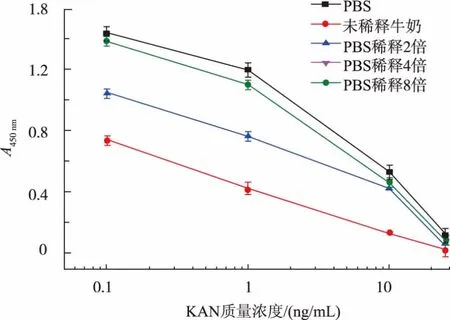
图6 牛奶样本基质效应的测定Fig. 6 Matrix effect in milk samples

表4 样品加标回收率及变异系数测定Table 4 Recovery and CV of Kanamycin in milk samples

表5 实际牛奶样品中卡那霉素的残留检测Table 5 Determination of Kanamycin in milk samples
3 结 语
该方法应用于牛奶样本中卡那霉素的检测,6种本地牛奶样本中检测到2种含有卡那霉素,但含量远低于MRL。
作者以MWCNTs 为载体,成功合成多酶纳米颗粒MWCNTs-Abs-HRP。 构建基于MWCNTs-Abs-HRP 的直接竞争ELISA 方法,其质量浓度线性范围为0.151~5.161 ng/mL, 其最低检测限为0.061 ng/mL,相比常规间接竞争性ELISA,灵敏度提高约5 倍。
