不同形式生物液加固砂土试验及机理分析
2020-09-10田志锋唐小微修志龙薛志佳
田志锋,唐小微,修志龙,薛志佳
(1.海岸与近海工程国家重点实验室(大连理工大学),辽宁 大连 116024;2.大连理工大学生命科学与技术学院,辽宁 大连 116024; 3.长安大学 公路学院,西安 710064)
微生物诱导碳酸钙(microbially induced carbonate precipitation,MICP)是一种绿色环保的土体加固新技术,其原理为细菌自身代谢产生的酶分解尿素产生碳酸根,在适宜条件下与钙离子反应生成碳酸钙,可填充孔隙,产生胶结等.现今,MICP已经被越来越多地应用于各工程领域,如提高砂土强度[1-5]、减轻砂土液化[6-7]、修复混凝土裂缝等[8-9].
巴氏球菌(Sporosarcinapasteurii)是一种具有高脲酶活性的尿素分解菌[10].近年来,关于巴氏球菌菌液提高砂土力学性能的研究取得了很大的成果.Dejong等[11]采用RF加固湿陷性松砂,结果表明,用RF处理松砂可有效提高其初始剪切刚度和极限剪切能力;Cheng等[5]使用RF研究不同环境条件下的MICP加固砂土效果,结果表明,经RF加固的砂土抗剪强度可达2 MPa.还有部分学者在MICP应用中采用US作为目标生物液.如Qabany等[12]在研究胶结液浓度对砂土加固的影响时采用经36 h培养的US作为目标生物液,结果表明,用US处理的砂土渗透性降低20%;Dejong等[13]研究生物胶结砂的工程性质时将培养24 h的US直接注入砂土中,经US处理后,砂的抗剪强度高达3.45 MPa;程晓辉等[6]等利用US对微生物加固砂的动力反应进行研究,证明了采用US处理砂柱可有效提高砂土的抗液化性能.如上所述,US和RF作为MICP目标菌液应用于工程均能产生良好的工程效果.但在大多数研究中对于生物液形式的选用却是任意的,对于试验或工程应用中US和RF的选择没有可以参考的依据.且在生物加固地基的研究中,大多数研究关注的是砂土经微生物加固后的力学性质演化或力学性能的改善情况,很少关注生物液组成成分对砂土力学性质的影响.然而生物液作为诱导碳酸钙的关键成分,其组成成分对碳酸钙的产量以及砂柱的加固效果有很大的影响.RF是经过新鲜培养培养基重悬菌体制成的,相比US,RF中有更多的营养物质,然而这些营养物质的添加对RF加固砂柱的效果是否有促进作用更是鲜有报道.此外,制备RF需要用离心机离心US以及新鲜培养基重悬菌体,制备RF的花费几乎是US的两倍,实际工程中选用生物液需要兼顾加固效果和经济性.很明显,探究新鲜培养基的添加对MICP加固砂土的能力是否有促进作用将会为MICP加固砂土中生物液的选用提供一定的依据,而深入研究不同生物液形式加固砂土的作用机理对MICP加固砂柱方案的优化也是至关重要的.
本文通过系列试验探究了用新鲜培养基重悬菌体对菌液的尿素水解、MICP和砂土加固能力是否有促进效果.由于经生理盐水重悬菌体而成的生物液(RS)中除菌体及生理盐水不含其他物质,且生理盐水只起维持菌体存活的作用,选用RS代表US中的菌体以研究生物液各组分(菌体,SS)的脲酶活性、MICP能力及砂土加固作用机理,为MICP应用于岩土工程时对生物液的选用提供指导.
1 试 验
1.1 试验材料
1.1.1 微生物
本文所用菌种为巴氏球菌(S.pasteurii,BNCC136654).培养基由20 g/L酪蛋白胨、5 g/L大豆蛋白胨、5 g/LNaCl和20 g/L尿素组成.细菌在30 ℃、180~200 r/min摇床中培养24 h后分成3份,其中一份不做任何处理(US),剩余菌液经10 000 r/min离心5 min后分离上清液(SS)及菌体沉淀,并分别用生理盐水和新鲜培养基重悬,得RS和RF.US的OD600(菌液浓度)为5.72,由于RS和RF含有US的所有菌体,认为三者菌量相等,SS中不含菌体.
1.1.2 反应底物及砂
尿素分解试验中的反应底物为0.5 mol/L尿素溶液;MICP试验中,为避免钙离子不足,用0.5 mol/L Ca(NO3)2·6H2O及0.3 mol/L尿素作反应底物;砂柱试验用0.5 mol/L Ca(NO3)2·6H2O及0.5 mol/L的尿素作反应液.砂柱试验用砂为中国福建标准砂,具体参数如表1所示,级配曲线如图1所示.

表1 砂土参数

图1 砂土级配曲线
1.1.3 砂柱装置
用有机玻璃筒(内径80 mm, 壁厚10 mm,高140 mm)作砂柱试验的试样筒.试样装置上端开口,下端封闭,下盖的中心部位开一孔并与硅胶软管相连,以便注入液能从下口顺利流出,并用一个收集器收集流出液.具体装置见图2.
1.2 试验方法
1.2.1 脲酶活性试验
菌液在1.1所述的培养条件下于250 mL的摇瓶中进行培养,每隔一定时间取3个摇瓶(3组平行试验)于20 ℃环境中测定OD600,并制备US、RF、RS和SS.然后用电导率法[14]测各菌液的脲酶活性.

图2 砂柱试验装置示意
1.2.2 MICP试验
分别取4 mL各生物液与24 mL反应液混合后静置于30 ℃恒温空气培养箱中,反应容器为一次性培养皿.定期取样测尿素浓度及pH.试验结束后用蒸馏水冲洗沉淀2~3次,并置于60 ℃烘箱,24 h后称重.碳酸钙产量计算公式为
mc=mt-mm-ml.
(1)
式中:mc为生成碳酸钙质量,mt为烘干后总质量,mm为培养皿质量,ml为滤纸质量.
1.2.3 砂柱试验
砂柱装样分3层进行,每层均通过振动密实至目标高度并通水饱和.砂土干密度为1.883 g/cm3,菌液浓度为5.13(OD600).通过表面渗流方式注浆.将1.5倍孔隙体积的各生物液分别注入砂柱后停歇8 h,然后将2倍孔隙体积反应液注入砂柱,并停歇4 h,共循环注入6次.注浆完成后将砂柱分成3份,采用直剪试验测定抗剪强度.直剪试验采用50 kPa上覆压力,加载速率为2 mm/min.测量完成后用差量-酸洗法[14]测定碳酸钙产量并用扫描电子显微镜(SEM)探究生物加固砂的微观结构.
2 结果与讨论
2.1 不同生长阶段菌液的脲酶活性
细菌的生长曲线如图3所示.细菌在0~15 h处于增长期,之后进入稳定期,菌量不再增加.不同生长阶段菌液的脲酶活性如图4(a)所示,其中脲酶活性表示为溶液中单位时间(min)内尿素浓度的降低量.所有菌液的脲酶活性均随培养进行而逐渐增大.培养15 h后,菌量不再增加,但脲酶活性仍继续增加,表明尽管处于稳定期,细菌仍有产脲酶的能力.稳定期时RS脲酶活性的升高同样证明了处于稳定期的菌体仍可继续产脲酶.此外,稳定期时RS的脲酶活性小于RF,说明新鲜培养基的添加能提高菌体的尿素分解能力.然而,如图4(a)所示,初始阶段US的脲酶活性低于RF,但当培养时间超过12 h时US的脲酶活性反而大于RF.初步认为,一方面培养初期,菌液浓度相对较低,新鲜培养基对菌体代谢有较大促进作用,随着细菌浓度的增加,新鲜培养基对菌体脲酶活性的促进作用逐渐减弱.另一方面,SS的脲酶活性很低,但并不为零(图4(a)所示),说明SS中含有一定量的脲酶.根据Kantzas等[15]的研究,脲酶属于胞内酶,但也会随细胞的死亡裂解而释放于体外.在制备RF时去除了SS,导致其损失了SS中的脲酶,该部分脲酶一定程度上抵消了新鲜培养基对菌体脲酶活性的促进,最终导致稳定期时US的脲酶活性大于RF.

图3 巴氏球菌生长曲线
由于RF、RS和SS均由US制备,其菌量相同,而SS也是来源于US,其中的游离脲酶为US中部分菌体裂解释放所得,因此,本文中4种生物液的单位脲酶活性定义为单位菌量的脲酶活性,其中所有菌液类型均以US的OD600作为总菌量.图4(b)表明,所有生物液的单位脲酶活性均先短暂增加后逐渐降低,在3 h时达到最大值.Zhao[16]在研究巴氏球菌脲酶活性时也发现,菌液在培养初期先达到最大脲酶活性之后逐渐降低.3 h时单位脲酶活性最大,但菌量极少,细菌的总脲酶活性反而较低.因此,实际工程中可采用具有较高脲酶活性的稳定期菌液作为目标生物液.
2.2 生物液诱导生成碳酸钙沉淀能力
MICP试验结果如图5所示.RF和RS的碳酸钙产量均在6 h时基本达到稳定,但RS略低于RF,表明新鲜培养基的添加增加了RF中的菌体诱导生成碳酸钙的能力.由于RF中有新鲜培养基的添加,其菌体诱导碳酸钙能力应大于US,但如图5所示,US诱导的碳酸钙产量略高于RF,这主要是由于制备RF时SS的损失.对于RF,新鲜培养基对菌体的重悬增加了菌体诱导碳酸钙的能力,但其制备时损失了SS中存在的脲酶及原有尿素分解物,导致其最终碳酸钙产量反而比US少.

图4 处于不同生长时期的生物液的尿素分解能力

图5 不同生物液类型诱导生成碳酸钙沉淀产量
此外,US由RS中的菌体和SS两部分组成,因此,对比了US的碳酸钙产量与RS和SS的总碳酸钙产量(图5).结果表明,US的碳酸钙产量略低于RS与SS碳酸钙产量之和.US中存在部分菌体的裂解死亡,菌体数量减小,而RS中的生理盐水维持细菌存活,其菌体数量相对US较多,提供了更多的成核位置,导致其碳酸钙产量大于US.
碳酸钙产率定义为碳酸钙实际生成量与理论生成量比值,反映MICP的效率.碳酸钙理论生成量按所有尿素完全分解且完全转化计算.由于其溶解度非常小(25 ℃时,KP,calcite=3.098 8-9(mol-2·L-2))[17],忽略碳酸钙溶解对实测生成量的影响.碳酸钙产率为
(2)
式中:ECaCO3(s)为碳酸钙产率,mCaCO3(s)为实测生成量,mCaCO3(T)为理论生成量.
如图6所示,RF、US、RS和SS诱导生成碳酸钙的最高产率分别为93.1%、92.8%、63%、34%.其中RF碳酸钙产率的计算基准是尿素含量. RF去除了SS,即其理论生成量不含SS中尿素分解物对应的碳酸钙产量,因此,虽其碳酸钙产量不如US,但产率略大于US.在MICP中,碳酸钙产率不仅受尿素、碳酸根和钙离子含量的限制,还受成核位点、pH等的影响.如图7(a)所示,虽然各组的pH不断波动,但基本处于8.8~9.1,而该pH对巴氏球菌的活性基本无影响.Okwadha等[18]的MICP试验中pH基本稳定在9左右,与细菌浓度无关.而Stocks等[19]证明碳酸钙在pH为8.3时开始析出,在pH为9时基本完成.MICP过程中的尿素浓度(图7(b))表明,所有生物液诱导碳酸钙的产率均未达100%,主要是尿素水解不完全所致.在MICP过程中,微生物为碳酸钙的形成提供成核位点,随着碳酸钙不断形成,菌体逐渐被包裹,失去脲酶活性,最终限制了尿素水解和碳酸钙生成[20].
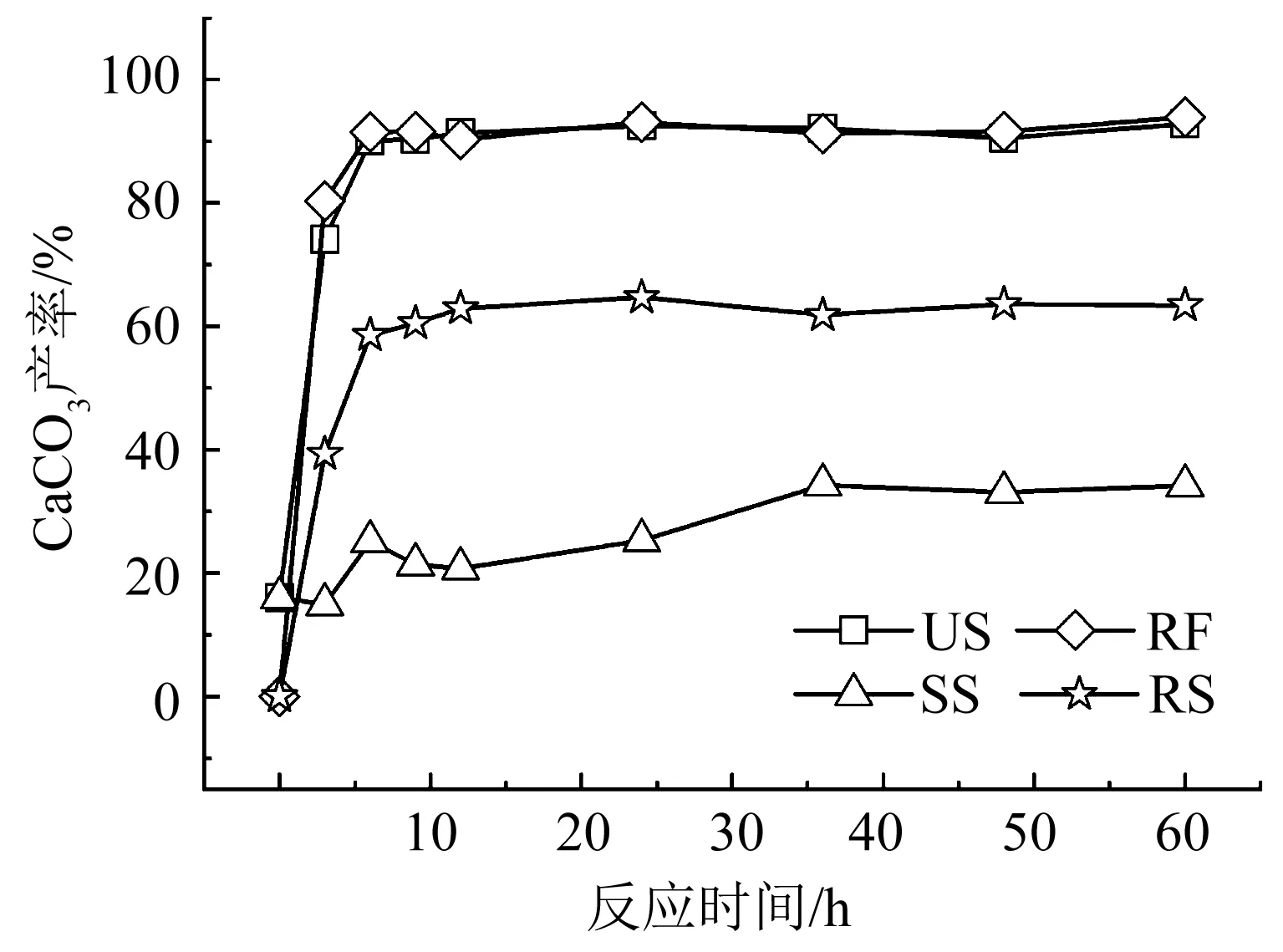
图6 不同生物液类型诱导生成碳酸钙沉淀产率
MICP试验表明高浓度菌体诱导形成碳酸钙的速度很快,在该实验条件下,对US和RF来说,6 h即可达到90%以上的碳酸钙产率.此外,生物诱导形成的碳酸钙在6~60 h时基本没有变化,表明碳酸钙可长期处于稳定状态.
2.3 碳酸钙形态分析
由图8可以看出,不同形式生物液诱导生成的碳酸钙形态之间有明显差异.US诱导生成的碳酸钙几乎全部胶结于培养皿上,RF组的碳酸钙部分则胶结于培养皿底板(箭头A).RS虽含有大量的菌体,但其生成的碳酸钙在培养皿上基本无胶结,而主要以絮凝状形式(箭头C所示)悬浮于溶液中.造成该差异的具体原因还有待研究,但可能与生理盐水有关.SS诱导生成的碳酸钙主要为单颗粒,基本上自由悬浮于溶液中(D,E所示).值得注意的是,US诱导的碳酸钙在培养皿上的完全胶结证明了其更强的胶结能力.而相比其他3种生物液,US诱导生成碳酸钙更强的胶结能力,一定程度上提高了US加固砂柱效果.而RF诱导的碳酸钙部分黏结于培养皿底板则反映了其相对较弱的胶结能力.
2.4 砂柱强度及碳酸钙产量
砂柱试验研究了不同形式生物液加固砂土的效果.未加固砂及加固后各砂柱的抗剪强度如图9所示.其中未加固砂的抗剪强度为17.2 kPa,相比未加固砂,所有经生物液加固的砂柱的抗剪强度均有明显的提高.剪切强度提高最高可达16.6倍(US最高剪切强度284.8 kPa),最小的也提高了3.6倍(SS最低剪切强度61.3 kPa).经US加固的砂柱除底部抗剪强度略低外,其顶部和中部的抗剪强度均高于其他3种生物液加固砂的抗剪强度.RF经新鲜培养基重悬,增加了更多的营养物质,但其处理砂柱的强度反而略低.虽然不能达到含菌生物液(US、RS、RF)对砂柱的加固效果,SS加固砂的抗剪强度也明显增加.此外,所有砂柱的抗剪强度均表现为上部最大,下部次之,中间最小.
砂柱中的碳酸钙产量如图10所示.碳酸钙产量与砂柱抗剪强度具有相同的分布趋势,同样表现为US加固砂的碳酸钙产量最大,RF次之,SS最小,且沿着注入方向碳酸钙产量先减小后增加.在砂土中,碳酸钙胶结于砂粒表面或沉积于砂粒间孔隙内,在砂粒间产生嵌固及胶结作用,增加砂土的结构性,提高其抗剪强度[3].根据Michael[4]与Cheng等[5]的结论,碳酸钙产量和抗剪强度之间呈正相关,相同条件下,碳酸钙产量越大,抗剪强度越大.根据Barkouki[21]的研究,碳酸钙产量沿注入方向越来越少.由于本文试验采用表面渗透方式注浆,且砂柱底部有溶液缓冲盒,菌液易在其表面聚集并生成碳酸钙,导致砂柱下部碳酸钙产量及抗剪强度比中部大.

图10 砂柱中碳酸钙产量
图11展示了不同生物液加固砂柱的强度与碳酸钙产量之间的关系.可明显得出无论何种生物液类型,砂柱的抗剪强度均随着碳酸钙产量的增加呈指数型增长.但对于不同生物液,相同碳酸钙产量对应的砂土加固效果差别很大,即不同生物液在砂土中产生的有效胶结大不相同.微生物诱导碳酸钙在土中有两种存在形式,即包覆砂粒和填充孔隙.当菌体存在时,菌体吸附于砂粒表面或砂粒接触处,为碳酸盐的产生和叠合提供成核位点.在成核位点存在时,碳酸钙主要在细菌周围聚集,胶附于砂粒上或砂粒接触处,因此,含菌体的生物液诱导生成的碳酸钙多覆于砂粒表面,主要为胶结作用.如3.3节所述,SS诱导生成碳酸钙沉淀主要是由于碳酸钙的过饱和.对于SS,在没有细菌提供成核位点情况下,生成的非生物碳酸钙主要是填充孔隙,起到嵌合作用,胶结较少,因此,砂粒间有效胶结接触也较少,相同碳酸钙含量时,砂土抗剪强度相对较低.对于RF,基本不存在非生物碳酸钙的生成,填充作用较少,在低碳酸钙含量时,生成的碳酸钙优先包裹砂粒,因此,形成砂粒间有效胶结接触需要更多的碳酸钙.当砂粒被包裹到一定程度,砂颗粒之间的嵌合和胶结越来越多,之后随着碳酸钙的增加,MICP引起的有效接触增加越来越快,相同碳酸钙产量下,其强度也更大.US不仅包含菌体,还含有SS,其在砂柱中生成的碳酸钙既有主要用于胶结砂粒的生物碳酸钙,也有主要用于填充孔隙的非生物碳酸钙.当碳酸钙产量相同时,嵌合作用和胶结作用的同时存在使砂粒间产生更多的有效胶结接触,导致更大的抗剪强度.

图11 碳酸钙产量与砂柱抗剪强度关系
图12(a)和(b)分别显示了US和RF的SEM图,从中可清楚地看到,US加固砂中的碳酸钙大量聚集在砂颗粒连接处,而RF加固砂中,砂颗粒连接处之间的碳酸钙相对较少.相比RF,US中多了SS,且SS中无菌体,其中存在菌液培养时期尿素分解所产生的碳酸根以及部分脲酶,在钙离子存在时,这部分碳酸根及部分脲酶分解尿素生成的碳酸根在无成核位置的情况下,最终导致US加固砂柱中分布于土颗粒间(空隙处)的碳酸钙比RF多.

图12 不同微生物加固砂的SEM图
2.5 经济及工程适用性
如1.1节所述,RF是在US的基础上做了进一步的处理,其首先要用离心机对US进行离心,之后需要用与初始培养基等量的新鲜培养基对离心获得的菌体进行重悬.实际工程中,相比US,制备RF需要额外的离心设备以及两倍的培养基量,因此,其制备成本也是RS两倍之多.
根据实验结果,在本文的砂柱处理时长下,原菌液(US)对砂柱的加固效果要优于新鲜培养基重悬菌体(RF)的加固效果.需要指出的是,新鲜培养基对菌体的重悬一定程度上为细菌的存活性和再繁殖提供了更好的营养条件,增加了菌液的长期存活性.当MICP应用于强度要求更高、处理时间更长的地基工程时,新鲜培养基对细菌作用时长的延长或许间接节省成本,提高工程效果,但还需要进一步的研究.而对强度要求一般且需要快速加固的地基,采用US作为目标菌液则更经济、高效.
3 结 论
1)用新鲜培养基对菌体重悬可促进菌体的尿素分解能力,当菌液浓度较低时(培养时间少于12 h),菌体尿素分解能力的提高大于RF制备时由于去除SS引起的菌液尿素分解能力的削弱,导致RF的尿素分解能力大于US,当菌液浓度较高时,US的尿素分解能力大于RF.
2)处于稳定期的细菌仍有继续产脲酶的能力.US分解尿素的能力来源于两方面,即菌体内脲酶和细胞裂解死亡释放到体外的脲酶,其中菌体内脲酶占大部分.
3)新鲜培养基的添加明显提高了菌体的MICP能力,但SS的损失导致RF的MICP能力与US基本相同(RF和US诱导生成碳酸钙的产率分别为93.1%和92.8%).此外碳酸钙产量在6 h达到稳定后,未随时间增加逐渐减小,可长期处于稳定状态.
4)US加固的砂柱具有更高的抗剪强度及碳酸钙产量,SS虽未含菌体,也可诱导生成碳酸钙并具有加固砂土的能力.
5)同种形式生物液,砂柱的抗剪强度随碳酸钙产量的增加而增加;不同形式的生物液,相同碳酸钙产量时,US的抗剪强度最大,主要是因为US 中SS和菌体的同时存在使砂柱中既产生主要起填充孔隙作用的非生物碳酸钙,又产生主要起胶结作用、包裹砂粒的生物碳酸钙,两者共同作用导致了更有效的胶结接触.