小麦 TaGRF4基因分析与功能鉴定
2020-09-10郭泾磊张程炀李红霞丁尔全
郭泾磊,张程炀,李红霞,李 嵩,丁尔全,汪 妤
(西北农林科技大学 农学院,陕西杨陵 712100)
全世界40%以上人口以小麦为主食,小麦为人类提供超过20%的蛋白质和能量[1],也是中国城乡居民的主要口粮作物之一[2]。近几年气候变化明显,极端高温或低温频发,需要培育抽穗前发育略慢而后期灌浆速度快的品种[3]。根据以往的育种经验,大多数小叶类型的小麦材料或品种都灌浆较好。不仅如此,小叶品种群体通透性好,避病和耐病能力强,光合效率高;大风暴雨极端天气抗倒伏,由于叶片小,蒸腾效率降低,节水抗旱。通过传统育种方法可以改良农艺性状优良但叶片较大的品种,如果能明确控制叶片大小的基因及其调控机制,借助生物技术手段将助力传统育种进程。
很多叶片发育相关基因的表达量改变不仅影响叶片大小,而且还会改变植物的其他性状,比如花器官、种子等。但是在拟南芥中的研究表明,某些GRF(Growth-regulating factor)家族成员主要作用于叶片片状结构的伸展过程,对分生组织以及其他器官的影响较小[4-6],是控制叶片大小的关键基因。在基因应用方面,相对下游且调控性状单一的基因具有更大的应用价值,可以在不改变其他优良农艺性状的同时改良目的性状。从这个角度看,GRF具有潜在的利用价值。
虽然在拟南芥、水稻和玉米中也有关于GRF及其转录激活因子GIF(GRF-interacting factor)调控叶片生长发育的研究,但是研究表明,分子水平上具有较高同源性的基因在两个作物中的生物学功能迥异,甚至相反[7-11]。目前关于小麦GRF基因家族的研究鲜见报道,因此本研究探索小麦GRF基因家族成员的生物学功能,以期找到与叶片发育相关的基因。
1 材料与方法
1.1 材料与试剂
小麦品种‘中国春’(Chinese spring)为西北农林科技大学小麦遗传育种实验室保存种子,重组BSMV病毒载体α、β、γ质粒由西北农林科技大学农学院韩德俊教授惠赠。限制性核酸内切酶PacI、NotI和BssHII购自美国NEB公司,RNA提取试剂Trizol、Universal DNA 纯化回收试剂盒、质粒小提试剂盒(Tiangen,北京)购自天根生化科技(北京)有限公司,反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,中国大连)、荧光定量试剂盒SYBR Premix ExTaqTMII(TaKaRa,中国大连)购自宝生物工程(大连)有限公司,体外转录试剂盒T7 RiboMAXTMExpress Large Scale RNA Production System(Promega)购自美国普罗麦格(Promega)公司。
1.2 试验方法
1.2.1 小麦TaGRF4的生物信息学分析GRF基因主要包含QLQ(GlnLeuGln)和WRC(TrpArgCys)两个保守结构域。从Ensembl plants(http://plants.ensembl.org/index.html) 获得6条水稻GRF基因序列和10条玉米GRF基因序列。使用这些基因序列的保守结构域在该数据库搜索小麦序列。根据蛋白序列进行筛选,删除没有QLQ或WRC结构域的序列,得到的序列即为小麦GRF序列。获得小麦GRF的氨基酸序列、cDNA序列、基因序列、内含子和外显子的起始终止位置等信息。利用玉米ZmGRF10基因的蛋白序列对已获得的小麦GRF序列进行blast搜索,找到与之同源性最高的3条小麦同源基因序列,命名为TaGRF4-A、TaGRF4-B和TaGRF4-D,合称为TaGRF4,全长为3 227~ 3 294 bp,含有 3 个外显子和 2 个内含子,总蛋白长度约为410个氨基酸。为了分析TaGRF4基因的进化关系,使用生物信息学分析软件MEGA 7.0对水稻、玉米GRF蛋白序列和小麦TaGRF4蛋白序列进行系统进化分析,使用邻位相连法(Neighbor-joining, NJ)构建进化树。
1.2.2 不同生长时期叶片TaGRF4基因表达量的鉴定 小麦(17 ℃暗培养2 h,21 ℃光照培养22 h,光照度为15 730 lx)在人工气候箱培养。为了研究TaGRF4在叶片发育过程中的表达模式,在小麦幼苗长到两叶一心时分别剪取小麦的第 1、 2、3 片叶,其中第 1 片叶生长时间最长,为老叶;第 2 片叶刚完全展开,为成熟叶片,也是主要的功能叶片;而第 3 片叶是正在发育的幼叶。用Trizol法提取总RNA,用反转录试剂盒反转录得到cDNA第 1 链,根据小麦TaGRF4的3个同源基因的保守序列设计特异引物RT-GRF4-F和RT-GRF4-R,以cDNA第 1 链为模板,以TaActin为内参基因,用荧光定量试剂盒进行实时荧光定量PCR,检测目的基因TaGRF4的表达水平。引物序列见表1。
1.2.3 叶片不同部位TaGRF4基因表达量的鉴定 为了检测叶片不同位置或区段TaGRF4的表达情况,将两叶一心时期刚完全展开的小麦第 2 片叶沿纵轴分割成远端、中远段、中近端和近端4 个部分分别取样。通过实时荧光定量PCR检测目的基因TaGRF4的表达水平。
1.2.4 GA处理后不同时间点TaGRF4基因表达量的鉴定 叶片最终大小与激素有关,其中最关键的是赤霉素(Gibberellin, GAs),其不仅促进细胞增大而且可以促进细胞增殖,为了研究TaGRF4基因的表达是否受其调控,用10 μmol·L-1赤霉素(GA3)涂抹两叶期小麦的第 1 片叶后,分别于 0 h、0.5 h、1 h、2 h、4 h、6 h、12 h、24 h选第 2 片叶取样,通过实时荧光定量PCR检测目的基因TaGRF4的表达水平。
1.2.5 病毒诱导基因沉默载体(VIGS)的构建与侵染 为了消除在表型鉴定过程中基因功能冗余的影响,需要将TaGRF4的3 个同源基因同时沉默,根据已知TaGRF4-A的cDNA序列设计带有PacⅠ和NotⅠ酶切位点和保护性碱基的引物(表1),以反转录得到的cDNA第 1 链为模板,用高保真酶PCR扩增得到的沉默片段经测序验证已成功在目的序列前后引入酶切位点和保护碱基,且与TaGRF4-B和TaGRF4-D相同区段的相似度≥85%,从而保证B和D基因组上TaGRF4能够同时被沉默。取含BSMV-α、BSMV-β、BSMV-γ和BSMV-γPDS质粒的大肠杆菌扩大培养,用天根(TianGen) 公司质粒小提试剂盒提取质粒。用上述扩增的片段与BSMV-γ质粒重组、转化和测序(测序引物见表1)。将BSMV-α、 BSMV-β、γBSMV-γPDS以及经验证含有目的基因的γBSMV-TaGRF4质粒线性化,其中α载体用MluI酶;β载体用SpeI酶;γ载体用BssHII酶,线性化后质粒电泳速度减慢,表明线性化成功(图1-A)。将线性化后的载体用体外转录试剂盒体外转录为RNA病毒(图1-B)。选第 3 片叶尚未发育的小麦幼苗于第 2 片叶接种RNA病毒,接种时α、β、γ液体按体积比1∶1∶1混合,共1.5 μL,加入8.5 μL FES缓冲液充分混匀后,进行摩擦接种。接种后将小麦放入25 ℃左右的环境密封暗处理 24 h,然后于人工气候箱正常培养。每天观察、记录植株第3片叶的长度变化。并于接种第 15天取第3片叶检测TaGRF4的表达量,验证沉默效果。

表1 基因克隆与遗传转化的引物Table 1 Primers for gene clone and genetic transformation

A.载体线性化; B.线性化载体体外转录; M.DL2000 DNA marker; 0.空载体,空白对照,下同
2 结果与分析
2.1 TaGRF4基因的生物信息学分析
2.1.1 基因与蛋白序列分析 通过获得的TaGRF4基因信息(表2),比较A、B和D基因组上3 个TaGRF4同源基因的蛋白序列,发现它们都有WRC和QLQ两个保守的结构域,部分同源基因在两个保守结构域上无氨基酸变异,氨基酸差异位点主要位于第3个外显子上(图2)。
2.1.2 物种同源性分析 利用小麦TaGRF4基因、水稻和玉米GRF基因的蛋白序列构建系统进化树(图3),发现除玉米ZmGRF10之外还有玉米ZmGRF9和水稻OsGRF1与小麦TaGRF4的同源性较高,其中水稻OsGRF1与小麦TaGRF4同源性最高,相似度为75%。

表2 小麦 TaGRF4基因信息Table 2 Information of wheat TaGRF4
2.2 TaGRF4基因表达量分析
2.2.1TaGRF4基因在苗期叶片中的表达量 不同发育时期叶片的实时定量结果表明,TaGRF4在第3片叶中的表达量最高,即在生长旺盛的幼叶中表达量最高,在第 1片叶和第2片叶中的表达量偏低,即在老叶和成熟叶片中的表达量偏低,且两者间无明显差异(图4)。
根据图4的结果可做出进一步推论:相较其他部分,叶片生长旺盛部分(叶尖,远端)的TaGRF4表达量更高。检测TaGRF4基因在 4 个部分的表达情况,结果表明TaGRF4在叶片远端(叶尖)表达量最高,中部表达量最低(图5),与推论相符。

图2 小麦A、B、D基因组上 TaGRF4的3 个同源蛋白比对Fig.2 The alignment of TaGRF4 protein sequences on A, B and D subgenome

图3 TaGRF4基因与水稻、玉米GRF家族基因系统进化分析Fig.3 Phylogenetics analysis of TaGRF4 in Triticum aestivum, Oryza sativa and Zea mays
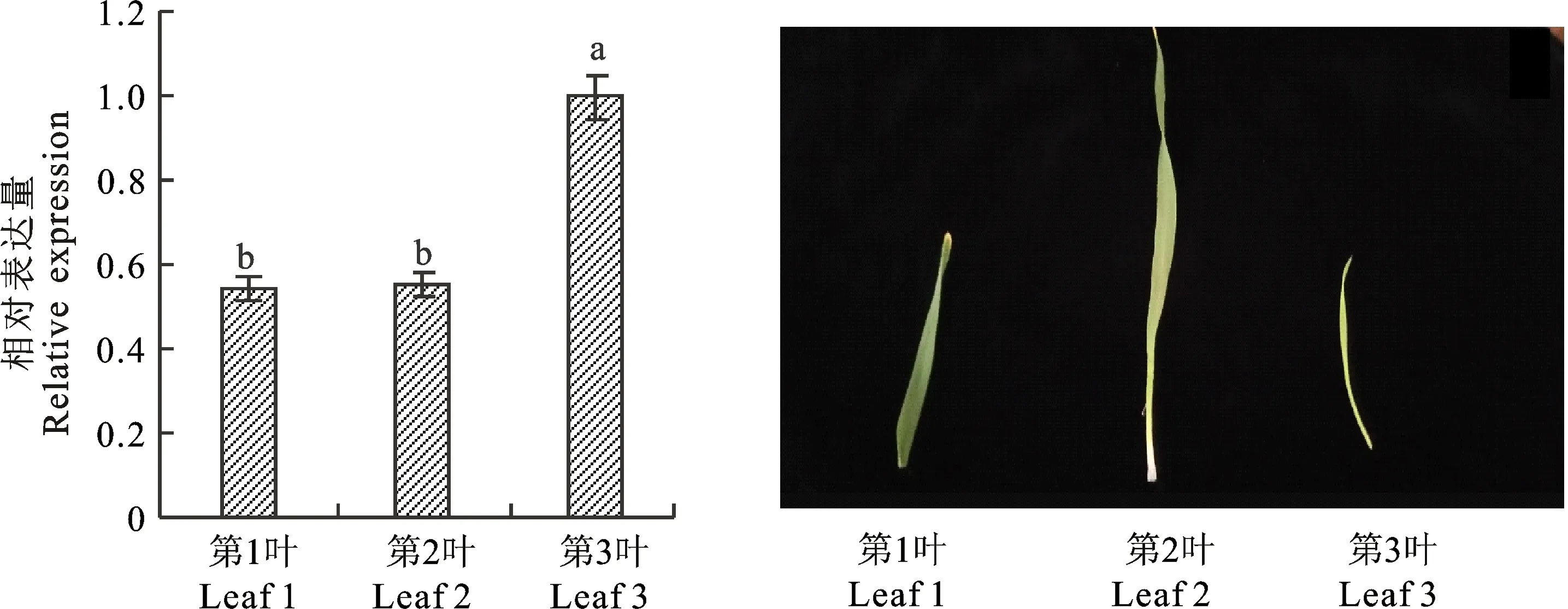
图4 TaGRF4在不同叶片中的表达分析Fig.4 Expression analysis of TaGRF4 of different leaves

图5 TaGRF4在叶片不同部位的表达分析Fig.5 Expression analysis of TaGRF4 in different sections of leaves
2.2.2 GA处理后不同时间点TaGRF4基因的表达量 两叶期小麦第 2 片叶在不同时间点的实时定量结果显示,TaGRF4基因在GA3处理后1 h显著上调表达,但随着处理时间的延长,表达量又回到未处理水平,说明在短时间内赤霉素会诱导TaGRF4的表达,但是无法维持其高表达(图6)。
2.3 VIGS结果分析
2.3.1 表型分析 在 BSMV-VIGS RNA病毒接种后第10天观察表型,发现接种γBSMV-TaGRF4的植株第3 片叶生长较快,而接种空载体γBSMV0的植株第3 片叶生长相对较慢(图7-A)。对第3 片叶长度的统计结果表明,接种γBSMV-TaGRF4的叶片比接种空载体的叶片长50%左右(图7-B)。说明TaGRF4沉默后能够促进叶片生长。

*代表差异达显著水平(P<0.05);**代表差异达极显著水平(P< 0.01);图8同

A.接种后表型比较,蓝色为接种叶,红色为新生叶片;B.接种后新生叶片长度统计
2.3.2 沉默后小麦TaGRF4的表达 BSMV-VIGS RNA病毒接种后第15天,第3片叶的实时定量结果显示,与接种空载体γBSMV0的植株相比,接种γBSMV-TaGRF4的植株#2与#5的TaGRF4基因表达量并未下调,而其余植株TaGRF4表达量显著降低(图8)。

#1~#7.γBSMV- TaGRF4 接种植株
3 讨 论
前人研究表明GRF基因家族某些成员可以调控叶片的大小[12],故本研究以GRF基因家族作为切入点,分析小麦控制叶片大小的分子调控机制,根据玉米中已经鉴定出的控制叶片大小的ZmGRF10蛋白序列,通过同源比对,在小麦基因组上找到与之同源性最高的小麦基因TaGRF4。同时在水稻和玉米中找到与TaGRF4同源性较高的基因,其中OsGRF1、ZmGRF9、ZmGRF11与TaGRF4的蛋白序列相似度达到60%~80%。
在叶片发育过程中,不同发育时期的叶片以及叶片不同位置的细胞分裂和生长状态不同[13],本研究通过比较小麦不同发育时期的叶片及完全展开叶片不同区段的TaGRF4表达情况以明确TaGRF4是否与叶片发育有关。发现TaGRF4在未完全展开叶中的表达量最高,而未完全展开叶片的细胞处于增殖增大阶段,因此推断TaGRF4在叶片发育早期叶片细胞迅速增殖增大的过程中发挥作用。前人研究表明单子叶叶片细胞生长具有向基性,即自上而下,顶部细胞分裂快,基部细胞分裂速度减慢并逐渐增大[14];而TaGRF4在叶片顶端的表达量最高,推测TaGRF4可能参与叶片生长初期细胞增殖过程。
第一个发现的GRF家族成员就是水稻OsGRF1,该基因主要在水稻的顶端分生组织和居间分生组织中表达,而且其表达受GA诱导,调控了水稻的营养生长[15]。本研究中TaGRF4与OsGRF1同源性最高,也主要在幼嫩组织中表达且受GA诱导,说明二者具有相似的表达模式,都与器官的形成和发育有关,但是目前关于OsGRF1调控叶片大小的研究鲜见报道。
BSMV-VIGS RNA 病毒的摩擦接种对被接种叶片(第 2 片叶)生长状态有明显影响,故选择新生叶片,即小麦第 3 片叶作为研究对象。本研究发现,利用BSMV-VIGS病毒沉默体系将TaGRF4在小麦幼苗中沉默后,第 3 片叶生长速率加快,说明TaGRF4可能与抑制叶片生长有关。这与玉米中关于ZmGRF10的研究结果类似,玉米ZmGRF10超表达后玉米的叶片变小[16]。由此可见,小麦TaGRF4与玉米ZmGRF10不仅同源性较高,而且二者可能具有相似的功能。ZmGRF10包含QLQ和WRC结构域,但是C端完全缺失。与之相比,小麦TaGRF4序列完整,说明C端序列不影响这两个基因调控叶片生长的功能。试验中#2与#5的TaGRF4基因表达量并未下调,而VIGS沉默存在侵染失败的可能性,故认为#2与#5为沉默失败植株。
本研究结果表明,小麦TaGRF4基因参与叶片的生长发育过程,并且受GA诱导,沉默后会促进苗期叶片生长。VIGS技术操作简单、周期短且不需要遗传转化,非常适用于小麦基因功能的快速分析[17-18],但VIGS体系中,RNA病毒较为脆弱,易出现侵染失败的情况,且侵染后性状不会遗传,只能初步验证TaGRF4基因的功能,进一步验证小麦基因功能仍需通过转基因、Crispr/Cas9等手段实现。
4 结 论
本研究利用同源比对找到与玉米ZmGRF10同源性较高的小麦TaGRF4基因,发现该基因在生长旺盛的幼嫩叶片和叶片顶端表达量最高,说明TaGRF4可能与叶片细胞分裂增殖有关。赤霉素GA在短时间内会诱导TaGRF4的表达,但是无法维持其高表达。利用VIGS病毒沉默技术将TaGRF4在小麦幼苗中沉默后,发现新生叶片的TaGRF4表达量较低,生长速率加快,沉默植株第3叶的长度显著大于对照植株,说明TaGRF4与ZmGRF10类似,在叶片生长过程中起抑制作用。综上得出结论,小麦基因TaGRF4主要在生长旺盛的叶片部位表达,参与调控叶片的生长发育。
