蒎烯类苯酚基吡啶氟硼发光材料的合成与性质
2020-09-10吕光宇王庭玮汪文源
吕光宇 王庭玮 汪文源 张 蕤 刘 建
(南京林业大学化学工程学院,江苏省林业资源高效加工利用协同创新中心,江苏省生物质能源与材料重点实验室,南京 210037)
分子基发光材料因其易于分子裁剪、结构丰富、颜色可调、性能可控、制备简单、能耗低等优点,近年来已成为新材料研究领域中的热点之一[1],在光电、信息、环境乃至生命科学等诸多高新技术领域具有广泛应用[2-5]。在分子基发光材料的开发和设计研究中,荧光量子产率的提升、发射光谱和荧光寿命的调控等是该领域的关注重点之一[6]。在众多分子基发光材料中,氟硼配合物因其优异的发光性能备受关注[7-8]。其中硼二吡咯亚甲基类染料(BODIPY)因具有高荧光量子产率和高摩尔消光系数,被广泛应用于光电转换、离子探针和荧光成像等领域[9-11]。在BODIPY结构中,硼原子与氮原子的桥联,使得2个吡咯环同处一个刚性共平面的六元杂环结构,很容易通过分子设计实现高荧光量子产率的长波长发射乃至近红外发射荧光材料的构建。共轭单元更小的氧氮氟硼类配合物体系通常能够呈现短波长发射性质,是一种构建蓝光发射材料的合成骨架,且制备更为简单,具有广阔应用前景[12]。如已有一系列基于苯酚基吡啶氟硼配合物的蓝光发射材料的研究报道[13-15]。然而它们的荧光量子产率还不是很理想,需要进一步通过分子设计来提升,以拓宽这类发光材料的应用前景。取代基的选择和优化是调控材料发光性能的有效途径之一。通常,增加取代基的刚性和空间位阻等能有效抑制分子间的电荷转移,减小发光分子激发态振动而产生的非辐射跃迁几率,进而提升材料的发光性能。我们在前期的工作中将蒎烯基团引入到联吡啶类稀土铕发光配合物中,成功地提升了材料的发光性能[16]。
本工作将天然合成砌块蒎烯作为功能调控基元引入到苯酚基吡啶氟硼配合物体系,构建了一系列新型氟硼发光配合物,考察了蒎烯基团对氟硼配合物发光性质的影响,并研究辅助取代基对配合物光谱调控和发光性质的影响。此外,基于蒎烯基团的手性,我们研究了5对蒎烯类苯酚基吡啶氟硼配合物对映体的圆二色光谱,首次拓展了氟硼类配合物的光学活性研究。
1 实验部分
1.1 试剂与仪器
实验中所用到的试剂均为分析纯,四氢呋喃、二氯甲烷、N,N-二甲基甲酰胺使用前进行了无水处理,其它试剂未经处理直接使用。起始原料1a、1c、1e为市售产品。1b、1d和中间体2a~2e、3a~3e、4a~4e、5a~5e的合成方法及表征数据见Supporting information[17-18]。红外光谱表征采用Perkin Elmer Spectrum Two红外光谱仪,溴化钾压片。核磁表征采用美国布鲁克公司生产的Bruker DRX-600核磁共振仪。吸收光谱测试采用日本岛津公司生产的SHIMADZU UV-3600紫外可见分光仪。荧光发射光谱采用日本日立公司生产的FL-4600荧光分光光度计。荧光寿命、荧光量子产率测试采用日本HORIBA FL-3三维荧光光谱仪。圆二色谱采用日本分光公司生产的J-810电子圆二色光谱仪。
1.2 合成步骤
1.2.1 配合物(-)-W1的合成
将化合物5a(200 mg,0.8 mmol)、无水二氯甲烷(15 mL)置于两口瓶中,在氮气保护下搅拌,缓慢加入三氟化硼-乙醚(227 mg,1.6 mmol)。滴毕,室温反应0.5 h后再加入三乙胺(122 mg,1.2 mmol),室温下继续反应12 h。反应结束,加入30 mL水淬灭反应,用二氯甲烷(50 mL×3)萃取有机相,依次用饱和食盐水洗涤2次,再加入无水硫酸钠干燥。过滤浓缩,粗产品经柱层析纯化得到白色粉末化合物(-)-W1(200 mg,产率:80%)。1H NMR(CDCl3,600 MHz):δ8.24(s,1H),7.81(s,1H),7.80(dd,J1=7.8 Hz,J2=1.2 Hz,1H),7.47~7.44(m,1H),7.18(dd,J1=7.2 Hz,J2=1.2 Hz,1H),7.04~7.01(m,1H),3.02(d,J=2.4 Hz,2H),2.98(t,J=5.4 Hz,1H),2,84~2.80(m,1H),2.42~2.39(m,1H),1.46(s,3H),0.69(s,3H)。13C NMR(CDCl3,150 MHz):δ155.7,153.3,148.3,143.2,136.2,134.0,125.0,120.7,120.5,119.4,116.4,44.7,39.6,39.4,33.8,31.6,29.8,25.8,21.7。
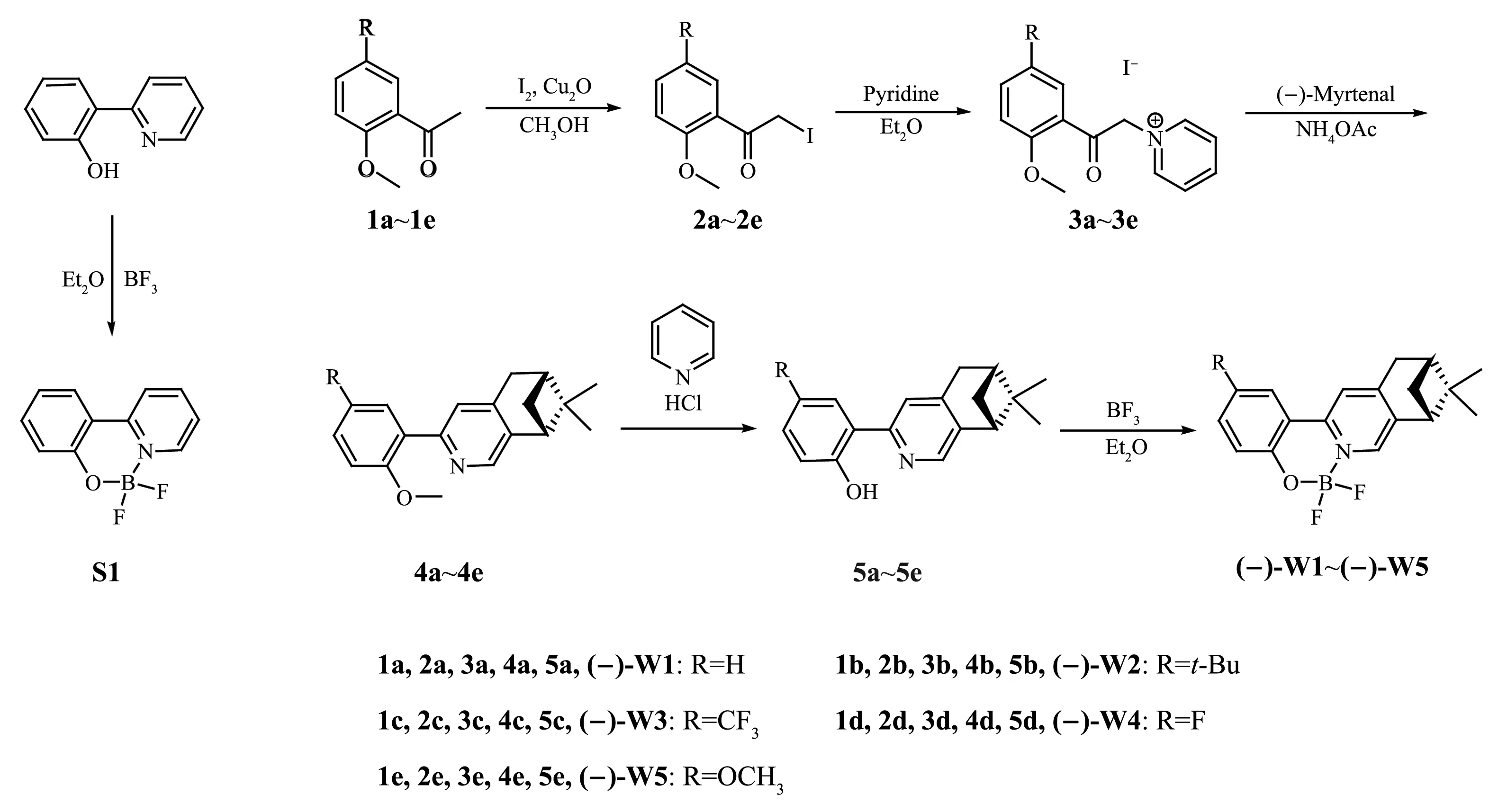
Scheme 1 Molecular structure of complex S1 and synthesis routes of chiral pinene-substituted phenol-pyridyl aza-fluoroboron complexes(-)-W1~(-)-W5
1.2.2 配合物(-)-W2~(-)-W5的合成
中间体(-)-W2~(-)-W5分别以化合物5b~5e为原料参考化合物(-)-W1的方法合成。
(-)-W2:产率:84%。1H NMR(CDCl3,600 MHz):δ8.22(s,1H),7,86(s,1H),7.75(d,J=8.4 Hz,1H),7.50(dd,J1=8.4 Hz,J2=2.4 Hz,1H),7.10(d,J=8.4 Hz,1H),3.22(d,J=2.4 Hz,2H),2.97(t,J=5.4 Hz,1H),2.83~2.80(m,1H),2.42~2.40(m,1H),1.46(s,3H),1.36(s,9H),0.69(s,3H)。13C NMR(CDCl3,150 MHz):δ153.5,153.1,148.6,143.2,142.9,136.1,131.7,121.1,120.2,119.3,115.5,58.5,47.1,44.6,39.6,39.4,34.4,33.8,31.6,25.8,21.6,18.5,8.8。
(-)-W3:产率:80%。1H NMR(CDCl3,600 MHz):δ8.25(s,1H),8.08(s,1H),7.93(s,1H),7.68(dd,J1=9 Hz,J2=2.4 Hz,1H),7.23(d,J=9.0 Hz,1H),3.24(d,J=2.4 Hz,2H),3.01(t,J=5.4 Hz,1H),2.88~2.82(m,1H),2.44~2.41(m,1H),1.49(s,3 H),0.69(s,3H)。13C NMR(CDCl3,150 MHz):δ158.1,154.2,146.8,144.5,136.4,130.4,130.3,125.1,122.9,122.8,122.78,122.76,122.74,122.65,121.2,119.7,116.4,46.9,44.7,39.5,39.3,33.8,31.4,25.7,21.6,8.6。
(-)-W4:产率:81%。1H NMR(CDCl3,600 MHz):δ8.25(s,1H),7.82(s,1H),7.51(dd,J1=12.0 Hz,J2=3.0 Hz,1H),7.20~7.17(m,1H),7.14~7.13(m,1H),7.12(d,J=2.4 Hz,2H),3.01(t,J=5.4 Hz,1H),2.86~2.82(m,1H),2.44~2.41(m,1H),1.48(s,3H),0.70(s,3H)。13C NMR(CDCl3,150 MHz):δ157.4,155.8,153.8,151.8,147.1,144.0,136.3,121.83,121.79,121.1,121.0,119.7,110.8,110.6,46.6,44.7,39.5,39.3,33.8,31.4,25.7,21.6,8.7。
(-)-W5:产率:70%。1H NMR(CDCl3,600 MHz):δ8.22(s,1H),7.80(s,1H),7.26(d,J=3.0 Hz,1H),7.09(d,J=9.0 Hz,1H),7.07~7.05(m,1H),3.84(s,3H),3.20(d,J=2.4 Hz,2H),2.97(t,J=5.4 Hz,1H),2.83~2.80(m,1H),2.42~2.39(m,1H),1.46(s,3H),0.69(s,3H)。13C NMR(CDCl3,150 MHz):δ153.4,153.29,149.9,148.0,143.3,136.2,121.5,121.1,119.5,116.4,108.8,56.2,46.6,44.7,39.6,39.4,33.8,31.7,31.6,25.7,22.8,21.6,14.2,8.7。
1.2.3 配合物S1的合成
配合物S1以2-(2-羟基苯基)吡啶为原料参考配合物(-)-W1的方法合成,合成路线见Scheme S3,产率:80%。1H NMR(CDCl3,600 MHz):δ8.68(d,J=5.4 Hz,1H),8.19~8.16(m,1H),8.11(d,J=8.4 Hz,1H),7.82(d,J=7.8 Hz,1H),7.58(t,J=6.6 Hz,1H),7.50~7.47(m,1H),7.18(d,J=8.4 Hz,1H),7.04(t,J=7.2 Hz,1H)。13C NMR(CDCl3,150 MHz):δ155.9,150.3,142.5,141.2,134.9,125.4,123.1,120.8,120.6,116.0。
2 结果与讨论
2.1 氟硼发光配合物的吸收光谱
图1为氟硼配合物(-)-W1~(-)-W5和S1在无水二氯甲烷(DCM)中的紫外可见吸收光谱。每个配合物的吸收光谱中都有2个或3个明显的吸收峰,其中长波长的吸收峰可归因于配合物分子内的电荷转移跃迁,短波长270 nm附近的吸收峰可归属于分子内的n-π*电子跃迁。由于6个配合物具有相同的共轭骨架,因此它们都具有相似的π-π*电子跃迁吸收峰,约为300 nm[41-42]。相比于配合物S1,(-)-W1的最大吸收峰位置有轻微的蓝移,这说明蒎烯基团的引入降低了吡啶环的吸电子能力。当在配合物中酚羟基的对位引入具有给电子能力的叔丁基或甲氧基时,配合物(-)-W2和(-)-W5的最大吸收峰相比于(-)-W1表现出不同程度的红移。其中,(-)-W5的最大吸收峰达到366 nm,可能是由于甲氧基的给电子效应促进了配合物(-)-W5中分子内电荷转移跃迁,导致吸收光谱红移。反之,吸电子基团三氟甲基的引入使得(-)-W3的最大吸收峰相比于(-)-W1蓝移了4 nm。然而,具有吸电子能力的F原子的引入却使得(-)-W4呈现出红移现象,这有可能是由于卤素原子易与苯环形成p-π共轭效应。
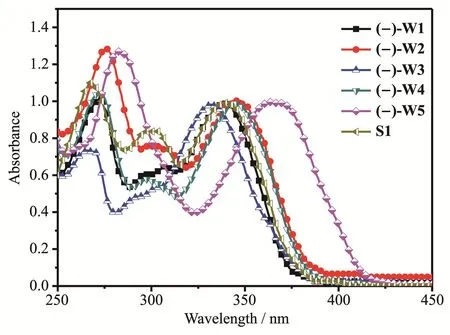
图1 配合物(-)-W1~(-)-W5和S1在二氯甲烷中的吸收光谱Fig.1 Solution absorption spectra of complexes(-)-W1~(-)-W5 and S1 in CH2Cl2
另一方面,我们研究了不同溶剂对配合物(-)-W1~(-)-W5和S1吸收光谱的影响,最大吸收峰波长数据列于表1。结果表明,在甲醇(MeOH)、乙腈(ACN)等强极性溶剂中,氟硼配合物的最大吸收峰发生了蓝移,而在弱极性溶剂1,4-二氧六环(DIO)中发生了红移。这进一步说明了配合物在长波长的吸收峰源自分子内电荷转移跃迁。
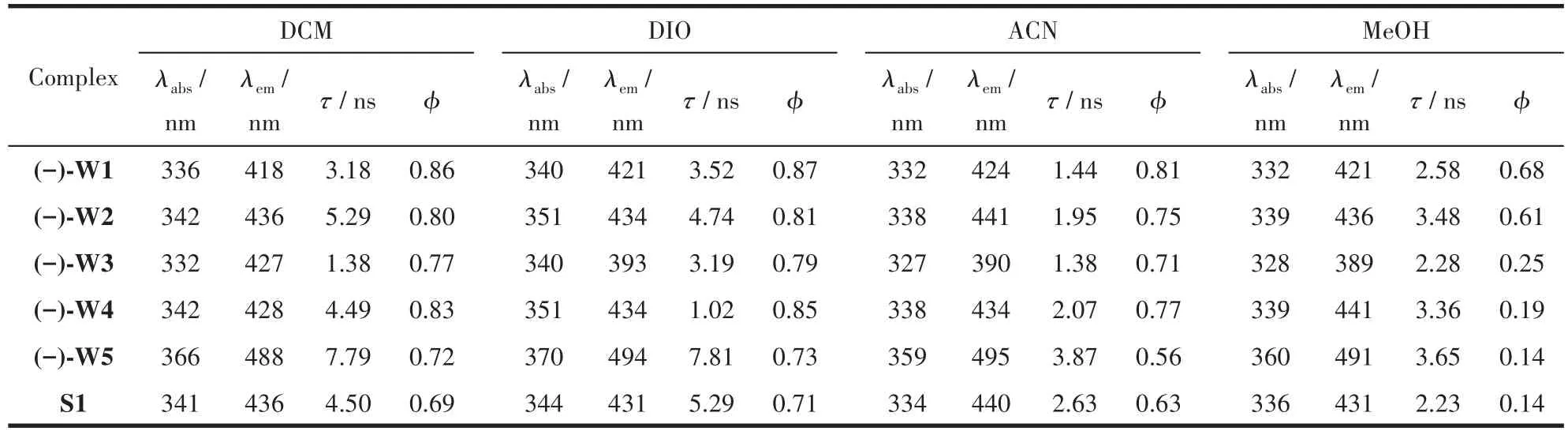
表1 配合物(-)-W1~(-)-W5和S1在不同溶剂中的光学性质Table 1 Optical properties of complexes(-)-W1~(-)-W5 and S1 in different solvents
2.2 氟硼发光配合物的发射光谱

图2 配合物(-)-W1~(-)-W5和S1在二氯甲烷中的荧光发射光谱Fig.2 Fluorescence emission spectra of complexes(-)-W1~(-)-W5 and S1 in CH2Cl2
我们首先对氟硼配合物在DCM溶液中的光致发光光谱进行了表征。如图2所示,配合物(-)-W1相比S1的发射峰呈现出约为18 nm的蓝移,通过计算得出其Stokes位移相比于配合物S1减小了13 nm,这说明刚性基团蒎烯的引入可能使配合物激发态结构变化,能量损失变小。当在酚羟基的对位上引入叔丁基、三氟甲基、氟、甲氧基时,使得配合物(-)-W2~(-)-W5与(-)-W1相比,分别产生18、19、10、64 nm的红移。这一结果表明,随着酚羟基对位基团给电子能力的增强,配合物发射峰红移程度更加明显,其中含有强给电子取代基OCH3的配合物的发射峰达到了488 nm。此外,我们还研究了不同溶剂对配合物发光光谱的影响。表1列出了(-)-W1~(-)-W5和S1在不同溶剂中的最大发射峰波长。结果表明溶剂的变化只会导致配合物(-)-W1、(-)-W2、(-)-W4、(-)-W5和S1的发射峰波长产生轻微的偏移。然而溶剂的变化对(-)-W3发射峰位置产生了比较大的影响。具体原因还不太清楚,将在后续研究中深入探讨。
2.3 氟硼发光配合物的荧光寿命
我们对氟硼发光配合物(-)-W1~(-)-W5和S1在不同溶液中的荧光衰减曲线进行了表征(图S19~S24)。如图3所示,在DCM为溶剂时,蒎烯基团的引入使得配合物(-)-W1的荧光寿命相比于配合物S1有一些降低。而辅助取代基的引入会导致配合物的荧光寿命总体呈现规律性的变化(表1):在DCM中,配合物荧光寿命的递减趋势为(-)-W5>(-)-W2>(-)-W4>(-)-W1>(-)-W3;在DIO中,配合物荧光寿命的递减趋势为(-)-W5>(-)-W2>(-)-W1>(-)-W3>(-)-W4;在ACN中,配合物荧光寿命的递减趋势为(-)-W5>(-)-W4>(-)-W2>(-)-W1>(-)-W3;在MeOH中,配合物荧光寿命的递减趋势为(-)-W5>(-)-W2>(-)-W4>(-)-W1>(-)-W3。由此可见,在酚羟基对位上引入给电子基团会不同程度地延长配合物的荧光寿命,当取代基为给电子能力最强的甲氧基时,配合物(-)-W5具有最长的荧光寿命;当引入强吸电子基团CF3时则会缩短配合物的荧光寿命。

图3 配合物(-)-W1~(-)-W5和S1在二氯甲烷中的荧光衰减曲线Fig.3 Photoluminescence decay of complexes(-)-W1~(-)-W5 and S1 in CH2Cl2
2.4 氟硼发光配合物的荧光量子效率
我们对氟硼配合物在不同溶液中的荧光量子产率进行了测试。如表1所示,蒎烯基团的引入使得配合物(-)-W1相比于S1具有更高的荧光量子产率。在非质子溶剂中,蒎烯类氟硼配合物的荧光量子产率大小顺序为(-)-W1>(-)-W4>(-)-W2>(-)-W3>(-)-W5。这表明辅助取代基的引入会降低配合物的荧光量子产率,其中含甲氧基的配合物(-)-W5具有最低的荧光量子产率。此外,较大体积的取代基(叔丁基和三氟甲基)的引入相比于氟取代基更容易降低配合物的荧光量子产率。在质子溶剂甲醇中,含 F、CF3和 OCH3的配合物(-)-W3、(-)-W4 和(-)-W5的荧光量子产率有很大幅度的降低,这有可能是因为这些取代基与溶剂分子之间存在一定的相互作用导致了荧光淬灭。
2.5 氟硼发光配合物对映体的圆二色光谱
由于蒎烯是一个潜在的手性基团,在配合物(-)-W1~(-)-W5的合成过程中采用了(-)-桃金娘烯醛作为手性源。为了研究氟硼配合物的圆二色(CD)光谱,我们又以(-)-桃金娘烯醛作为手性源按照相似的方法合成它们的对映体(+)-W1~(+)-W5。如图4和S25~S28所示,手性蒎烯基团的引入使得吡啶基苯酚氟硼化合物具有一定的光学活性,且与蒎烯基团中碳原子的绝对立体构型密切相关,对映体的圆二色光谱信号均一一对应。

图4 (-)-W1和(+)-W1的分子结构及其在二氯甲烷中的CD光谱Fig.4 Molecular structures and CD spectra in CH2Cl2of(-)-W1 and(+)-W1
3 结 论
我们通过分子设计,将手性蒎烯基团引入到苯酚基吡啶氟硼体系,制备了一系列手性氟硼配合物。通过对新型蒎烯类苯酚基吡啶氟硼配合物光学性质的研究,表明辅助取代基的吸/给电子能力、空间位阻等对配合物光学性质具有一定的影响,且呈现出一定的规律性。该类新型氟硼配合物具有很强的蓝光发射性质,且发射波长可以通过分子设计进行调控,这为后续设计新型蒎烯类苯酚基吡啶氟硼发光配合物及其全光谱调控奠定了基础。此外,本文创新性地研究了氟硼配合物手性对映体的圆二色光谱,对拓展氟硼配合物的光学活性研究具有借鉴意义。
Supporting information is available at http://www.wjhxxb.cn
