磁性水热炭对重金属离子铅的吸附性能研究
2020-09-09吴凡何宗文刘雪梅黄晶
吴凡,何宗文,刘雪梅,黄晶
(1.华东交通大学 土木建筑学院,江西 南昌 330013;2.丰城市水利局,江西 丰城 331100)
人们在生活生产过程中会产生大量重金属废水,比如电镀冶金、采矿化工等[1-2],产生的重金属离子进入水体不可降解,最终通过食物链进入人体中[3],对人体健康造成危害[4]。重金属废水的传统处理方法通常有化学沉淀法、离子交换法、电解法、膜分离法等[5-11],但是这些传统方法处理效率低且成本费高。吸附法具有简便经济、高效稳定和吸附容量大等特点,廉价的农林废弃物成为我们研究的对象,本实验以橘子皮作为生物吸附材料并对其进行改性,研究其对Pb2+的吸附性能,并拟合了动力学方程和等温吸附模型,为橘子皮处理工业废水提供理论基础。
1 实验部分
1.1 试剂与仪器
铅标准储备液(1 000 mg/L)、硫酸、FeCl3、FeSO4·7H2O、氨水、氢氧化钠、盐酸等均为优级纯。
MJ-PB80Easy218破壁机;DF-101s集热式数显磁力搅拌器;SHZ-82A数显水浴恒温振荡箱;pHS-3E型pH计;AL204型电子分析天平;PE900T原子吸收光谱仪;3-5W低速离心机;DZF系列真空干燥箱;SHZ-D(III)真空抽滤机。
1.2 实验方法
橘子皮(OP)经自来水洗2遍,用去离子水浸泡24 h,再用去离子水清洗3遍,于80 ℃鼓风干燥箱内烘干至恒重,用破壁机粉碎过40目筛,备用。
水热炭的制备:称取20 g OP粉末于反应釜中,加入100 mL稀硫酸溶液(1.84 mol/L),240 ℃下炭化12 h后取出冷却至室温,倒出反应釜中得炭化橘子皮,用去离子水洗至中性,80 ℃真空干燥12 h,收集炭化的材料即为橘子皮水热炭,装在收纳袋中备用。
水热炭负载磁性纳米材料的制备:将盛有200 mL超纯水的四口烧瓶,通氮气1 h,使容器内无氧化后加5.24 g七水硫酸亚铁(FeSO4·7H2O)和3.64 g硫酸铁[Fe2(SO4)3][n(Fe3+)∶n(Fe2+)=2∶1]至溶解完全。随后加2.4 g水热炭及15 mL、28%氨水(NH3·H2O)剧烈搅拌反应0.5 h,密闭静置1 h,去离子水洗至中性,在80 ℃真空干燥箱里干燥12 h后,得到磁性水热炭,装在收纳袋中备用。
1.3 模拟废水的配制
称取经过烘箱100 ℃干燥后的硝酸铅1.599 g于1 L烧杯中,加入少量水溶解,之后定容于1 L的容量瓶中。此溶液浓度为1 000 mg/L,用于配制相对浓度的铅模拟废水水样。
1.4 Pb2+的测定
在实验环境达到优化的状况下,在一系列50 mL的容量瓶中配制出0.00,1.00,2.00,3.00,4.00,5.00 mg/L的铅离子标准溶液。采用原子吸收光谱仪(Perkin Elmer 900T)测定标准曲线,得出铅离子曲线的相关系数R2为0.999 95,每个样测3次取平均值且相对标准偏差(RSD)要<5%,Pb的校正曲线见图1。由此,之后吸附后的废液Pb2+浓度全由原子吸收光谱仪测定。

图1 Pb校准曲线
1.5 Pb2+的吸附实验
准确量取一定浓度含铅模拟废水50 mL,于8个150 mL锥形瓶中,加入一定量的吸附剂,用0.1 mol/L的HCl和0.1 mol/L的NaOH调节溶液的初始pH值;在水浴恒温振荡器30 ℃条件下恒温振荡2 h,以恒定速率为150 r/min振荡,抽滤取上清液于50 mL的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率和吸附量。整个实验研究了吸附剂投加量、初始溶液的pH值、吸附时间、初始离子浓度、离子竞争吸附等因素对吸附实验去除Pb2+的行为影响。
1.6 分析方法
1.6.1 去除率及吸附量的计算 吸附实验中,吸附效果的好坏用两个重要的指标去除率(η)和吸附吸附量(qe)来反映。去除率η是吸附前后废水中离子浓度量的比值,qe是单位质量吸附剂吸附废水中离子的质量。
去除率η的计算公式如下:
(1)
吸附量qe的计算公式如下:
(2)
其中η——去除率,%;
qe——平衡吸附量,mg/g;
C0——吸附前离子的初始浓度,mg/L;
Ce——吸附后离子的平衡浓度,mg/L;
V——吸附溶液体积,L;
m——吸附剂的质量,g。
1.6.2 吸附动力学 吸附动力学研究吸附剂对离子的吸附过程及机理分析,一般采用准一级动力学方程、准二级动力学方程及颗粒内扩散方程对实验数据进行拟合。其方程式如下:
准一级动力学方程:
ln(qe-qt)=lnqe-k1t
(3)
准二级动力学方程:
(4)
其中,k1为准一级吸附速率常数(h-1);k2为准二级吸附速率常数[g/(mg·h)];qe和qt分别为平衡吸附量和在t时的吸附量(mg/g);t为时间。
颗粒内扩散方程:
qt=kit1/2+C
(5)
式中,qt为在t时的吸附量(mg/g);ki为颗粒内扩散速率常数[mg/g·min0.5];t为时间;C为截距。
1.6.3 等温吸附模型 通常等温吸附模型有Langmuir和Freundlich两种。Langmuir等温模型适合描述单分子层的吸附,假设吸附剂表面结构均匀,被吸附的分子间不存在纵横向作用力;Freundlich模型描述的是介于单层与多层吸附之间的模型,其表面结构的不均匀表明吸附的多样性和异质性。实验得出的数据用Langmuir和Freundlich等温吸附方程进行拟合。其方程式如下:
Langmuir等温吸附方程为:
(6)
式中Ce——平衡时污染物的浓度,mg/L;
qe——平衡吸附量,mg/g;
qm——饱和吸附容量,mg/g;
KL——Langmuir吸附平衡常数,L/mg。
Freundlich等温吸附方程为:
(7)
式中,qe为吸附达到平衡时的吸附容量;KF为Freundlich平衡吸附系数;n为特征常数,反映吸附剂的表面不均匀性,以及吸附强度的相对大小;Ce为吸附达到平衡时溶液中污染物的浓度。
2 结果与讨论
2.1 投加量对吸附Pb2+性能的影响
准确量取铅标准使用液(50 mg/L)50 mL,于8个150 mL锥形瓶中,分别称取磁性水热炭0.02,0.04,0.05,0.06,0.07,0.08,0.09,0.10 g,在30 ℃下恒温振荡2 h,以恒定速率为150 r/min振荡,抽滤取上清液于50 mL的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率,测定结果见图2。
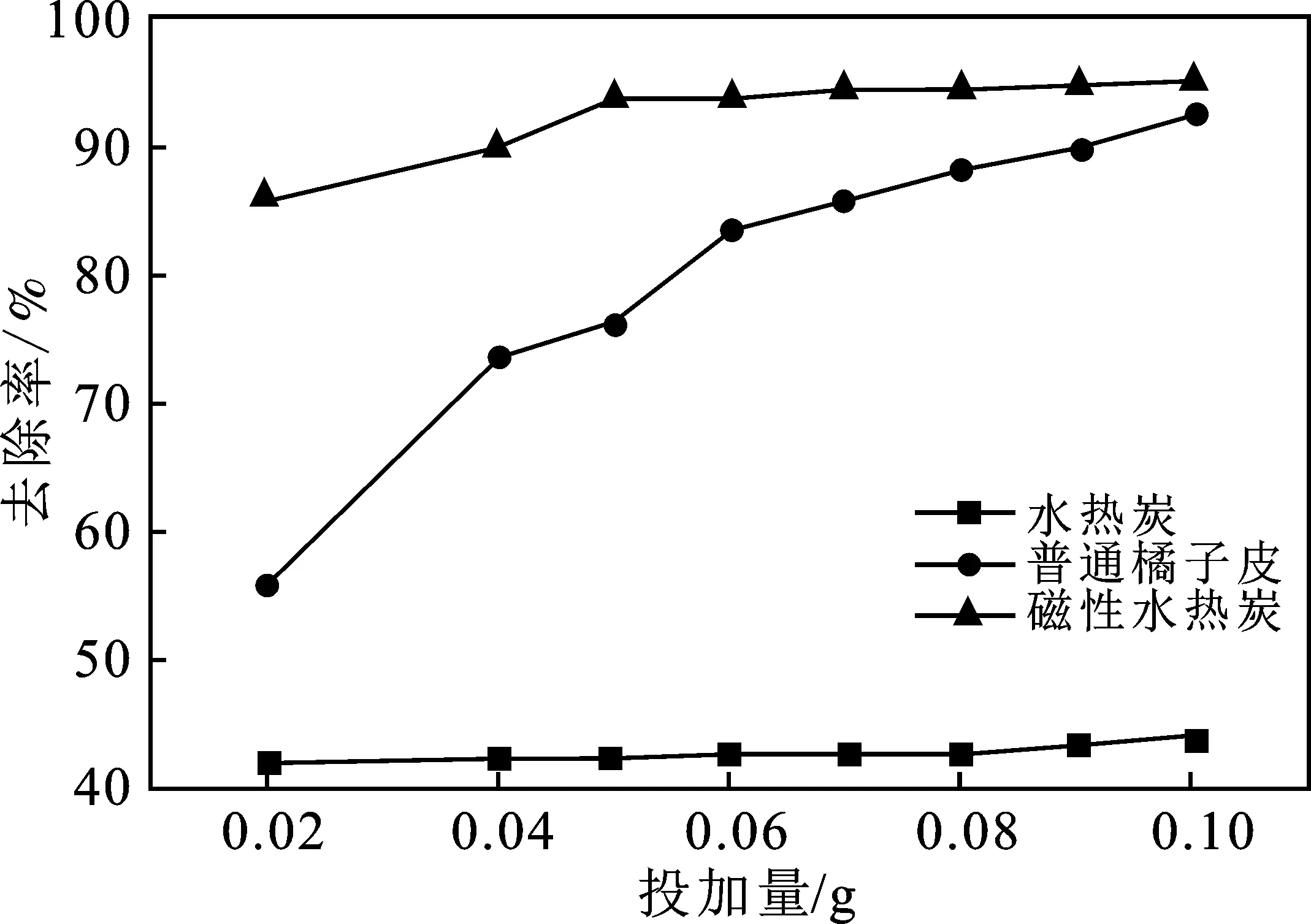
图2 投加量对吸附性能的影响
由图2可知,水热炭对Pb2+的吸附效果比原橘子皮还差,但负载磁性材料后,其吸附效果出现转变。随着吸附剂的投加量越多吸附去除率越高,磁性水热炭对Pb2+吸附的去除率从85.79%增加到94.98%,普遍高于普通橘子皮和水热炭的去除效果。去除率的增加可能是由于随着投加量的增加提供了大量的活性位点且固液表面接触面积增多,使得与官能团结合的Pb2+也增加,由于水热炭的比表面积和孔隙度也比较大,自然去除率越来越高。虽然去除率变高,但吸附量从107.24 mg/g 减少到23.495 mg/g,因此我们要考虑到经济成本问题来确定最佳投加量。改性橘子皮的投加量到0.05 g时之后变化幅度很小,说明吸附达到基本的饱和状态。当投加量为0.05 g时,去除率为93.85%及吸附量为46.93 mg/g,也高于普通橘子皮的去除率76.32%和吸附量38.16 mg/g。考虑到吸附量和去除率等因素,确定最佳投加量为 0.05 g(1 g/L)。
2.2 溶液初始pH值对吸附Pb2+性能的影响
溶液pH是研究吸附效果的一大关键性因素,由于pH值为7.5时,铅离子会以Pb(OH)2形式沉淀。所以溶液pH值的大小对实验研究有很大的影响,控制pH值是实验的重要因素。准确量取铅标准使用液(50 mg/L)50 mL,于8个150 mL锥形瓶中,称取磁性水热炭0.05 g,用0.1 mol/L的HCl和0.1 mol/L的NaOH分别将溶液的初始pH值调节为2,3,4,4.5,5,5.5,6,7;在30 ℃下恒温振荡2 h,以恒定速率为150 r/min振荡,抽滤取上清液于50 mL 的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率。
由图3可知,磁性水热炭与普通橘子皮的变化趋势比较相似,不同的是普通橘子皮的最适pH为5.5,而磁性水热炭的为5.0。初始溶液的pH较小时,磁性水热炭与普通橘子皮的吸附去除率小,随着pH的增大,去除率也变大,当pH由2增加到5.0时,对Pb2+的去除率由23.53%增大到93.88%。造成吸附去除率小的原因可能是H+与Pb2+形成竞争吸附,从而降低了吸附率。H+与金属离子Mn+的竞争性吸附是pH影响的主要原因,pH越小时,H+占据了大部分吸附位点,阻碍了Mn+的吸附结合,所以H+浓度越高吸附率越小。当溶液pH值增大时,H+浓度减小吸附率变大,但pH 5.0之后吸附百分率几乎不变甚至有微小的减少。所以控制溶液的pH值为5.0,达到磁性水热炭对Pb2+的最佳吸附条件。

图3 pH对吸附性能的影响
2.3 吸附时间对吸附Pb2+性能的影响
准确量取铅标准使用液(50 mg/L)50 mL,于8个150 mL锥形瓶中,称取磁性水热炭0.05 g,将溶液的初始pH值调节为5.5,在30 ℃下恒温振荡20,40,60,70,80,90,100,120 min,以恒定速率为150 r/min振荡,抽滤取上清液于50 mL的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率。
30 ℃下,吸附去除率随时间变化见图4。由图4可知,磁性水热炭和普通橘子皮对Pb2+的吸附在短时间迅速达到平衡。在20 min之后,普通橘子皮对Pb2+的去除率基本维持在88%左右,基本达到吸附饱和。同时磁性水热炭对Pb2+的吸附在20 min之后吸附率就维持在93%~94%,说明磁性水热炭对Pb2+的吸附在20 min也基本达到吸附平衡。还可以从图中看出,磁性水热炭比普通橘子皮在时间范围内吸附去除率都要高,磁性水热炭的最大吸附量为46.865 mg/g也高于普通橘子皮的最大吸附量44.74 mg/g。
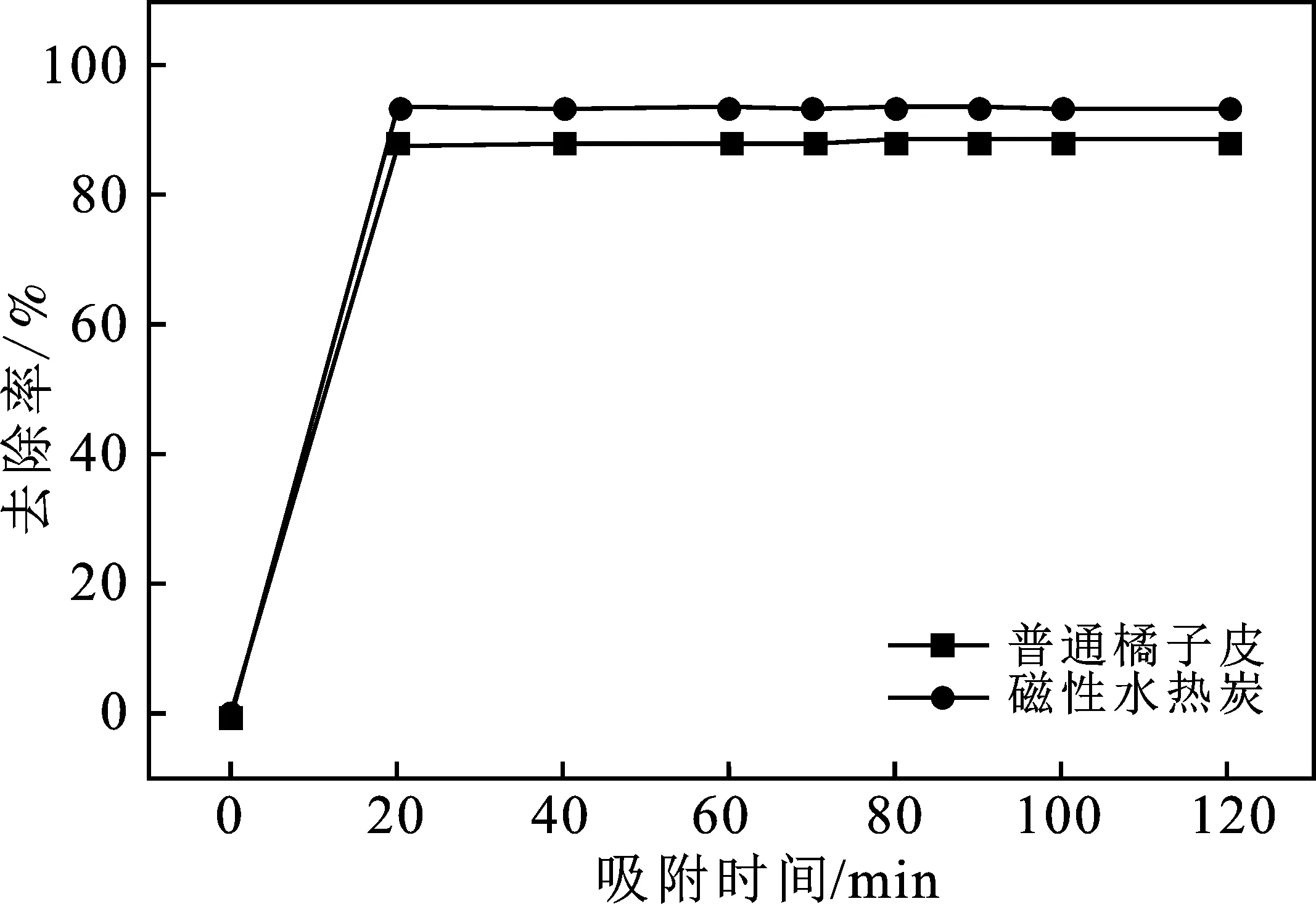
图4 时间对吸附性能的影响
2.4 动力学性能研究
取8个150 mL的锥形瓶,每个锥形瓶中,将0.05 g的磁性水热炭加入到50 mL,50 mg/L的铅离子溶液中,在pH=5.0,30 ℃恒温水浴下,以恒定速率150 r/min振荡,分别振荡20,40,60,70,80,90,100,120 min后,抽滤取上清液于50 mL的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率。
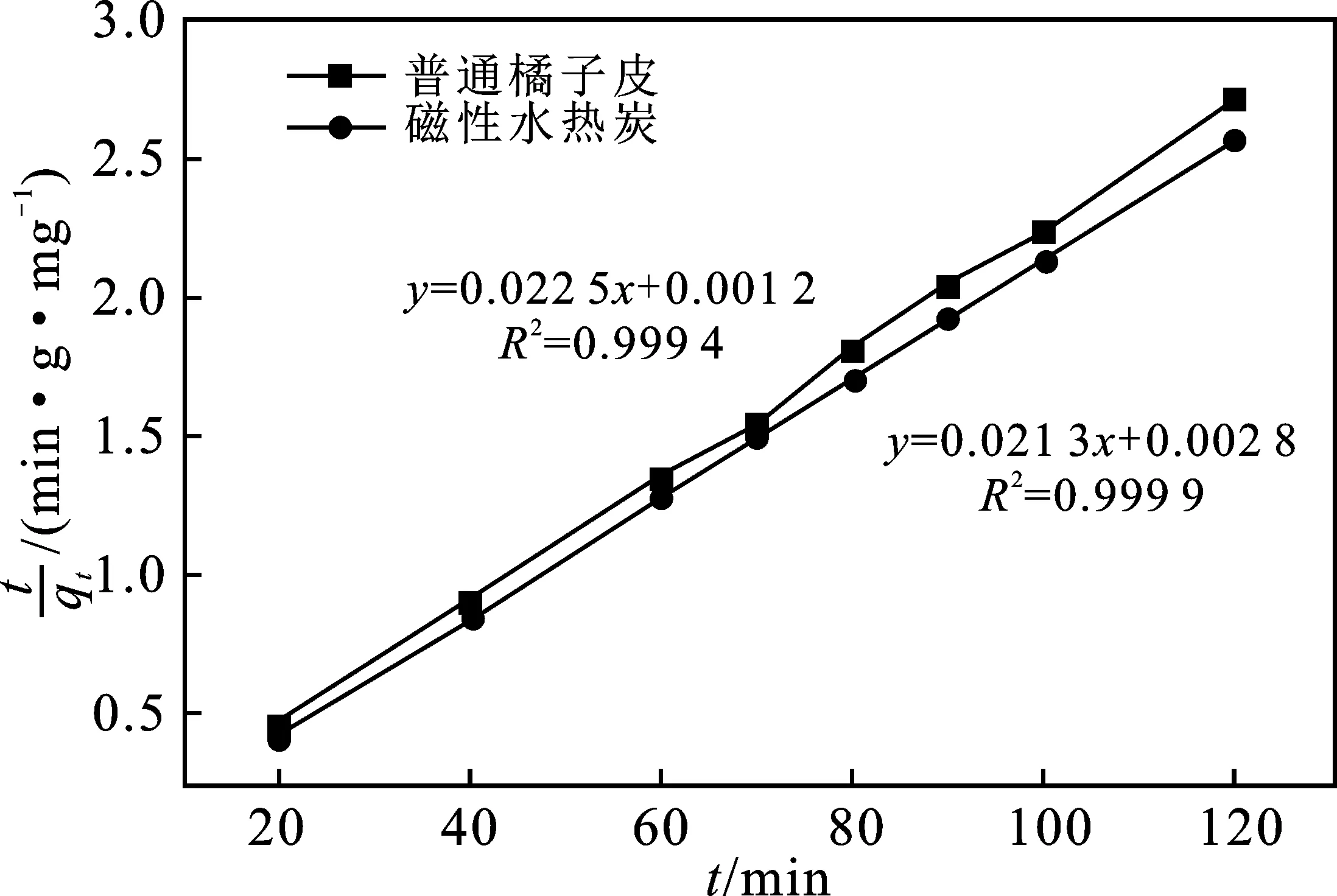
图6 准二级吸附动力学方程模拟结果
利用动力学方程式对图4数据模拟,结果见图5~图7。从3个图相比来看,磁性水热炭与普通橘子皮都可以很好地用准二级动力学方程进行模拟,模拟的相关系数可以达到0.999 4以上,且磁性水热炭模拟的结果更好,其相关系数达到0.999 9。再从表1中可看出,无论是普通橘子皮还是磁性水热炭,模拟结果的准二级动力学相关系数要大于准一级动力学和内扩散,表明普通橘子皮与磁性水热炭的吸附过程都遵循准二级反应机理,属于化学吸附。
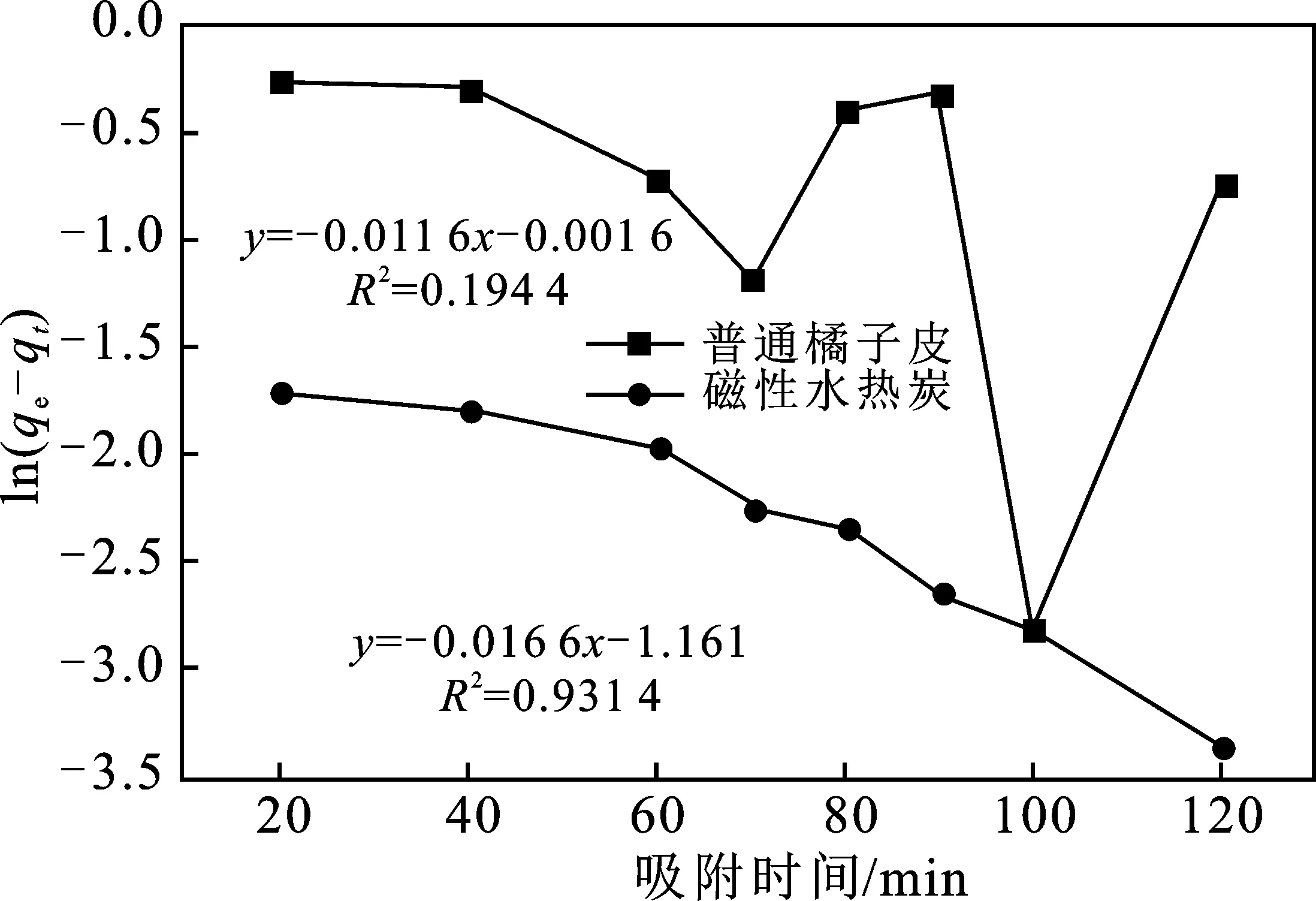
图5 准一级吸附动力学方程模拟结果

图7 内扩散吸附动力学方程模拟结果
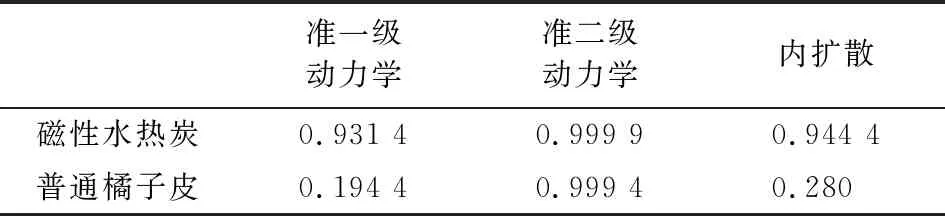
表1 准一级动力学、准二级动力学和内扩散模拟实验数据的相关系数R2
2.5 等温吸附性能研究
取8个150 mL的锥形瓶,每个锥形瓶中,将0.05 g的磁性水热炭加入到50 mL,铅离子溶液初始浓度分别为10,20,40,50,60,80,100,150 mg/L中,在pH=5.0,30 ℃恒温水浴下,以恒定速率150 r/min 振荡2 h后,抽滤取上清液于50 mL的比色管中,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率。
由图8可知,磁性水热炭在30 ℃下对Pb2+的吸附等温线,平衡吸附量随着金属离子浓度的增加而增加。在Pb2+的浓度为10~150 mg/L内,对Pb2+的吸附量随Pb2+的浓度的增大而增加,磁性水热炭对Pb2+的吸附几乎成直线增加,吸附量从9.426 mg/g 增加到124.185 mg/g。等温吸附模型用Langmuir和Freundlich两种模型描述,已知Ce和qe,根据式(6),以Ce作横坐标和qe作纵坐标,作图得Langmuir方程见图9;根据式(7),以lgCe作横坐标和qe作纵坐标,作图得Freundlich方程,见图10。
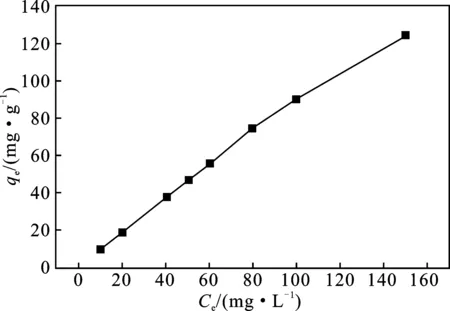
图8 吸附等温线
根据图9和图10的吸附等温线,可得出相关吸附等温模型方程及相关参数,见表2。

图9 Langmuir吸附等温式
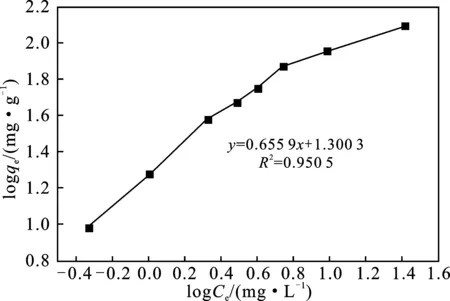
图10 Freundlich吸附等温式

表2 吸附等温线方程拟合参数
图9、10是以Langmuir和Freundlich等温吸附模型模拟磁性水热炭吸附Pb2+的结果,从图中可以看出,磁性水热炭对Pb2+的吸附均符合Langmuir和Freundlich模型,与Langmuir吸附等温方程拟合的相关系数分别为0.997 6,与Freundlich吸附等温方程拟合的相关系数分别为0.950 5。相比Freundlich吸附等温线,Langmuir吸附等温线更符合实验数据,可以认为吸附过程是单分子层吸附,所以磁性水热炭对Pb2+的吸附以化学吸附为主。
2.6 其他离子竞争吸附性能的影响
分别配制50 mg/L+200 mg/L、100 mg/L+200 mg/L 和150 mg/L+200 mg/L的Cu2+/Pb2+体系溶液,Cd2+/Pb2+和Ni2+/Pb2+体系溶液同上,各取200 mL。将0.2 g的磁性水热炭加入到上述200 mL的混合溶液中,在pH=5.0,30 ℃恒温水浴下,以恒定速率150 r/min振荡2 h后,抽滤取上清液,然后稀释10倍于原子吸收光谱仪上测定其浓度,计算吸附去除率。
工业废水中含有多种阳离子,例如Cu2+、Ni2+、Cd2+等离子,会与需要去除的金属离子竞争吸附点位,从而对吸附产生干扰,出现竞争吸附效应。本实验考察了Cd2+、Ni2+和Cu2+对磁性水热炭吸附Pb2+的影响,结果见图11。
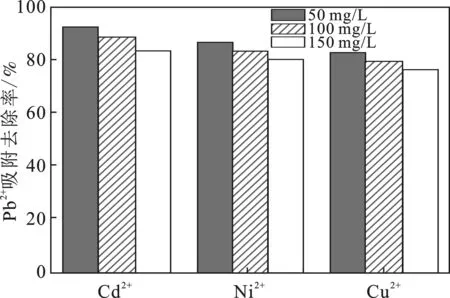
图11 不同阳离子存在时对Pb2+的吸附去除率
由图11可知,竞争离子浓度越大,吸附影响就越大,在Cd2+浓度为50,100,150 mg/L时,Pb2+的去除率分别为92.22%,86.41%,82.79%,同样的条件下(Ni2+和Cu2+),去除率分别为(88.64%,83.58%,79.37%)和(83.26%,80.11%,76.63%),随着竞争离子的浓度增大,其对Pb2+的去除效果都会相应的减少。而且不同离子对Pb2+吸附效果影响大小不同,图11中得出影响结果大小是Cu2+>Ni2+>Cd2+。由表3可知,4种离子的基本物理化学性质来分析竞争吸附影响[12],一般认为原子量越大,能量越大,越容易与吸附剂表面碰撞,从而更容易被吸附,说明Pb2+最容易被吸附,其它离子只能形成竞争影响,但理论顺序(Cd2+>Cu2+>Ni2+)与吸附影响效果实际顺序(Cu2+>Ni2+>Cd2+)不一致;离子半径越小,对竞争吸附得影响更大,由于Cu2+与Ni2+的离子半径相差不大,则可认为离子半径理论顺序(Cu2+≥Ni2+>Cd2+)与吸附影响效果实际顺序(Cu2+>Ni2+>Cd2+)较一致;电负性越大,对吸附剂表面的吸引力越强,被吸附可能性更大,电负性的理论顺序(Cu2+>Ni2+>Cd2+)与吸附影响效果实际顺序(Cu2+>Ni2+>Cd2+)一致;标准还原电位大小表示呈负电的吸附剂与金属离子的相互作用,与吸附影响效果实际顺序完全不一致。因此影响竞争吸附的效果主要是与离子电负性和离子半径有关,对吸附的影响也较大。
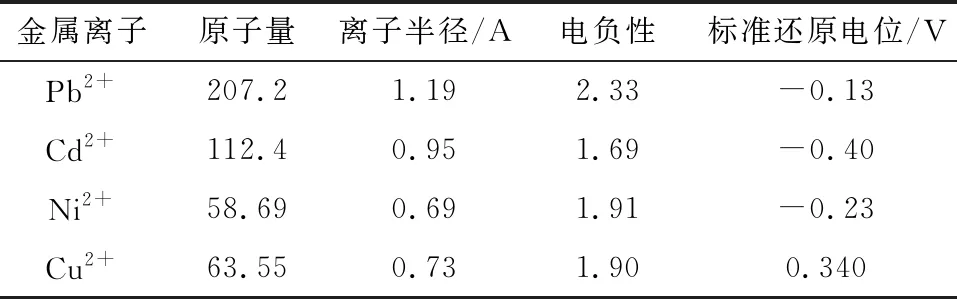
表3 Pb2+、Cd2+、Ni2+、Cu2+四种离子的基本物理化学性质Table 3 Basic physical and chemical properties of Pb2+,Cd2+,Ni2+ and Cu2+ ions
2.7 解吸再生实验
向达到吸附平衡的磁性水热炭中加入100 mL,0.1 mol/L的NaOH,恒温恒速振荡5 h,过滤水洗至中性,烘干再进行吸附。将0.05 g烘干后的磁性水热炭加入到50 mL、50 mg/L的模拟废水中,恒温恒速振荡2 h,抽滤取上清液于50 mL的比色管中,稀释10倍于原子吸收光谱仪上测定浓度。重复利用次数及橘子皮对Pb2+的吸附效果见图12。
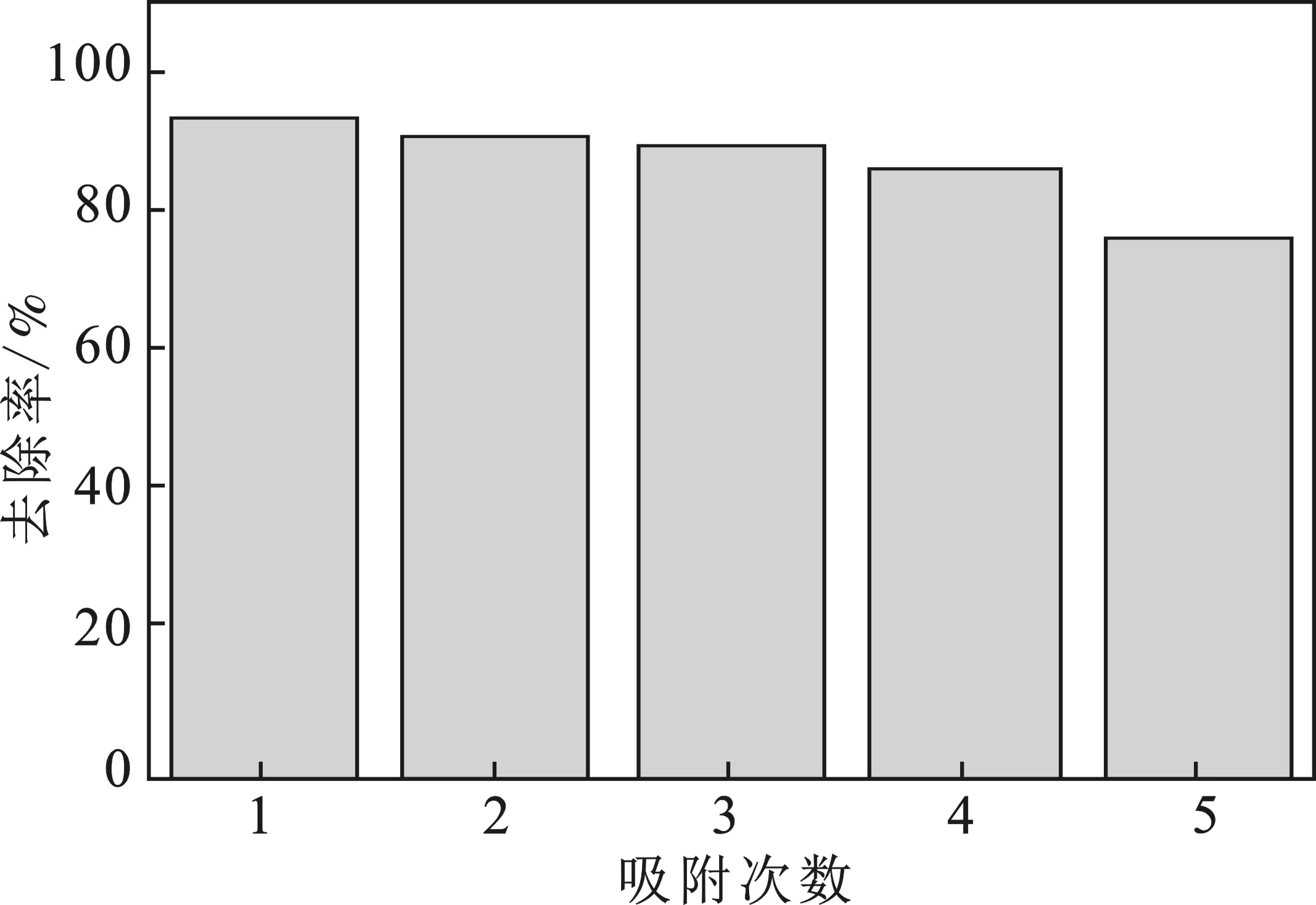
图12 吸附性能再生利用
对已经吸附完Pb2+的磁性水热炭投入0.1 mol/L的NaOH溶液进行解吸,解吸完后的吸附材料再进行吸附性能研究。结果见图12,再生后的吸附材料依然具有很好的吸附效果,第1次93.62%,第2次91.12到第4次的86.38%,第5次为76.35%。说明随着吸附解吸的次数增加,材料慢慢失去了磁性,表面活性点位被铅离子占据,活性点位减少,使得去除率降低,但也证明磁性材料具有一定的重复循环利用性,在保持80%以上至少可以重复利用4次。
3 结论
本实验通过水热炭负载磁性纳米Fe3O4对Pb2+有效吸附的方法研究,得出磁性水热炭对Pb2+具有较好的吸附性能。并可以得出以下结论:
(1)通过静态吸附实验,结果表明,磁性水热炭对Pb2+吸附的最佳条件初始离子浓度为50 mg/L,pH为5和投加量0.05 g,30 ℃下,在20 min内吸附去除率能达到93.88%,吸附量为46.94 mg/g。
(2)Langmuir等温吸附模型可以很好的模拟实验结果,吸附动力学可以用准二级动力学方程描述,表明磁性水热炭对Pb2+的吸附过程属于单分子层的化学吸附过程。
(3)Langmuir等温模型描述出磁性水热炭的最大吸附量为127.69 mg/g,均高于改性前的105.77 mg/g。这表明磁性水热炭相比起普通橘子皮的吸附性能得到了提高。
(4)原子量越大能量越大,越加容易与吸附剂表面碰撞,从而更容易被吸附,说明Pb2+最容易被吸附,其它离子只能形成竞争影响。由于影响竞争吸附的效果主要是与离子电负性和离子半径有关,因此不同离子对Pb2+的吸附影响效果也不同,主要是离子半径和离子电负性能与实际吸附顺序(Cu2+>Ni2+>Cd2+)相呼应。
(5)解吸完后的吸附材料进行吸附性能研究,吸附再生5次后,吸附能力下降严重。但是第4次的吸附能力还能维持在80%以上,说明橘子皮具有一定的重复利用性,且可以重复利用4次。
