葛根汤对寒湿凝滞型原发性痛经模型小鼠的治疗作用及其机理研究
2020-09-09刘志刚张荣春刘红梅王志鹏
刘志刚 张荣春 刘红梅 王志鹏
(东南大学附属中大医院,江苏南京210009)
原发性痛经(primary dysmenorrhea,PD)是妇女盆腔结构正常情况下出现的月经期疼痛,其特征是在月经开始前或月经开始时出现的盆腔痉挛性疼痛,通常持续1~3 d[1]。PD的发病率在年轻女性中约为40%~50%[2]。目前认为前列腺素(prostaglandin,PG),尤其是前列腺素F2α(PGF2α),是PD发病的关键因素[2]。非甾体抗炎药物(NSAIDs)常用来治疗本病[1],其作用机制即与抑制前列腺素的合成有关,但NSAIDs仅能暂时缓解疼痛,并没有根治或预防效果,必须在疼痛开始前或开始时服药才能有效缓解疼痛,需要长期用药[3]。这提示必须从根本上持久阻断PGF2α的上游及/或下游通路,方能达到长期缓解的目的。研究显示,缩宫素(oxytocin,OT)[4]、血管升压素(arginine vasopressin,AVP)[5]等均与PD的发病有关,肿瘤坏死因子α(TNF-α)也可以参与子宫内膜PGF2α的调控[6]。
葛根汤是一首经典名方,临床主要用于治疗风寒外袭引起的感冒,“解肌散寒”为其主要功效。我们在临床实践中发现,葛根汤治疗寒湿凝滞型PD效果明显,而且疗效持久,甚至不再复发,说明该方可能从上游及/或下游机制持久地阻断PGF2α,而不是单纯地抑制PGF2α的合成。
目前研究PD的动物模型比较缺乏,最常用的是利用雌激素序贯缩宫素的动物模型,但该模型没有模拟行经样改变。为此,我们采用小鼠子宫内膜行经样模型复合水浸束缚应激模型来模拟人类在寒冷应激情况下出现的痛经反应,构建了小鼠寒湿凝滞型PD模型,并对葛根汤的治疗作用进行了初步研究,这种类似于实际病理生理过程的动物模型将有助于阐明PD的发病机制和药物的作用机制,现报道如下。
1 实验材料
1.1 实验动物 清洁级雌性未孕昆明种小鼠,常州卡文斯实验动物有限公司,8~12周龄,许可证号:SCXK(苏)2016-0010。于恒温(20~23 ℃),恒湿(45%~60%),12 h光照/黑暗交替循环中饲养,自由饮水、进食。实验方法通过伦理委员会审查,符合国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》要求。
1.2 药品与试剂 葛根汤,按照组成药物麻黄∶葛根∶芍药∶桂枝∶甘草∶生姜∶大枣=1∶4∶3∶3∶2∶2∶4的剂量比例,药物购自南京传统中医门诊部,将药物以8倍量清水浸泡30 min,热回流提取1 h后过滤,再加6倍水回流提取40 min,合并2次滤液后浓缩至每毫升约含生药量1 g。根据既往研究结果,虽然葛根汤不同剂量均能抑制缩宫素复合寒冷刺激诱导的PD模型小鼠疼痛扭体反应,但以临床剂量(高剂量)组作用最为明显[7],因此本实验选择临床剂量(14 g/kg体重)作为研究剂量。
布洛芬缓释片(上海上药信谊药厂有限公司生产,规格0.3 g/片,产品批号170323),雌二醇(Sigma,E2758),孕酮(Sigma,V900699),米非司酮(Sigma,M8046),花生油(山东鲁花集团有限公司),缩宫素试剂盒(Enzo Life Sciences公司,ADI-901-153A-0001),PGF2α试 剂 盒(Enzo Life Sciences公司,ADI-901-069),AVP试剂盒(MitoSciences公司,xyB263Mu),TNF-α试 剂 盒(Enzo Life Sciences公司,ADI-900-047)。
1.3 主要仪器 分析天平(浙江宁海白石电子医药仪器厂),冷冻离心机(Sigma),Sunrise酶标仪(奥地利Tecan Gmbh公司)。
2 实验方法
2.1 分组、造模与给药 小鼠随机分为空白对照组、模型组、葛根汤组及阳性对照组,最终各组均为6只。
小鼠子宫内膜行经样模型的制备参照文献[8]方法,小鼠在麻醉下摘除双侧卵巢,恢复2周以清除体内激素后进行下列操作:去势小鼠在第1、2和3天皮下注射0.37 nmol雌二醇;第4~6天不给予任何处理;第7天将孕酮硅胶管埋植于小鼠背部皮下,同时0.16 nmol孕酮、0.02 nmol雌二醇皮下注射;第8、9天皮下注射18.3 nmol雌二醇,第9天注射2 h后,向小鼠双侧子宫角各注射20 µL花生油,向子宫腔内注射40 µL花生油,以刺激子宫腔上皮启动蜕膜化信号途径诱导蜕膜化;48 h后,即第11天,米非司酮(120 mg/kg)灌胃。造模时间从卵巢摘除2周后注射雌二醇开始计算。在造模第12天,即米非司酮处理后的24 h后对小鼠进行阴道脱落细胞学检查,涂片置95%乙醇固定10 min后观察红细胞出现情况。如可见红细胞,说明造模成功。如未见红细胞,后每隔4 h进行阴道涂片,直至见到红细胞为止。
除空白对照组,其余各组小鼠在行经模型诱导过程中同时完成以下操作:在去势恢复2周后的第1~12天将小鼠置于束缚笼后放置(8±0.5)℃冷水水浴中,浸泡1 h,每日1次。
去势恢复2周后的第1天开始,葛根汤组给予葛根汤14 g·kg-1·d-1灌胃,阳性对照组给予布洛芬0.12 g·kg-1·d-1灌胃,空白对照组和模型组给予等容积生理盐水,各组给药均持续12 d。
2.2 指标观察 造模第12天,阴道脱落细胞学检查发现红细胞后实验结束。将各组小鼠麻醉后,打开腹腔,腹主动脉取血,再分离取出子宫,进行指标观察。
2.2.1 HE染色观察小鼠子宫组织病理形态 取出子宫后用10%福尔马林固定,石蜡包埋,HE染色进行组织学观察。主要观察子宫组织血管分布及炎性细胞浸润情况。
2.2.2 ELISA法检测血清及子宫组织PGF2α、OT、TNF-α及AVP水平 各组小鼠取血后,常温静置30 min,离心半径为8 cm,3 500 r/min,离心15 min,取血清,-70 ℃保存备测。分离出的子宫,剔除脂肪组织,用电子分析天平称取子宫的质量,以每克子宫组织加9倍量生理盐水用匀浆机制备10%组织匀浆,离心半径为8 cm,3 000 r/min,低温离心10 min,分离出上清液,-70 ℃保存。按照ELISA试剂盒说明书检测各组小鼠血清和子宫组织中PGF2α、OT、TNF-α及AVP的含量。
3 实验结果
3.1 各组小鼠子宫组织病理形态比较 子宫组织病理学观察发现,模型组较空白对照组血管偏少,间质致密,炎性细胞增生、浸润;阳性对照组较模型组血管更丰富,间质疏松,炎性细胞浸润减少;葛根汤组较模型组血管更少,间质紧密,炎性细胞浸润相对较少,成纤维细胞增生减少。见图1。
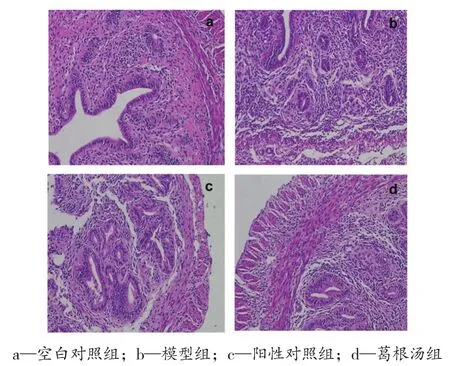
图1 各组小鼠子宫内膜病理组织学变化(×100)
3.2 各组小鼠血清及子宫组织中PGF2α、OT、TNF-α、AVP含量比较 与空白对照组比较,模型组小鼠血清和子宫组织PGF2α、OT、TNF-α和AVP水平明显升高(P<0.05,P<0.01)。与模型组比较,阳性对照组小鼠血清及子宫组织PGF2α、OT、TNF-α和AVP水平均明显降低(P<0.05,P<0.01);葛根汤组小鼠血清及子宫组织PGF2α、TNF-α和AVP水平明显降低(P<0.05,P<0.01),血清OT水平明显降低(P<0.01)。葛根汤组小鼠血清PGF2α、OT及TNF-α水平,子宫组织OT水平明显高于阳性对照组(P<0.05,P<0.01)。见表1、表2。
表1 各组小鼠血清PGF2α、OT、TNF-α和AVP含量比较()

表1 各组小鼠血清PGF2α、OT、TNF-α和AVP含量比较()
注: 与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01。
血管升压素(AVP,ng/mL)空白对照组 6 13.70±0.91 131.94±2.93 1.34±0.04 8.72±0.46模型组 6 17.52±1.26** 146.12±4.92** 1.42±0.04* 12.67±1.06**阳性对照组 6 11.86±1.72## 118.12±7.68## 1.20±0.10## 9.32±0.84##葛根汤组 6 15.48±0.65#△ 134.65±5.94##△△ 1.30±0.02##△△ 10.43±1.96##组别 动物数/只 前列腺素F2α(PGF2α,ng/mL)缩宫素(OT,pg/mL)肿瘤坏死因子α(TNF-α,ng/mL)
表2 各组小鼠子宫组织PGF2α、OT、TNF-α和AVP含量比较()

表2 各组小鼠子宫组织PGF2α、OT、TNF-α和AVP含量比较()
注: 与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与阳性对照组比较,△P<0.05。
血管升压素(AVP,pg/mg)空白对照组 6 103.91±7.66 93.81±3.65 20.84±3.49 7.55±2.05模型组 6 115.75±8.31** 102.47±8.50* 25.40±3.48** 12.94±2.08**阳性对照组 6 106.08±4.36# 87.40±6.00## 18.64±2.72## 9.30±0.88##葛根汤组 6 105.72±6.69# 95.28±5.81△ 21.15±2.60# 10.41±0.95##组别 动物数/只 前列腺素F2α(PGF2α,pg/mg)缩宫素(OT,pg/mg)肿瘤坏死因子α(TNF-α,pg/mg)
4 讨论
虽然目前已明确地认为PG,尤其是PGF2α异常升高,在PD的发病过程中发挥关键作用,但是从抑制前列腺素合成的一线治疗药物NSAIDs仅能暂时缓解疼痛,不能预防痛经的反复发作来看,推测降低PGF2α周期性异常升高是“治愈”PD的途经之一,而明确PD患者子宫内膜PGF2α异常升高的机制可能是阐明该病发病机制的重要途径。PGF2α的升高不仅是PD发生的关键因素,在月经周期形成过程中也具有非常重要的作用。在生理情况下,子宫内膜PGF2α的分泌是月经周期中导致黄体退化的始动因素[9],黄体退化过程中PGF2α的异常调控可能是PD发病的重要原因。研究发现,OT、TNF-α参与黄体退化过程中PGF2α的调控[6,10]。OT在非孕子宫是重要的PGF2α分泌信号[11]。在黄体溶解前,卵巢的TNF-α溶基因表达及其释放出现急剧增加[12]。因此,OT与TNF-α均与月经期子宫内膜PGF2α的表达密切相关。在应激条件下,这些活性物质的增加可能会导致月经期子宫内膜PGF2α分泌的异常增加,从而引发痛经。尽管目前没有发现AVP对黄体退化及/或PGF2α生成有明确影响,但AVP与PD的关系十分密切[13],因此本实验将其也作为观察对象。
葛根汤出自张仲景的《伤寒论》,由葛根、麻黄、桂枝、芍药、甘草、生姜、大枣等7味药物组成。实际上,该方是由桂枝汤加葛根、麻黄而成。桂枝汤可以解肌发表、调和营卫,用于外感风寒表虚之证,而加入麻黄增强散寒解表作用,葛根增强解肌散寒功效,使处方转而治疗外感风寒表实证,其突出特点是“散寒”“解肌”,因而临床广泛用于肌肉张力异常及痉挛性疾病,如颈椎病,尤其对因感受风寒诱发或加重者疗效显著。PD在中医临床上以实证居多,而实证中又以寒湿凝滞证为主[14],临床表现为极痛的患者辨证多属寒湿凝滞证或气滞血瘀证。而寒湿凝滞型PD的病机与葛根汤功效主治十分契合,因此疗效显著。葛根汤的作用机制显然与NSAIDs不同,该方在停药后数月,甚至数年都有持续的作用,说明葛根汤能够纠正PD发病的始动因素,而不是单纯地暂时抑制PGF2α的合成。目前的动物实验研究表明,葛根汤对缩宫素复合寒冷刺激诱导的寒湿凝滞型原发性痛经小鼠模型具有显著治疗作用[7,15],但葛根汤具有长期效应的机制还有待研究。
本研究采用小鼠子宫内膜行经样模型与水浸束缚应激的复合造模手段,实验结果显示,造模后小鼠阴道涂片有红细胞出现,子宫组织病理学观察显示模型组较空白对照组炎性细胞增多,血清及子宫组织PGF2α明显增高。这些发现说明本实验通过小鼠行经模型复合冷水水浸束缚手段模拟了PD患者在月经期血液及子宫组织中PGF2α异常升高的病理生理特征。同时,该模型采用冷水水浸束缚的实验方法也符合寒湿凝滞型PD病机特征。中医学认为,寒主收引,其性凝滞,导致气滞血瘀,可以引发疼痛等诸多疾病。流行病学研究表明,贪凉饮冷、受凉等是PD发病的危险因素[16]。
本研究结果表明,模型组小鼠血清及子宫组织中OT、AVP及TNF-α较空白对照组明显增高,说明这些指标水平在寒冷刺激过程中均出现增高并且可能导致PGF2α异常增加。葛根汤在显著降低小鼠PGF2α水平的同时,对OT、AVP及TNF-α水平的升高也有缓解作用,说明葛根汤可能通过调节这些活性物质的水平,抑制PGF2α的异常分泌。本实验结果有助于理解葛根汤的治疗作用,但还需要更深入研究明确其作用机制。进一步的研究可以分为两个方向:一是从细胞、分子水平对子宫内膜PGF2α异常升高的上游机制进行研究,诸如OT、TNF-α、AVP与PGF2α分泌的关系;二是从细胞、分子水平就PGF2α对子宫组织作用的下游分子机制(如PGF2α受体表达及其影响因素)进行深入研究。
