ACR TI-RADS与ATA超声模型对甲状腺良恶性结节诊断价值的比较
2020-09-09汪珺莉马千清强邦红
汪珺莉,马千清,强邦红,何 勇,张 霞
(1.芜湖市第二人民医院 超声医学科,安徽 芜湖 241000;2.皖南医学院第一附属医院 弋矶山医院 超声医学科,安徽 芜湖 241001)
2017年美国国立综合癌症网络发布的甲状腺癌诊疗指南将其分为乳头状癌、滤泡状癌、Hürthle细胞癌、髓样癌、未分化癌5种类型,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)约占成人甲状腺癌的60%和儿童的全部,是甲状腺癌中最常见的病理类型[1]。直径≤10 mm的甲状腺乳头状微小癌(papillary thyroid micro-carcinoma,PTMC)的增加是PTC近年来发病率上升的主要原因[2]。PTC的预后很好,但是即使经过适当的治疗,仍有10%~20%的患者会复发,而在治疗后数年至数十年之间,仍有2%~5%的患者会发生远处转移[3]。PTC病灶的大小对其预后有着重要的影响[4]。美国甲状腺协会(American Thyroid Association,ATA)于2015年推出了对甲状腺结节进行分类的临床指南简称ATA超声模型[3];2017年,美国放射学会(American College of Radiology,ACR)以定量评分法建立甲状腺结节的危险分层系统,提出了最新版本的甲状腺影像报告和数据系统(thyroid imaging reporting and data system,TI-RADS)分类[5]。两种分类方法对于直径≤10 mm的甲状腺结节价值尚不明确,本研究回顾性分析160个结节(直径≤10 mm)的声像图特征及术后病理资料,比较两种分类方法对于甲状腺良恶性结节的诊断价值。
1 资料与方法
1.1 一般资料 选取2018年7月~2019年12月134例在芜湖市第二人民医院检查发现的甲状腺结节并手术的患者,共160个甲状腺结节,均由病理证实。男21例,女113例,年龄24~79岁,平均(49.55±10.20)岁,结节最大直径3~10 mm,平均(6.56±1.86)mm。对所有结节使用两种方法进行分类。
1.2 仪器与方法 仪器选用GE VOLUSON S8、Philip EPIQ5、Siemens AcusonS2000等,探头频率为7.5~13.0 MHz。测量结节的大小,并观察及记录结节的结构、回声、形态(垂直位或水平位)、边缘、局灶性强回声等。其中有多个结节的,声像图相似者则取其最大结节进行分析;若各结节声像图特征不同,则将结节分开分析,并根据ACR TI-RADS及ATA超声模型进行分类。ACR TI-RADS根据结节的结构、回声、形态、边缘、局灶性强回声的不同,分别赋值0~3分,并将结节的分值相加根据ACR TI-RADS评分进行分类:TR1,总分=0分;TR2,总分=2分;TR3,总分=3分;TR4,总分=4~6分;TR5,总分≥7分。ATA超声模型将甲状腺结节分为5类:①高度可疑恶性。实性低回声结节或部分囊实性结节的实性部分包含以下至少一个超声特征:边界不规则(浸润性、小分叶或毛刺)、微钙化、纵横比>1、边缘钙化中断伴软组织成分突出、甲状腺外侵犯。②中度可疑恶性。低回声实性结节,边界平滑,无微钙化、甲状腺外侵犯或纵横比>1。③低度可疑恶性。等回声或高回声实性结节,或部分囊性结节含偏心实性成分,无微钙化、边界不规则、甲状腺外侵犯或纵横比>1。④极低度可疑恶性。海绵状或部分囊实性结节无任何上述可疑的超声特征。⑤良性。单纯性囊肿(无实性成分)。
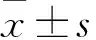
2 结果
2.1 患者病理结果 本研究共收集134例患者,160个甲状腺结节。其中甲状腺乳头状微小癌110个,结节性甲状腺肿20个,结节性甲状腺肿伴局部滤泡上皮乳头状增生12个,结节性甲状腺肿伴纤维化3个,结节性甲状腺肿伴腺瘤样结节形成8个,桥本甲状腺炎2个,纤维钙化性结节1个和亚急性肉芽肿性甲状腺炎4个。
2.2 患者甲状腺结节一般资料对比 结果显示,良性结节患者的平均年龄高于恶性结节患者,差异有统计学意义(P<0.05);两组患者在性别、结节最大直径上差异无统计学意义(P>0.05)。见表1。
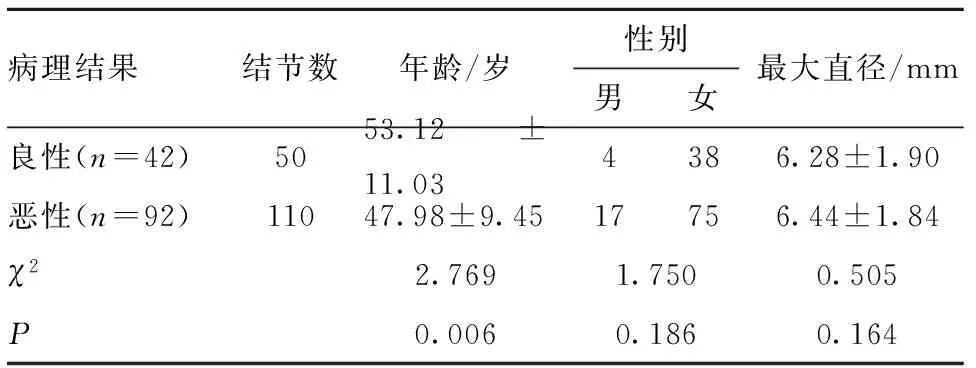
表1 甲状腺结节的一般资料对比
2.3 患者甲状腺结节的超声检查特征性指标 结果显示,恶性结节在结构、回声、形态、边缘、局灶性强回声的构成比例与良性结节间差异均有统计学意义(P<0.05)。见表2。
2.4 ACR TI-RADS分类与ATA超声模型诊断结果与病理结果对比 结果显示,ACR TI-RADS分类与ATA超声模型诊断结果及病理检查结果均呈正相关(rs=0.454和0.356,P=0.000)。见表3。
2.5 ACR TI-RADS与ATA超声模型两种分类对于甲状腺良恶性结节判断比较 结果显示,ACR TI-RADS判断最佳截止值为评分7分(TR5类)的结节,其灵敏度84.5%、特异度58.0%、阳性预测值81.6%、阴性预测值63.0%、准确率76.3%,曲线下面积(AUC)为0.713;ATA超声模型判断最佳截止值为高度可疑恶性结节,其灵敏度90.9%、特异度38.0%、阳性预测值76.3%、阴性预测值65.5%、准确率74.4%,AUC为0.645。ACR TI-RADS特异度高于ATA超声模型,差异有统计学意义(χ2=4.006,P=0.045);两种检测方法在灵敏度、阳性预测值、阴性预测值、准确率和AUC上差异无统计学意义(χ2=2.069,P=0.150;χ2=1.002,P=0.317;χ2=0.047,P=0.828;χ2=0.151,P=0.697;Z=0.991,P=0.294)。见表4和图1。
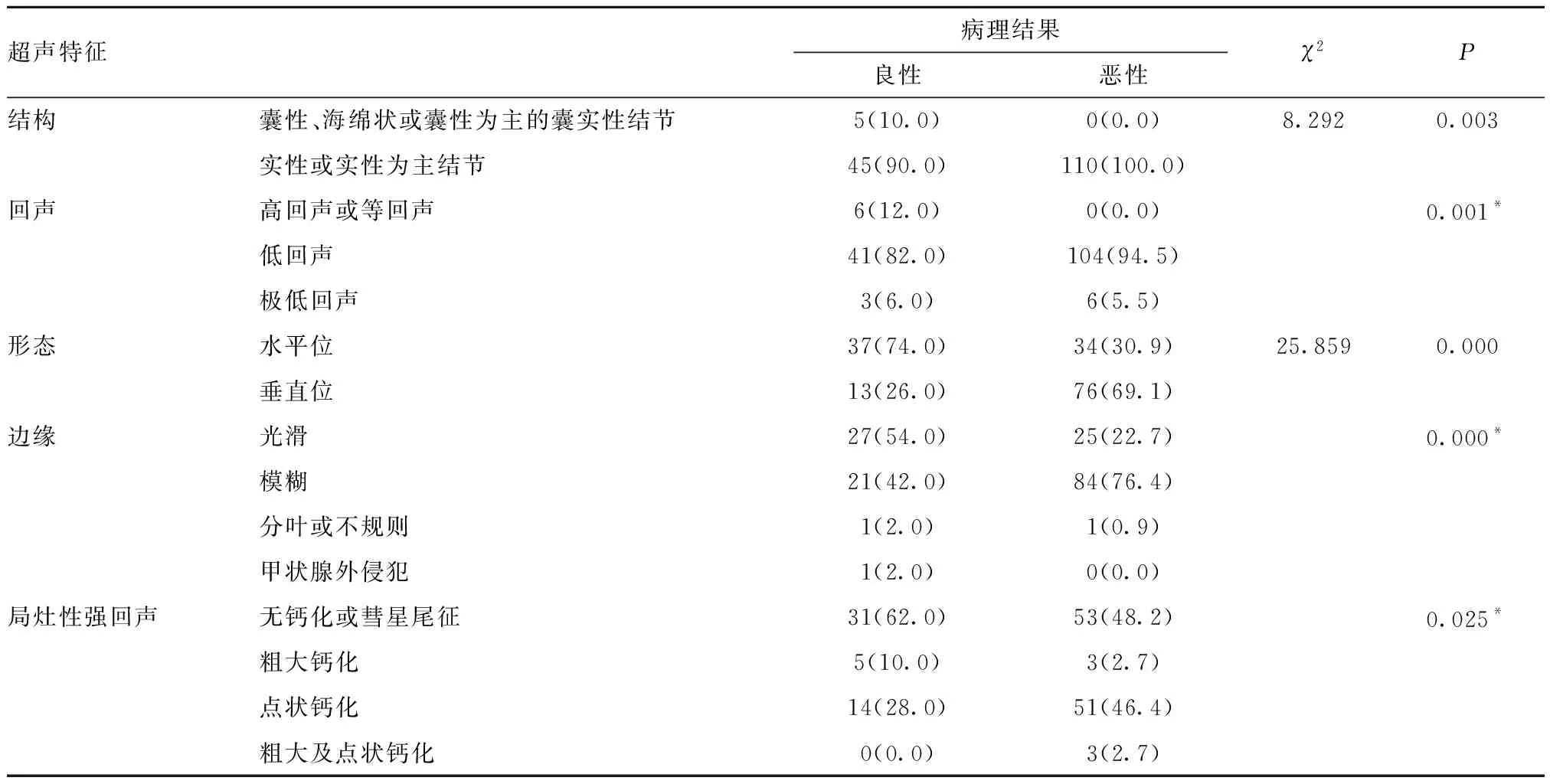
表2 甲状腺结节超声特征性指标对比[n(%)]
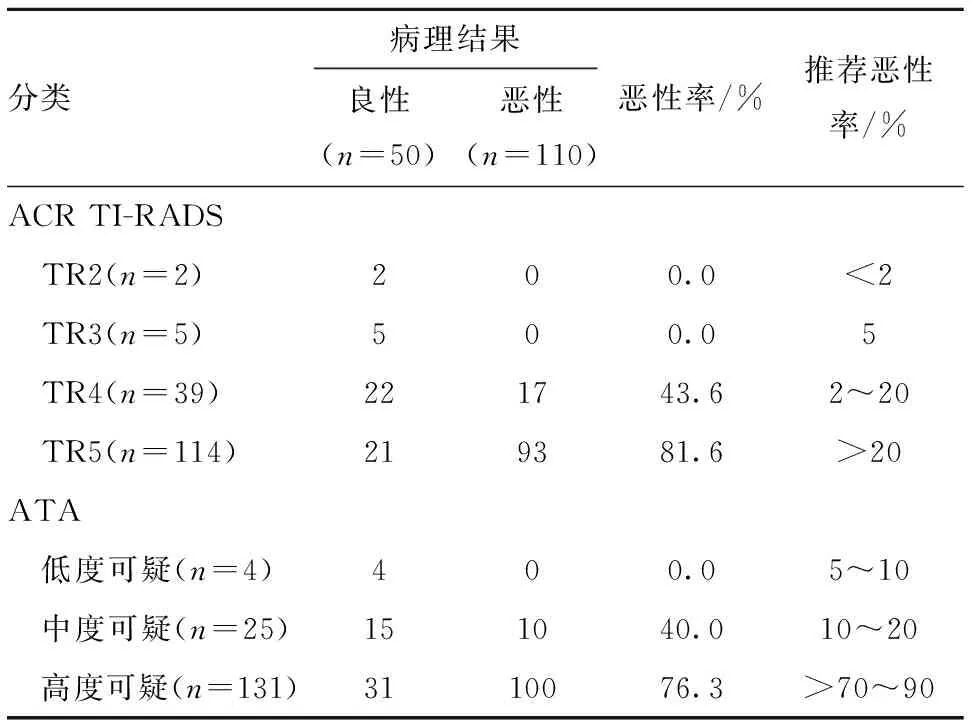
表3 ATA超声模型与ACR TI-RADS分类诊断结果与病理结果对比
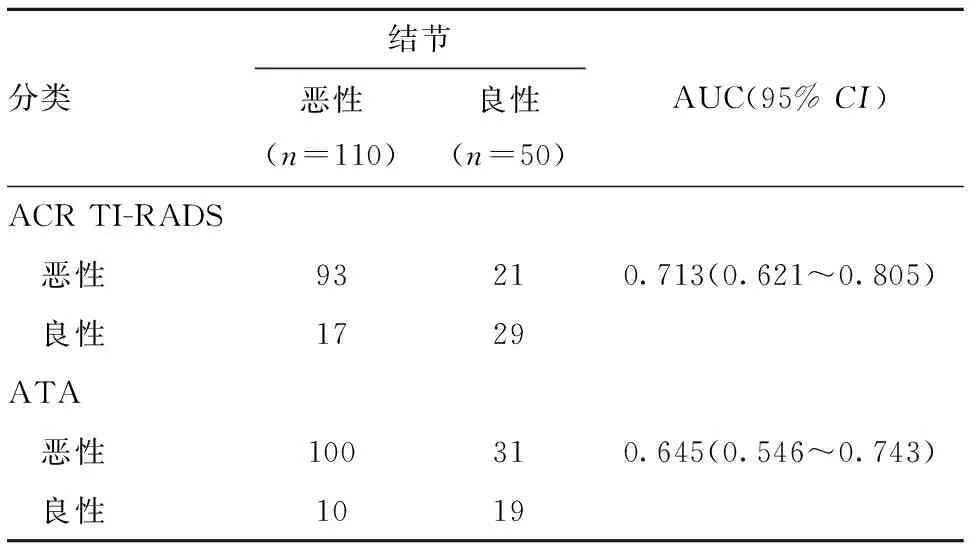
表4 ACR TI-RADS与ATA超声模型分类诊断结果
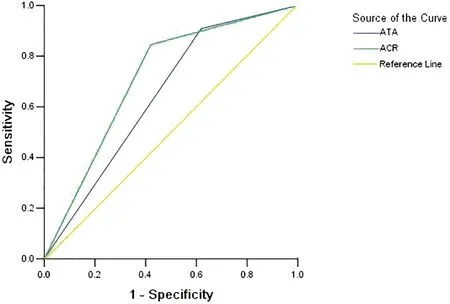
图1 ACR TI-RADS、ATA超声模型的ROC曲线比较
3 讨论
甲状腺恶性结节的复发率与结节的大小密切相关,有研究表明,直径>10 mm的甲状腺乳头状癌复发率明显增加[6],甲状腺乳头状癌的早期发现与诊断有着重要的意义,超声是目前甲状腺疾病首选的影像学检查方法。ATA超声模型与ACR TI-RADS是目前常用的对甲状腺结节危险分层的两种方法,但对于直径≤10 mm的甲状腺结节诊断价值尚不明确。故本研究主要比较这两种分类方法对直径≤10 mm甲状腺结节的诊断效价。
本研究中纳入患者134例,160个结节,良性结节的平均年龄高于恶性结节的平均年龄,与Shayganfar等[7]研究结果相同,其研究发现结节的大小与恶性率呈反比,本研究中也发现良性结节的直径大于恶性结节,但差异无统计学意义(P>0.05),可能由于本研究中结节直径均≤10 mm,在较小的结节中,结节的大小不能被作为结节良恶性的风险预测。
结节的结构、回声、形态、边缘、局灶性强回声对于甲状腺结节良恶性判断差异均有统计学意义(P<0.05)。本研究使用ACR TI-RADS分类TR2、TR3、TR4、TR5类甲状腺结节恶性率分别为0.0%、0.0%、43.6%、81.6%,ACR TI-RADS相应的推荐恶性率分别为<2%、5%、2%~20%、>20%。使用ATA超声模型低度可疑、中度可疑、高度可疑甲状腺结节的恶性率分别为0.0%、40.0%、76.3%,ATA超声模型相应的推荐恶性率分别5%~10%、10%~20%、>70%~90%。ACR TI-RADS分类中TR 4类的恶性率及ATA超声模型中度可疑的恶性率较推荐的明显增高,分析其原因可能因为本组是经过高度筛选过的甲状腺结节,这些结节虽小但具有高度可疑的恶性征象,所以选择外科手术治疗。
与其他研究结果相似[8-9],ATA超声模型最佳截止值为高度可疑恶性结节,ACR TI-RADS最佳截止值为评分7分(TR5类)的结节。有研究认为ATA超声模型及ACR TI-RADS对于甲状腺结节危险分层的效能相当[10]。本研究中发现两种分类方法对于直径≤10 mm甲状腺结节良恶性判断价值也相当,AUC分别为0.645、0.713(与付鹏等[11]研究结果相近),差异无统计学意义(P>0.05)。但ACR TI-RADS特异度高于ATA超声模型(P<0.05),两种分类方法在灵敏度、阳性预测值、阴性预测值、准确率方面差异无统计学意义(P>0.05)。
本研究中存在一些局限性,由于单纯囊性结节及囊性为主的囊实性结节恶性率极低,本研究中没有相关的手术病例,因此没有ATA超声模型分层为良性、极低可疑组结节以及ACR TI-RADS分类为TR1、TR2类结节。另外在ATA超声模型的危险分层中,有一类不确定结节,是指由于表面钙化而无法判断内部结构的结节,本研究中无此种结节,但有研究表明直径<10 mm的不确定结节的恶性率可高达64.3%[12]。
ATA超声模型与ACR TI-RADS两种分类方法对于甲状腺结节良恶性判断均有一定的价值,ACR TI-RADS对结节评分的方法能提供更客观的评价,特异度高于ATA超声模型。超声造影及弹性成像等新技术的发展为甲状腺结节的诊断提供了更多的方法,减少了不必要的外科治疗。
