贝伐单抗联合小梁切除术与全视网膜光凝术治疗新生血管性青光眼疗效对比研究*
2020-09-09于敬妮
张 璐,于敬妮
西安市第四医院眼科(西安710004)
新生血管性青光眼(Neovascular glaucoma,NVG)多是因眼后节缺氧或局部性的眼前节缺氧,使虹膜异常血管增生而导致的,与视网膜中央静脉阻塞、糖尿病视网膜病变等因素有关,患者多表现为眼痛、畏光等症状[1]。NVG会导致患者眼压持续升高及角膜水肿,严重影响了对原发病的检查和治疗,并且眼部的炎症充血状态也会增加手术失败的风险性,故常在术前给予贝伐单抗等抗血管内皮生长因子药物治疗,可降低眼内压,促进手术的顺利进行[2]。目前常采用小梁切除术及全视网膜光凝术(Panretinal photocoagulation,PRP)治疗NVG,小梁切除术可改变房水屏障,通过释放房水起到降低眼压的作用;PRP可造成血管内栓塞,引起血管壁收缩,减少血管渗漏[3]。本研究通过对比贝伐单抗联合小梁切除术与贝伐单抗联合PRP治疗NVG的临床疗效,为NVG的治疗提供理论依据,现报告如下。
资料与方法
1 一般资料 经我院伦理委员会审核通过,选取2017年7月至2019年7月在我院眼科治疗的NVG患者94例,采用简单抽样法将其分为对照组和观察组,每组47例。对照组中男27例,女20例;年龄46~81岁,平均(61.27±7.15)岁;NVG分期[4]:Ⅱ期33例、Ⅲ期14例;眼压42~62 mmHg,平均(50.12±4.86)mmHg;青光眼47眼。观察组中男28例,女19例;年龄45~83岁,平均(62.73±7.22)岁;NVG分期:Ⅱ期31例、Ⅲ期16例;眼压40~63 mmHg,平均(50.34±4.91)mmHg;青光眼47眼。两组患者上述资料对比无统计学差异(P>0.05)。病例纳入标准:①符合《中华眼科学》[5]关于新生血管性青光眼的诊断标准;②患者知情同意且签署同意书;③经眼底荧光素血管造影发现视网膜或虹膜存在明显新生血管;④单独注射贝伐单抗治疗效果不理想者。排除标准:①严重心肝肾功能异常者;②既往有青光眼手术史者;③存在小梁切除术及PRP术治疗禁忌证者;④严重糖尿病患者;⑤晶体混浊或玻璃体积血严重患者;⑥严重凝血功能异常者;⑦玻璃体受损患者。
2 治疗方法 ①观察组球内注射贝伐单抗后给予小梁切除术治疗,应用开睑器开睑,取无菌针头,抽取贝伐单抗眼用注射液(批号S20120069),更换药品专属注射针头,于角膜后缘3.5~4 mm处进针,对准眼球中心,深度为6~8 mm,注射完成后将针头拔出,用棉签按压注射部位30~60 s,密闭巩膜进针点,同时行房水穿刺,抽取房水以降低眼压,于注射贝伐单抗一周后,虹膜面新生血管消退后行小梁切除术治疗,局部浸润麻醉,弧形剪开球结膜,虹膜表面止血后作以角膜缘为基底的3 mm×4 mm的虹膜瓣,应用粘弹剂保护周围结膜及角膜,用乳酸钠林格注射液(国药准字H12021182)冲洗球结膜囊及瓣下巩膜面,于角膜缘行前房穿刺,释放房水以降低眼压,然后切除巩膜瓣下的小梁组织1 mm×2 mm,并行虹膜根切除术,缝合球结膜,于前房注射乳酸钠林格注射液,在球结膜瓣处无渗液后结束手术。②对照组于注射贝伐单抗后给予PRP术治疗,贝伐单抗注射方法与观察组相同,于眼压下降且角膜透明后行PRP术治疗,分3~4次完成,每次间隔7 d,周边及中周部光斑大小为200~300 μm,能量为150~250 mW,后极部光斑大小为5~15 μm,能量为100~150 mW,曝光时间为0.1~0.15 s,总光凝点为1200~1800个。
3 观察指标 ①疗效:于术后2个月根据患者临床症状及眼压改善情况判断治疗疗效[6],分为显效、有效、无效。患者眼痛、畏光等临床症状完全消失,眼压稳定,新生血管消失,术后无需服用抗青光眼药物为显效;患者眼痛、畏光等症状得到明显改善,眼压基本稳定,新生血管明显减少,仍需服用少量抗青光眼药物为有效;患者眼痛、畏光等症状无改善或加重,眼压不稳,新生血管未减少或增多,术后仍需服用大量抗青光眼药物为无效。②比较两组术前及术后15 d、1个月眼压、神经纤维层厚度、视野缺损值:使用非接触式眼压计测量患者眼压,应用光学相干断层扫描测量绕视盘中心3.45 mm直径的视网膜神经纤维层厚度及视野缺损情况。③视力恢复情况:应用国际标准视力表检测患者术前及术后1个月的视力[7]。提高为视力术后1个月较术前提升2行及以上;不变为视力变化1行内;减退为视力术后1个月较术前下降2行及以上。④比较两组手术前后视网膜静脉循环时间及虹膜新生血管消退时间:应用荧光血管造影检测患者视网膜静脉循环时间,应用裂隙灯显微镜观察患者虹膜新生血管消退情况。⑤术后并发症:比较两组角膜水肿、前房积血、前房纤维渗出、晶状体浑浊加重等并发症发生情况。

结 果
1 两组治疗总有效率比较 观察组治疗总有效率高于对照组(P<0.05),见表1。
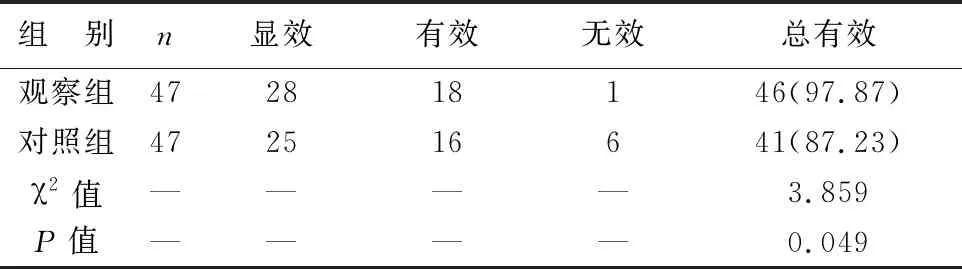
表1 两组治疗总有效率比较[例(%)]
2 两组手术前后眼压、神经纤维层厚度、视野缺损值比较 两组术后15 d、1个月的眼压均低于术前,且观察组低于对照组(P<0.05);两组术后15 d、1个月的神经纤维层厚度均大于术前,且观察组大于对照组(P<0.05);两组术后15 d、1个月的视野缺损值均小于术前,且观察组小于对照组(P<0.05)。见表2。
表2 两组手术前后眼压、神经纤维层厚度、视野缺损值比较
3 两组视力改善情况比较 观察组视力提高率高于对照组(P<0.05),见表3。
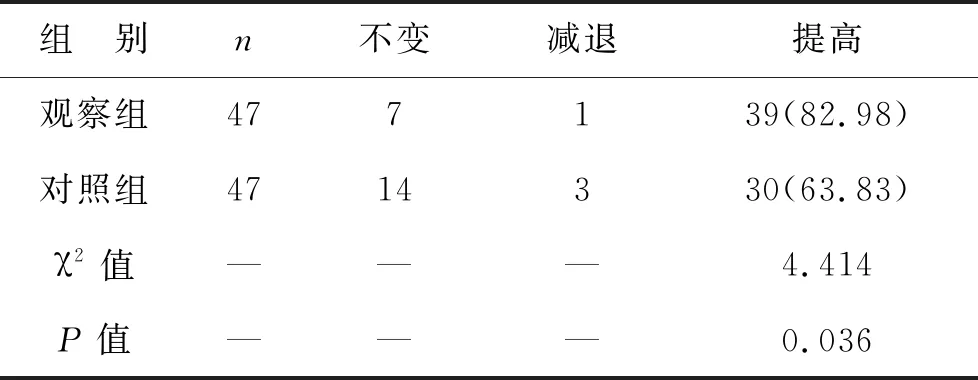
表3 两组视力改善情况比较[例(%)]
4 两组手术前后视网膜静脉循环时间及虹膜新生血管消退时间比较 两组术后1个月视网膜静脉循环时间均短于术前,且观察组短于对照组(P<0.05);术后1个月观察组虹膜新生血管消退时间短于对照组(P<0.05)。见表4。
表4 两组手术前后视网膜静脉循环时间及虹膜新生血管消退时间比较
5 两组术后并发症发生情况比较 观察组并发症发生率低于对照组(P<0.05),见表5。
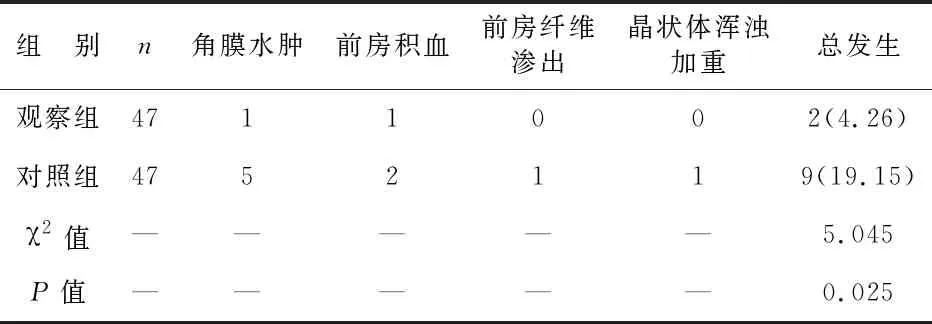
表5 两组术后并发症发生情况比较[例(%)]
讨 论
NVG患者多眼压过高,常伴有角膜水肿、虹膜新生血管、不同程度的房角内粘连等症状。有报道指出,NVG的形成会导致患者视力下降,具有较强的破坏性和较高的致盲率[8]。Kabesha 等[9]研究发现,对NVG患者给予贝伐单抗联合小梁切除术治疗,可提高视力,降低致盲的危险性。在术前给予贝伐单抗治疗,可减少虹膜和前房角的新生血管,降低术中出血量,促进手术的进行,小梁切除术是在角膜缘建立一条房水引流通道,将房水引流至球结膜下间隙,以起到降低眼压的作用,可延缓视网膜病变程度,进而可保护视功能,提高视力[10]。本研究中,观察组治疗总有效率、视力提高率高于对照组,虹膜新生血管消退时间短于对照组,说明应用贝伐单抗联合小梁切除术治疗NVG有效率高,可提高患者视力,缩短虹膜新生血管消退时间。Wang等[11]对NVG患者给予贝伐单抗及小梁切除术联合治疗,证实了该治疗方式可有效改善患者视力,与本研究结果相同。
NVG主要是因视网膜缺血后损伤的血管壁释放血管内皮生长因子(VEGF),使视网膜、虹膜和房角新生血管形成,导致周边虹膜和小梁网组织粘连,引起眼压升高[12]。目前临床上常采用抗VEGF治疗NVG,但有研究发现,单纯应用抗VEGF治疗NVG有效率低,部分患者的眼压在新生血管消退后并没有得到有效控制,故需要进一步进行手术治疗[13]。相关报道指出,对NVG患者给予贝伐单抗联合小梁切除术治疗,可有效降低患者血压[14]。本研究发现观察组术后15 d、1个月的眼压均低于对照组,对NVG患者给予贝伐单抗联合小梁切除术治疗,降眼压效果较好,这主要是因为在注射贝伐单抗后给予小梁切除术治疗,可抑制成纤维细胞增殖,促进滤过泡的形成,促进房水释放,进而可降低眼压。
NVG的发生与缺血性视网膜静脉阻塞、增生型糖尿病视网膜病等原发病有关,虹膜和房角的新生血管持续增生,跨越前房角,会阻碍房水排出,使房角关闭,抑制视网膜血液循环,使视网膜静脉阻塞,加重视网膜缺氧程度[15-16]。注射贝伐单抗可降低眼压,给予小梁切除术治疗可促进房水释放,有效抑制新生血管生成,改善视网膜血液循环,减轻视网膜缺氧严重程度,进而可改善视网膜功能[17]。本研究中,观察组术后1个月的视网膜静脉循环时间短于对照组,神经纤维层厚度大于对照组,视野缺损值小于对照组,说明应用贝伐单抗联合小梁切除术治疗,可促进视网膜血液循环,改善视网膜功能。另外,本研究发现,给予贝伐单抗联合小梁切除术治疗的观察组并发症发生率低于给予贝伐单抗联合PRP治疗的对照组,说明应用贝伐单抗联合小梁切除术治疗,可降低患者角膜水肿等并发症发生率,与吴超琼等[18]研究结果相同,这主要是因为贝伐单抗联合小梁切除术治疗可释放房水,降低眼压,且巩膜板层覆盖引流口,可防止房水过多流出,可在一定程度上减少术后低眼压的出现,进而可降低术后并发症的发生率[19]。
综上所述,相比于贝伐单抗联合PRP治疗,应用贝伐单抗联合小梁切除术治疗NVG有效率高,可提高患者视力、降低眼压、改善视网膜功能、减少并发症的发生。
